浅析独立第三方开展临床研究中心稽查的工作程序
文/蔡绪柳 金迪蒂 张馨元 郝华珍
临床试验是保证药品医疗器械安全性、有效性最重要的阶段。临床试验周期较长,涉及多个相关方:医药企业、医药研发合同外包服务机构(CRO)、研究机构、研究机构现场管理组织(SMO)、数据管理与统计单位、中心实验室、中心影像、生物样本运输单位等等,试验管理复杂,不确定因素较多,试验过程中需要持续保证临床试验的质量。监查、稽查和视察是保证临床试验质量的三个重要手段。根据ICH E6(R2),稽查是对临床试验的所有行为和相关文件进行系统的、独立的核查,以判定试验的实施过程和试验数据的记录、分析与报告是否与试验方案、标准操作规程(SOP)、药物临床试验质量管理规范(GCP)以及现行的相关法律法规的要求相符[1][2][3]。
实际上可以看到,临床试验稽查的独立性要求,与第三方的独立属性完全契合,由独立第三方行使稽查的职责能够更好地发挥稽查保证临床试验质量的作用。我国开展药物临床试验核查以来,医药行业的质量意识有了明显的提升,但是临床试验质量仍有待提高。分析原因,一个重要的方面是由于医药企业或者CRO自身无法保证稽查的独立性,导致无法客观真实地发现临床试验过程中的质量问题,未能及早采取纠正预防措施。同时,随着政策法规对于创新药开发的大力促进,临床试验行业迅猛发展,越来越多中小型研发企业参与到药品器械研发中,然而受研发资源和人才培养的限制,多数企业内部没有能力设置专门的稽查团队,使质量管理领域的分工细化和第三方稽查的参与成为趋势。
近两年,国内临床试验严格监管日趋常态化,涌现出了较多第三方稽查主体,包括单人模式的第三方稽查、多人组成的第三方稽查团队以及规模化的第三方稽查公司。鉴于第三方稽查是保证临床试验质量的重要手段,因此有必要对专业第三方稽查公司的工作模式、工作内容等进行探讨,以推动第三方稽查行业的规范,真正发挥临床试验质量保证的作用。
1 第三方稽查介绍
参考国际第三方稽查的发展情况,医药领域的第三方稽查可全面覆盖GCP/GLP/GMP/GPvP等各细分领域的GxP合规检查。2017年中办、国办发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》提出,可委托第三方对临床试验机构进行评估。2018年原国家食品药品监督管理总局办公厅公开征求意见的《药品检查办法(征求意见稿)》中提到,可委托第三方对药品生产企业的质量管理体系进行评估。根据临床试验的需求,结合法规政策和行业发展趋势,以下将对第三方稽查的基本原则、涉及的主要稽查类型作简单介绍。
1.1 第三方稽查的基本原则
由于临床试验的特殊性,独立第三方开展稽查工作,应遵循两大基本原则:①独立性原则,稽查人员身份独立,依据稽查计划独立开展工作,在充分沟通的基础上稽查得出的专业判断和意见不受任何组织或个人干预。②保密性原则,对稽查过程中所接触的有关试验信息和数据、项目信息、企业信息、机构信息、供应商信息等资料,不得随意向外泄露。在相关的稽查记录、稽查报告中也应注意采取保密措施,防止这些信息泄露。
1.2 第三方稽查的主要类型
1.2.1 临床试验启动、设计阶段
临床试验启动、设计阶段的第三方稽查,主要包括研究中心机构评估、供应商评估、临床试验方案评估、申办方质量体系评估、和/或试验用药品代生产商(OEM)评估等。
研究中心机构评估,评估临床研究科室及辅助支持科室,是否具备完备的质量管理系统,及该研究中心的项目实施能力(如临床试验机构是否有良好的医疗设施、实验室设备、人员配备,以确保受试者的安全)。
供应商评估,主要是评估供应商的质量管理系统,以及项目实施能力,支持供应商的选择,比如中心实验室、生物样本分析检测机构、数据管理与统计分析单位、CROSMO。
申办方质量体系评估,评估其质量管理系统是否具有完备的流程,用以支持药品或器械能持续的满足质量要求,实现高质量的产出、有效的风险管理及持续改进。
1.2.2 临床试验实施阶段
临床试验实施阶段的第三方稽查,主要包括研究中心现场稽查、生物样本检测现场稽查、数据管理与统计现场稽查、临床试验用药品生产现场稽查,根据试验进度和稽查的目的,可以在临床试验实施的不同阶段引入第三方稽查。
1.2.3 临床试验结束阶段和注册阶段
临床试验结束阶段的第三方稽查,主要包括临床试验数据自查、临床试验现场核查前准备、临床试验现场核查模拟、临床试验现场核查问题调查、生产现场检查模拟。
1.2.4 上市/批量生产阶段
药品上市后的第三方稽查,主要包括上市后再评价研究的稽查、GMP跟踪检查模拟、药品飞行检查模拟等。
以下将对GCP领域临床研究中心第三方稽查的工作程序进行介绍。
2 临床研究中心第三方稽查的工作程序
2.1 稽查启动
在了解任何试验保密信息前,双方应签署保密协议。第三方稽查将根据委托方的实际需求开展工作,稽查方应根据临床试验的基本信息(分期、适应证领域、实际进度等)了解委托方的稽查目的、期望和拟解决的问题,在充分沟通需求之后确定稽查范围。
合同签署后,稽查委托方需提供项目相关资料,提供的资料应包括但不限于试验方案、研究者手册、法规部门/伦理委员会批准文件等,用于稽查方制定有针对性的稽查计划,组建专门的稽查团队。
2.2 稽查前准备
2.2.1 制定稽查计划
稽查计划应由稽查方拟定,实施前应获得委托方(申办方/CRO/机构)审阅和批准,通过对稽查计划的充分沟通,保证稽查方与委托方对稽查实施有一致的理解。一份完整的稽查计划应涵盖的信息,包括但不局限于项目概况、项目目的、稽查要点分析、稽查实施计划、项目人员、沟通计划、稽查对象、稽查范围、稽查时间点、稽查组成员信息、稽查依据、稽查报告需要递交的人员、稽查报告的时限等内容。
其中稽查要点分析的制定,应充分结合试验的类型和复杂程度、该试验用于药品评价的重要性、适应证风险、研究中心的风险、以及任何项目已知的问题[1-6],通过稽查要点实现稽查覆盖研究中心的风险点。为保证稽查实施的范围,笔者所在的第三方稽查公司参考EMA的做法,结合ICH E6 (R2)、中国GCP以及CFDA发布的临床试验现场核查要点,以做好一项临床试验为目标,对临床试验涉及的内容和要求进行整理,总结成13个模块:试验用药品/器械、设备设施、生物样本和实验室、实验管理(申办方/CRO职责)、质量管理体系(QMS)、监管部门和伦理、源文件管理、计算机化系统、数据管理与统计、方案依从性、受试者保护、知情同意、药物安全与警戒,和质量要求七性:真实性、可靠性、完整性、有效性、安全性、合规性、可控性,详见图1。每个模块的关键环节及关键数据,都应在稽查计划中完整的体现。对临床试验质量要求七性的全面把控,也是稽查要点设计、稽查问题的定性和影响分析的重要考量。比如,可控性要求审视申办方或者CRO对临床试验的操作实施其质量体系是否是可控的,用以评估通过抽样的方式实施的稽查是否对其他未稽查数据、未稽查中心同样具备可比性。
不同种类的临床试验,进行的阶段不同、稽查的对象不同,稽查要点也相应不同。比如BE试验,对生物样本检测分析部分是需要重点关注的;Ⅰ期临床研究由于是首次人体试验,更加关注受试者的安全性数据;Ⅱ、Ⅲ期临床研究对影响安全性、有效性指标的因素会重点分析。在入组早期阶段的稽查,更侧重于发现试验设计方面和流程方面问题,试验后期更侧重于检查数据的完整可靠性。
目前国际提倡的基于风险的稽查计划,主要通过抽样的方式,根据风险来确定稽查资源。这样既可以解决稽查员资源有限的问题,还可以提高委托方在稽查方面投入的回报率。
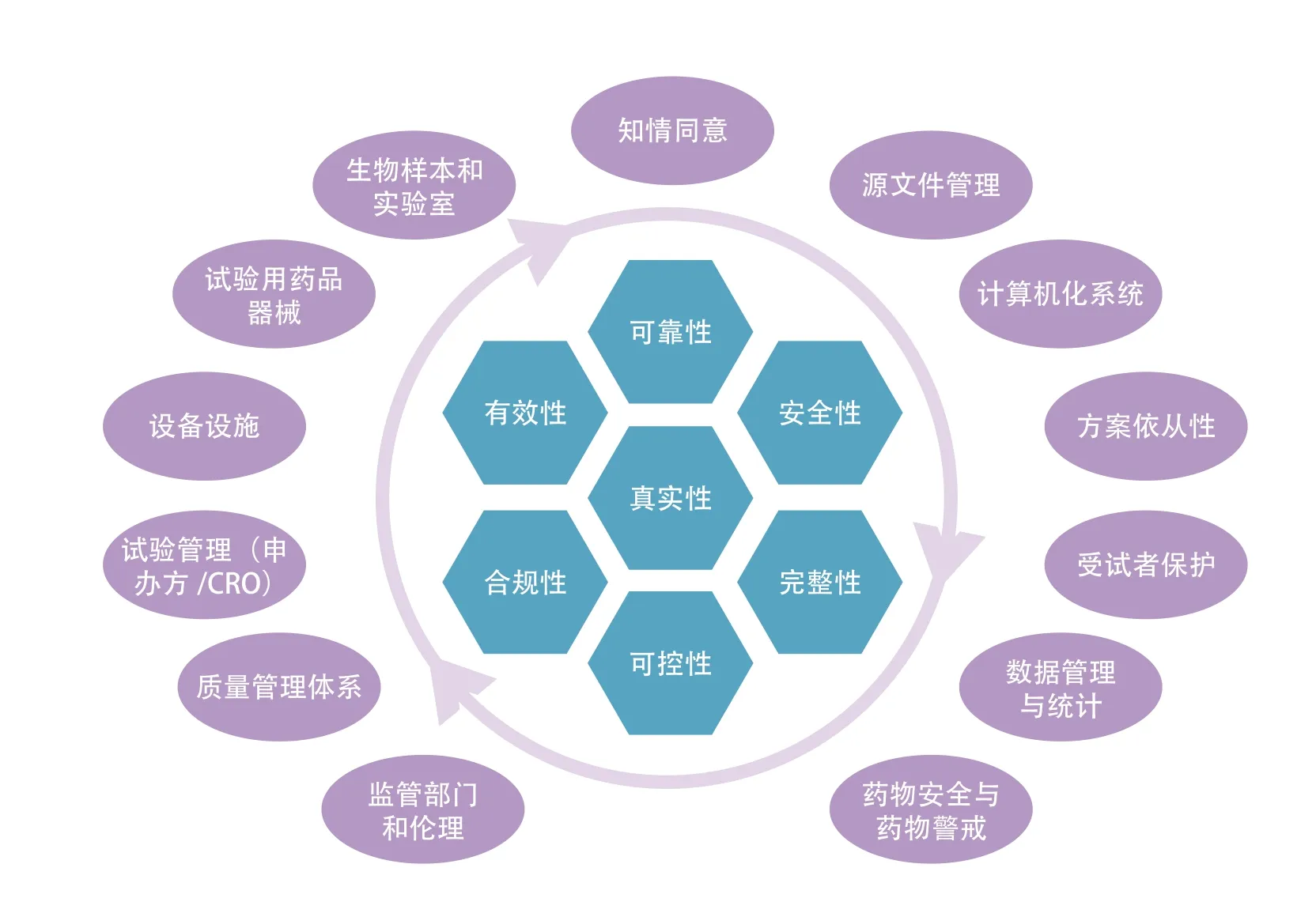
图1 GCP稽查的13个模块与质量要求的七性
2.2.2 稽查团队及稽查人员安排
为保证第三方稽查团队与委托方的沟通配合,同一项目多个中心稽查的一致性,以及同一项目涉及不同类型稽查间信息的串线核对,需要指定稽查项目经理来管理项目,搭建项目的稽查团队。常见的一个项目的稽查团队组织架构,见图2。
单中心稽查由稽查组长负责。稽查组长组建2~3名稽查员的稽查小组,负责组内的稽查任务分配。稽查员需要满足稽查员必备的通用知识(GCP法规及临床试验相关法规等)、基本的稽查技能和思维方式的训练、必要的资质评估、项目所涉及的专业领域(如肿瘤、抗菌药物、儿童药物等)知识,以及既往类似项目的稽查经验。
2.2.3 准备稽查工具
稽查工具应充分关注稽查范围内的所有要素,对每一稽查模块的关键流程及产生的关键数据应重点分析,同时可制定稽查检查清单等工具辅助稽查。

图2 稽查团队组织架构
2.2.4 稽查前培训
由稽查项目经理组织召开稽查前的方案培训和稽查计划的培训,专业医学领域的知识由外聘医学专家培训。
2.3 稽查实施
2.3.1 首次会议
首次会议由稽查组长主持。首次会议的目的是确认稽查方、被稽查方对稽查计划的安排达成一致;介绍稽查团队成员,确保稽查活动能够顺利实施。首次会议应当是正式的,应保存出席人员的记录。
2.3.2 稽查实施
按照13个模块,结合临床试验过程中产生的相关文件、设施设备、实施环境等,进行原始资料溯源、数据链、药品链、生物样本链等系统性的检查。以试验药品模块为例,应涵盖药品链从试验药品的申请、供应、运输、接收、保存、发放、配制、使用、回收及销毁的所有环节,在每一个过程中涉及的人员、设备及产生的文件均需要进行审阅核对[1][2][3],见表1。

表1 试验药品模块的稽查实施
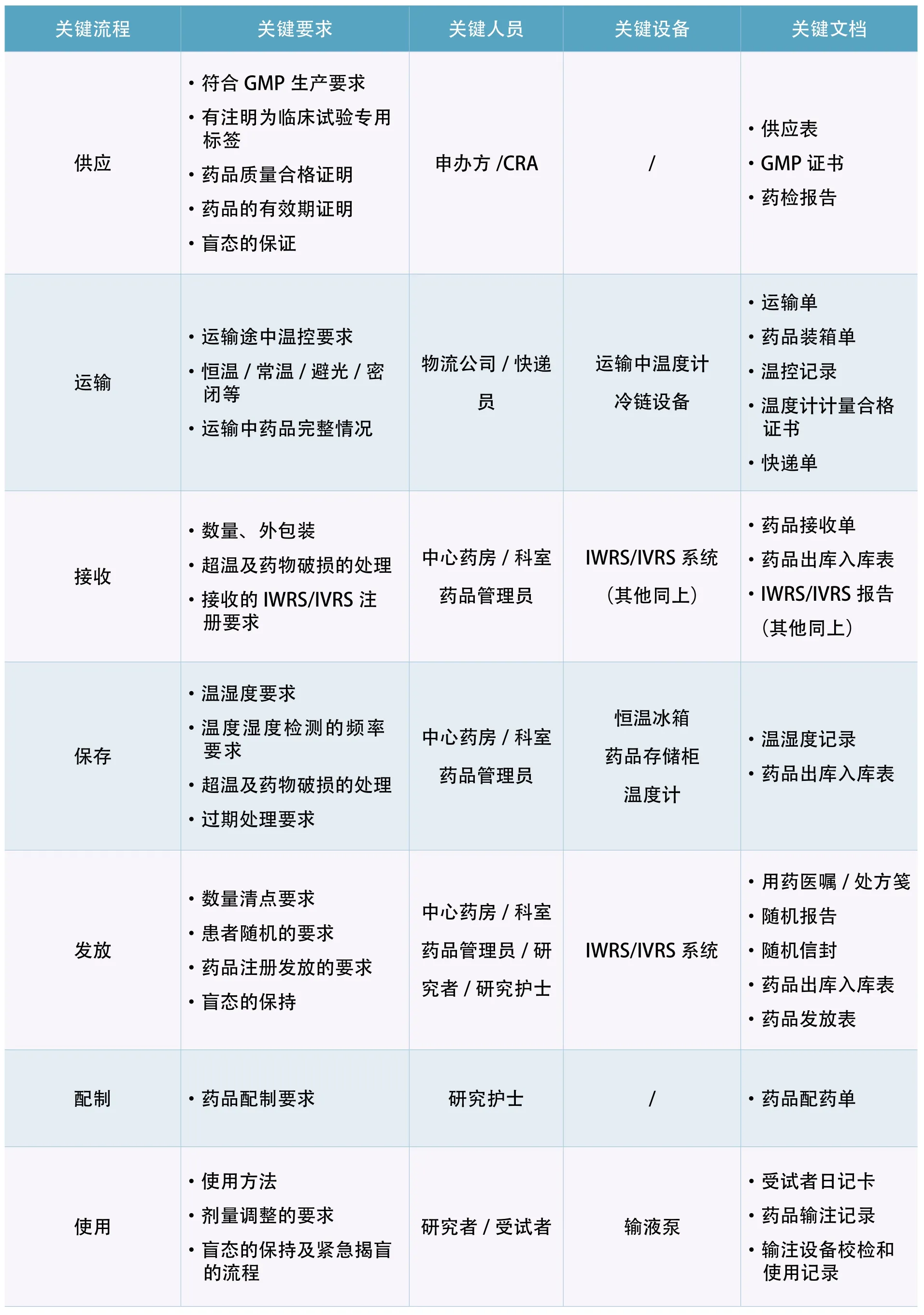
关键流程 关键要求 关键人员 关键设备 关键文档供应·符合GMP生产要求·有注明为临床试验专用标签·药品质量合格证明·药品的有效期证明·盲态的保证申办方/CRA /·供应表·GMP证书·药检报告运输·运输途中温控要求·恒温/常温/避光/密闭等·运输中药品完整情况物流公司/快递员运输中温度计冷链设备·运输单·药品装箱单·温控记录·温度计计量合格证书·快递单接收·数量、外包装·超温及药物破损的处理·接收的IWRS/IVRS注册要求中心药房/科室药品管理员IWRS/IVRS系统(其他同上)·药品接收单·药品出库入库表·IWRS/IVRS报告(其他同上)保存·温湿度要求·温度湿度检测的频率要求·超温及药物破损的处理·过期处理要求中心药房/科室药品管理员恒温冰箱药品存储柜温度计·温湿度记录·药品出库入库表发放·数量清点要求·患者随机的要求·药品注册发放的要求·盲态的保持中心药房/科室药品管理员/研究者/研究护士IWRS/IVRS系统·用药医嘱/处方笺·随机报告·随机信封·药品出库入库表·药品发放表配制 ·药品配制要求 研究护士 / ·药品配药单使用·使用方法·剂量调整的要求·盲态的保持及紧急揭盲的流程研究者/受试者 输液泵·受试者日记卡·药品输注记录·输注设备校检和使用记录
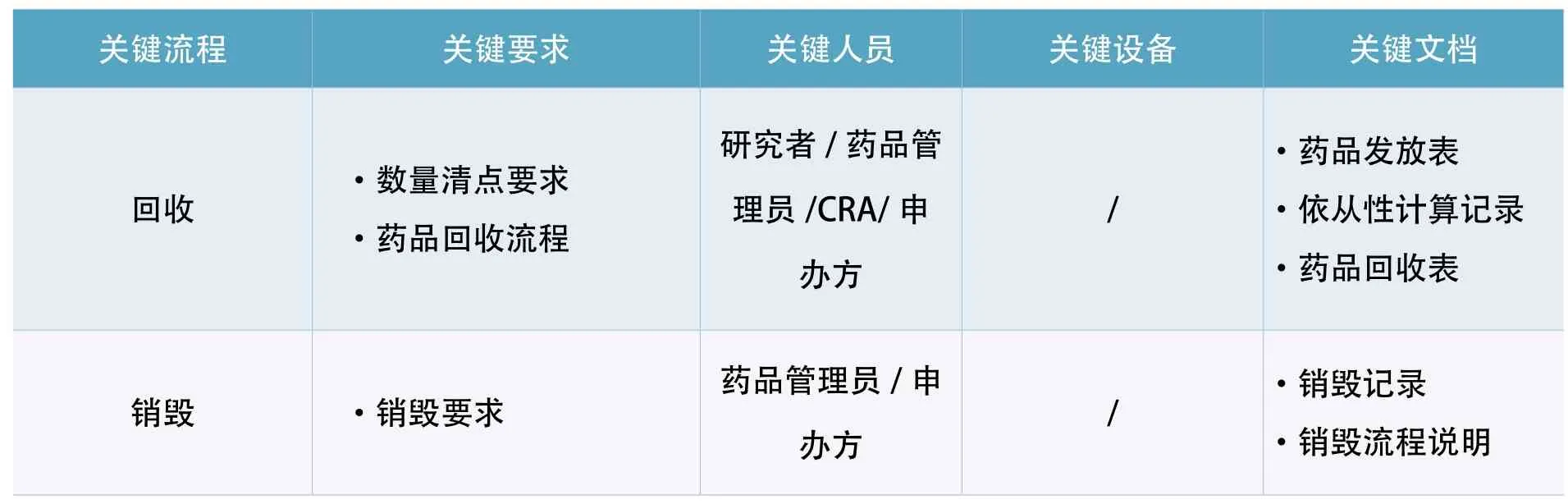
关键流程 关键要求 关键人员 关键设备 关键文档回收 ·数量清点要求·药品回收流程研究者/药品管理员/CRA/申办方/·药品发放表·依从性计算记录·药品回收表销毁 ·销毁要求 药品管理员/申办方 / ·销毁记录·销毁流程说明

图3 收集和验证稽查发现的过程
2.3.3 信息的收集和验证
收集信息的方法主要包括文件记录、观察、访谈,收集和验证信息的过程[7],见图3。
研究中心稽查期间,当有疑问时需要对研究者、研究护士、药品管理员等研究团队成员进行访谈,了解临床试验实施的流程是否符合项目和法规要求、实施情况与文件记录的一致性、对重要稽查发现通过访谈挖掘问题的根源、将稽查发现与责任人确认核实。
2.3.4 末次会议
末次会议由稽查组长主持,参加人员包括临床研究者、研究团队成员、CRACRC及申办方代表,药物临床试验机构管理者可选择参加。
关于稽查发现或稽查结论应与研究者进行充分的讨论,以研究者理解和认同的方式提出稽查发现和稽查结论。对稽查组与研究者之间关于稽查发现或稽查结论的分歧,应尽可能予以解决。适当时,稽查组可以与研究团队讨论纠正预防建议。
此外,末次会议应告知稽查报告提交的方式、方法和时限,以及对于任何相关的稽查后续活动(例如纠正预防措施的制定)的安排。
2.4 稽查报告的撰写
研究中心稽查完成后,根据稽查标准操作流程的规定,稽查组长应负责中心稽查报告的撰写,由指定的审核人员评审后,将定稿的稽查报告发给委托方。一般稽查报告的内容应包括:试验相关信息、稽查对象、稽查时间段、稽查范围、稽查依据、稽查结果、撰写人与审批人、报告日期等,稽查报告示例见图4。
稽查报告中有关稽查情况的概述、试验文件的列表、稽查实施的内容、稽查发现的纠正预防建议等,根据各第三方稽查公司的SOP来确定。
根据问题的重要性及影响程度,通常稽查发现会按照三个级别进行分级,重大(Critical)、主要(Major)、轻微(Minor)[8]。
①重大问题适用于当稽查问题被认为对受试者权益、安全或健康或对临床试验数据的质量和真实可靠性造成不利的影响。当发生多个主要稽查问题的集合时可能会被归类为一个重大的系统性的问题。

图4 稽查报告示例
②主要问题适用于当没有被适当的管理,稽查问题对受试者权益、安全和健康或临床试验数据的质量和真实可靠性有可能造成不利的影响。当发生多个轻微问题的集合时,可能会被归类一个主要的系统性问题。
③轻微问题适用于对质量管理体系或GCP原则的偏离,但该情况、操作或过程的偏离对受试者权益、安全和健康或临床试验数据的质量和真实可靠性均没有不利的影响。
2.5 稽查后CAPA计划的制定和审核
稽查结束后将进入纠正和预防程序,被稽查方依据稽查报告对稽查发现进行根本原因分析,制定纠正和预防措施(CAPA)计划,由稽查组长审核CAPA计划的合理性。所有双方的沟通记录及产生的文档均应保留。CAPA实施后应对CAPA的有效性进行确认,对于经验不足的被稽查方,通常也会将CAPA的有效性确认委托给稽查方。
3 讨论
随着我国对药物临床试验的监管日趋严格,申办方引入第三方稽查来评估临床试验的质量已屡见不鲜。高质量的第三方稽查,与国家现场检查程序相似,并且进一步结合了国内外稽查的新方法,能够为申办方和临床研究中心提供更早期的质量检查。第三方稽查的优势在于独立性:即身份的独立性,和开展工作的独立性,这是保证稽查客观公正的起点[9]。其次,第三方稽查公司涉及的项目范围广泛,稽查经验丰富,能够准确把握国家政策法规,给出专业的意见。此外,第三方稽查着重于发现临床试验过程中对GCP、SOPs及试验方案的遵守情况,重视问题的解决,在试验早期提早发现问题、解决问题,帮助优质药品尽早上市,减少发生药品因为临床试验的质量问题而延迟上市情况。
值得关注的是,如何保证第三方稽查的稽查员能够胜任并满足稽查领域的专业性要求,是第三方稽查面临的一个关键问题。笔者所在的第三方稽查公司也在倡导推行对稽查员进行能力考核认定评定,这种方法能否在第三方稽查行业推行尚需共同探讨。

