铁皮石斛硫氧还蛋白基因(DoTrxL2)的克隆及表达分析
范静, 毛欢, 刘楚琪, 龙涛, 周康, 王万军
(西南交通大学 生命科学与工程学院, 成都610031)
硫氧还原蛋白(thioredoxin,Trx)是生物体内广泛存在的一种调节体内氧化还原反应的重要蛋白质。Trx的分子量较小,且都具有CXXC保守基序[1-3]。在拟南芥中,根据亚细胞定位可将Trx分为f、m、h、x、y和o共6个类型,f、m、x和y型主要存在于叶绿体中[4],o型则在线粒体和细胞核中表达,而h型则在细胞质、细胞核、内质网和线粒体中均有发现[5-6];早前也有根据Trx的特异性靶酶的不同而分类,如Trxf的靶酶为果糖-1,6-二磷酸磷酸酶,Trxm的靶酶为NADP-苹果酸脱氢酶[7]等。近年在拟南芥中还发现了新的、与叶绿体发育相关的z型Trx[8],以及大量的硫氧还原蛋白类超家族成员(ThioredoxinLike,TrxL),这些超家族成员蛋白含有一个或多个Trx基序,但对其结构和功能的研究较少[7]。Trx可通过还原蛋白酶分子中的双硫键,直接参与或间接影响种子中淀粉和储存蛋白的合成与分解,从而在种子萌发初期调节胚乳中的碳氮代谢[9]。大麦种子的萌发中,Trx过量表达,可使淀粉酶活性增强,进而促进种子的萌发[10-11]。在细胞中,Trx1可以通过抑制抑癌基因PTEN(phosphatase and tensin homolog deleted on chromosome ten)活性从而抑制蛋白激酶B(protein kinase,Akt)和凋亡信号调节酶1(apoptosis signal-regulation kinase 1,ASK1),最终诱使细胞死亡;Trx1可分别激活AMP依赖的蛋白激酶[adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK]和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK),抑制细胞死亡;Trx1也可通过NF-κB途径最终抑制细胞死亡[12-15]。
铁皮石斛(DendrobiumofficinaleKimuraetMigo)是兰科石斛属多年附生草本植物,目前铁皮石斛的相关研究主要在多糖的代谢、原球茎发育、以及菌根分子相互作用等方面[16]。原球茎发育是兰科植物胚胎的特殊发育机制,本研究以铁皮石斛为材料,采用RACE技术克隆得到一个TrxL 超家族成员基因DoTrxL2,并结合生物信息软件进行蛋白特征分析和系统发育树构建,通过实时荧光定量PCR(quantitative Real-time PCR, qRT-PCR)技术分析该基因在铁皮石斛不同组织以及原球茎发育时期的表达量差异,探究DoTrxL2基因在铁皮石斛发育过程中的作用,为后续研究硫氧还蛋白基因的功能提供参考。
1 材料与方法
1.1 材料
铁皮石斛成熟种子在不含激素的1/2MS半固体培养基(1/2MS大量元素+MS微量元素及有机元素+MS铁盐)上经原球茎发育途径形成完整植株。
选取成熟种子以及培养过程中处于原球茎形成期(P1)、原分生组织形成期(P2)、顶端分生组织形成期(P3)、椭球形原球茎期(P4)、叶原基维管系统形成期(P5)、根端分生组织形成期(P6)、原球茎退化和苗的形成(P7)等7个时期的原球茎各100 mg。
选取铁皮石斛无菌幼苗在壮苗培养过程中其基部形成的类原球茎100 mg;选取长势较好、整齐一致、并具5~6片叶的新鲜幼苗,分别取其根、茎、叶组织各100 mg;选取盆栽铁皮石斛植株开花期的将要开放的全花组织100 mg。
以上所有样品均取3个平行样,取样后迅速放入液氮中速冻,然后转入-80℃保存备用。
1.2 方法
1.2.1 总RNA提取及cDNA的合成
按照Plant RNA Kit(OMEGA)方法对各铁皮石斛实验材料进行总RNA提取,并用RNase-free DNase I(TaKaRa)去除总RNA中的基因组污染。经1%琼脂糖凝胶电泳检测,选择具清晰的28S rRNA和18S rRNA条带、无弥散条带且OD260/OD280≥1.8的样品用于后续的基因克隆及荧光定量PCR。
将合格的RNA立即采用TaKaRa逆转录试剂盒获得cDNA。
1.2.2DoTRXL2基因克隆及测序
根据已经获得的铁皮石斛转录组序列用primer premier 5.0设计3′RACE巢式引物(表1),引物由上海生工公司合成。以cDNA为模版克隆,PCR反应体系为25 μL(EasyTaqDNA Polymerase 0.15 μL、正向引物1 μL、反向引物1 μL、cDNA模板1 μL、ddH2O 18.35 μL、dNTPmix 1 μL、EasyTaqbuffer 2.5 μL),扩增条件为:94℃预变性2 min;94℃变性30 s、55℃退火30 s、72℃延伸2 min;72℃再延伸5 min。产物用1%琼脂糖凝胶电泳检测,扩增所得目的片段经胶回收,pGEM-T easy载体连接,质粒转化,蓝白斑筛选并挑取单克隆并送至上海生物工程公司进行测序。根据测序所得的序列设计qRT-PCR引物用于实时荧光定量PCR实验(表1)。

表1 DoTRXL2克隆引物及qRT-PCR所用引物
1.2.3 序列分析
根据所得序列,利用BioXM软件的ORF功能预测开放阅读框;用NCBI Blastp分析其保守结构域;利用NCBI的BLAST在线分析工具选出与基因序列相近的其他物种序列,利用DNAMAN对其进行比对分析;利用Protparam软件分析DoTrxL2的理化性质;利用DNAstar软件中Protean模块对DoTrxL2进行二级结构预测。将DoTrxL2进行blastp搜索,选取与其一致性70%以上的不同植物,一共46条Trx基因,使用MEGA6的邻近法(NJ)构建进化树。
1.2.4 荧光定量PCR检测基因在不同组织和原球茎不同发育时期的表达
利用实时荧光定量PCR的方法检测DoTrxL2基因在铁皮石斛不同组织和铁皮石斛种子不同发育时期的相对表达量。通过primer premier 5.0对已得到的克隆序列设计定量引物见表1。将提取的各类cDNA按10 μL反应体系进行扩增(SYBR green 5 μL、cDNA 0.5 μL、MilliQ ddH2O 2.9 μL、引物各0.8 μL),反应体系为预变性95℃ 30 s;95℃变性5 s,60℃退火10 s,72℃延伸25 s,扩增45个循环;72℃再延伸30 s。扩增完成后运用LightCycler®96 SW 1.1软件进行误差分析,采用2-ΔΔCt分析方法对DoTrxL2进行相对定量表达分析。
2 结果与分析
2.1 DoTRXL2的克隆及序列分析
根据已经获得的DoTrxL2核心序列设计3′RACE引物(表1),进行PCR扩增,扩增结果如图1。将测序后的序列在NCBI数据库中进行Blast分析,验证了所得基因序列为DoTrxL2的cDNA完整序列。其中开放阅读框(ORF)长度为639 bp,编码213个氨基酸,命名为DoTrxL2(NCBI序列号为KX524080.1),见图2。用NCBI Blastp分析其保守结构域,结果显示该产物有一个Trx家族特有的结构域,即Cys-Gly-Ser-Cys(图3黑色方框表示)。将该序列在NCBI中进行blastp分析,选取与其相近的16条序列进行DNAMAN蛋白比对分析,发现该结构域非常保守(图3红色框线),除此外,在此序列后的C-端还有3个C残基(黑色三角形表示),进一步证明克隆所得为Trx家族基因。

图1 DoTrxL2 PCR扩增结果

图2 DoTrxL2的核酸序列与氨基酸序列

图3 DNAMAN比对的DoTrxL2的CXXC结构域
注:图中各条序列的accesion number分别为DoTRXL2(铁皮石斛DendrobiumofficinaleKimuraetMigo,APB87930.1);EgTRXL2(油棕Elaeisguineensis,XP_010915239.1);PdTRXL2(海枣Phoenixdactylifera,XP_008782549.1);AcTRXL2(菠萝Ananascomosus,XP_020096762.1);ZomTRX(大叶藻Zosteramarina,KMZ59737.1);NnTRXL2(莲Nelumbonucifera,XP_010262166.1);PeuTRXL2(胡杨Populuseuphratica,XP_011014007.1);VvTRXL2(葡萄Vitisvinifera,XP_002282326.1);ZmTRXL2-2(玉米Zeamays,AQK84723.1);GaTRXL2 木本棉Gossypiumarboreum,XP_017617040.1);DcTRXL2(胡萝卜Daucuscarota,XP_017240278.1);JrTRXL2(胡桃Juglansregia,XP_018845883.1);RcTRX(蓖麻Ricinuscommunis,EEF48055.1);OsTRXL6(水稻Oryzasativa,BAS92705.1);GmTRXL2(大豆Glycinemax,XP_003517423.1);PeTRXL2 (小兰屿蝴蝶兰Phalaenopsisequestris,XP_020585481.1);AoTRXL2(龙须菜Asparagusofficinalis,XP_020251035.1)
2.2 DoTrxL2的生物信息学分析
用ProtParam软件进行蛋白质基本性质预测,DoTrxL2基因编码的蛋白分子量为23 794.48 ku,理论pI为5.09,所带的负电荷(Asp + Glu)总数为23,正电荷(Arg+Lys)总数为29,分子式为C1066H1681N297O301S10,不稳定系数为35.06,表明该蛋白较稳定。
运用DNAStar中Protean程序对DoTrxL2进行蛋白质二级结构分析,结果显示DoTrxL2蛋白质的二级结构由11个α-螺旋、4个β-折叠、13个T-转角和14个无规则卷曲组成(图4)。利用TMHMM对蛋白质跨膜区特性进行分析,结果显示该蛋白主要分布于膜外,不含跨膜位点。
利用PSORT亚细胞定位预测显示,该蛋白主要分布于植物细胞叶绿体中,极少量分布在细胞核中。
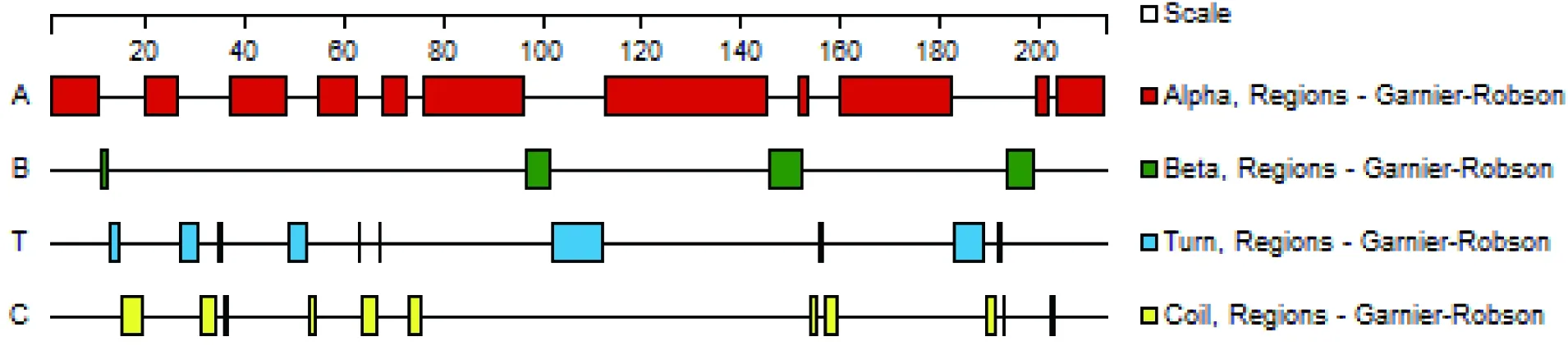
图 4 铁皮石斛DoTrxL2蛋白二级结构预测
2.3 DoTrxL2系统发育树构建

图5 不同物种硫氧还蛋白基因核苷酸序列系统发育树
注:图中各条序列的accesion number分别为DoTRXL2(铁皮石斛DendrobiumofficinaleKimuraetMigo,APB87930.1);PheTRXL2(小兰屿蝴蝶兰Phalaenopsisequestris,XP_020585481.1);EgTRXL2(油棕Elaeisguineensis,XP_010915239.1);AoTRXL2(龙须菜Asparagusofficinalis,XP_020251035.1);PdTRXL2(海枣Phoenixdactylifera,XP_008782549.1);AcTRXL2(菠萝Ananascomosus,XP_020096762.1);NnTRXL2(莲Nelumbonucifera,XP_010262166.1);PeTRXL2(胡杨Populuseuphratica,XP_011014007.1);VvTRXL2(葡萄Vitisvinifera,XP_002282326.1);TcTRX2(可可Theobromacacao,EOX96498.1);JrTRXL2(胡桃Juglansregia,XP_018845883.1);BdTRXL2(二穗短柄草Brachypodiumdistachyon,XP_003568764.1);RcTRXL2(蓖麻Ricinuscommunis,XP_002514101.1);GmTRXL2(大豆Glycinemax,XP_003529085.1);GsTRXL2(野生大豆Glycinesoja,KHN32916.1);SiTRXL2(芝麻Sesamumindicum,XP_011093720.1);CacTRXL2(木豆Cajanuscajan,XP_020239980.1);FvTRXL2(棉花Gossypiumhirsutum,XP_011459858.1);CcTRX(黄麻Corchoruscapsularis,OMO69628.1);PmTRXL2(青梅Prunusmume,XP_008242407.1);AetTRXL2(节节麦Aegilopstauschii,XP_020165732.1);NtTRXL2(烟草Nicotianatabacum,XP_016479657.1);CaTRXL2(鹰嘴豆Cicerarietinum,XP_004513104.1);VaTRXL2(赤豆Vignaangularis,XP_017440281.1);ZmTRXL6(玉米Zeamays,NP_001149676.1);CsTRXL2(黄瓜Cucumissativus,XP_004133814.1);ZjTRXL2(枣Ziziphusjujuba,XP_015889122.1);InTRXL2(牵牛Ipomoeanil,XP_019150855.1);SlTRXL2(番茄Solanumlycopersicum,XP_004253215.1);SeiTRXL2(小米Setariaitalica,XP_004960923.1);MdTRXL2(苹果Malusdomestica,XP_008337697.1);StTRXL2(马铃薯Solanumtuberosum,XP_015163827.1);GaTRXL2(木本棉Gossypiumarboreum,XP_017643280.1);CaaTRXL2(辣椒Capsicumannuum,XP_016580284.1);RsTRXL2-2(萝卜Raphanussativus,XP_018471912.1);ThTRXL2-2(醉蝶花Tarenayahassleriana,XP_010526398.1);BvTRXL2(甜菜Betavulgaris,XP_010677990.1);BrTRXL1-1(白菜Brassicarapa,XP_009148112.1);CasTRXL1-1(亚麻荠Camelinasativa,XP_010458099.1);BoTRXL1-1(甘蓝Brassicaoleracea,XP_013587205.1);PvTRX(菜豆Phaseolusvulgaris,AGV54520.1);DcTRXL1-1(胡萝卜Daucuscarota,XP_017239001.1);LlTRX(麝香百合Liliumlongiflorum,AAA33400.1);TuTRXL1-1(乌拉尔图小麦Triticumurartu,EMS65805.1);CycTRX(刺菜蓟Cynaracardunculus,KVH90699.1);OsTRXL1-1(水稻Oryzasativa,XP_015631589.1)
将DoTrxL2序列的氨基酸序列在NCBI上进行Blastp比对后,将选取的46条序列通过ClustalX比对后,用MEGA6构建DoTrxL2的系统发育树(图5)。结果显示,不同植物的Trx基因聚为3支,其中,C类全为双子叶植物,B类全为单子叶植物,A类中除LlTrx和TuTrxL1-1为单子叶,其余为双子叶植物。并且发现C类和B类亲缘关系较近,而A类亲缘关系较远。DoTrxL2属于B类,并与小兰屿蝴蝶兰、石刁柏等单子叶植物亲缘关系较近,这与铁皮石斛属于单子叶兰科的植物分类学特征相符。
2.4 DoTrxL2在不同组织及原球茎不同发育时期中的表达分析
采用2-△△Ct方法对原始Ct值进行计算后得出DoTrxL2基因的相对表达量,结果如图6所示。结果显示,DoTrxL2基因在铁皮石斛原球茎不同时期的表达差异不大,相对表达量最高最低相差大约20%。与原球茎形成时期相比,总体趋势为先下降后缓慢上升最后下降。其中原分生组织形成以及原球茎退化和苗的形成两个时期表达量较低,且两者相差不大;原球茎形成时期,叶原基维管系统形成时期和根端分生组织形成时期的表达量基本持平。
DoTrxL2基因在铁皮石斛不同组织中差异表达,在种子中表达量最高,是其在根中表达量的8.26倍;在花中的表达量是根的6.53倍;而在茎、叶、类原球茎差异不大,表达量是根的3~4倍。
3 讨论
Trx的二级结构较为保守,大多数由4个β折叠与其外包围着的5个α螺旋组成,活性中心在β2的尾部与α2的起始端之间[17]。Trx中活性中心CXXC的半胱氨酸对Trx的还原活性起着主导作用,而研究XX序列的不同突变体发现XX序列对不同蛋白质互作和维持蛋白质三维结构有重要的作用[18-19]。利用PCR点突变的方法,将烟草硫氧还蛋白基因(NtTrxh)活性位点WCGPC以外的3个C进行替换,发现突变蛋白均失去催化活性,表明NtTrxh氮末端的C残基也是催化反应所必须的[20]。而本研究中DoTrxL2碳末端的3个C残基,可能对维持蛋白质三维结构和催化活性有着重要作用。

图6 原球茎不同发育时期、不同组织中DoTrxL2基因表达分析
注:P2-P8分别代表原球茎形成、原分生组织形成、顶端分生组织、椭球形原球茎、叶原基维管系统形成、根端分生组织形成、原球茎退化和苗的形成;R、St、L、F、Se分别表示根、茎、叶、花、种子和类原球茎时期
Trx作为细胞氧化还原系统的关键蛋白参与细胞的基础代谢,在种子的萌发过程中有着重要作用。DoTrxL2在不同原球茎发育时期基础表达量均较大,表明DoTrxL2对原球茎的发育是必须的;而各时期表达量有差异但不显著,预示着DoTrxL2调控原球茎的发育代谢。在小麦(TriticumaestivumL.)种子萌发过程中,Trxh可通过诱导氯仿/甲醇可溶蛋白转换为代谢活性蛋白增强代谢途径,降解贮藏蛋白和增强GOGAT(glutamine oxoglutarate aminotransferase)活性促进种子萌发[21]。DoTrxL2在原球茎形成初期活化种子,促进原球茎形成;而到了原球茎发育后期,则促进原球茎叶和根的发生。在铁皮石斛原球茎发育成苗的过程中,会伴随着细胞的凋亡而使原球茎的形态发生变化。如在P4时期,原球茎的顶端会出现一个小凹槽;在P5时期、P6时期以及P7时期,原球茎的下部逐渐由圆球形变为哑铃形,最后下端完全退化[22]。在这些时期中DoTrxL2的相对表达量均有所上调,推测该基因介导的细胞凋亡途径对原球茎的形态发育有着重要影响[12, 22-23]。在植物早期发育过程中,Trx参与的硫氧化还原系统是叶绿体发育和维持叶绿体化合作用所必需的[24]。
DoTrxL2在不同组织中都有所表达,趋势为:种子>花>茎>叶>类原球茎>根。相关研究表明Trx在植物不同组织中均有表达且有所差异。铁皮石斛DoTrxm1和丹参(SalviamiltiorrhizaBge.)SmTrxh在根中表达量高而在叶中表达较少[25-26];甘蔗(Saccharumofficinarum)硫氧还蛋白基因ScTRXh2在叶片和茎中的表达量显著高于根和芽[27];而巴西橡胶树(Heveabrasiliensis)中HbTRX基因则在愈伤中大量表达,胶乳中次之,在花、叶、芽、树皮中均微量表达[28]。对豌豆(PisumsativumL.)的非光合器官如花、种子和根中的Trx进行研究,通过对与Trx偶联的β-葡萄糖醛酸酶(β-glucuronidase,GUS)进行组织化学染色,发现Trxf和Trxm均有所表达,并参与植物细胞分裂过程和植物生殖过程[29]。Trx不同成员的组织特异性表现不同,推测Trx不同成员相互协调调控植物的生长发育[27-28, 30]。DoTrxL2在花和种子中的表达量较高,推测该基因特异调控植物的生殖发育,在生殖生长中参与基础代谢。当植物遭受氧化胁迫压力时,Trx通过与过氧化物氧化还原酶的相互作用,参与清除有毒害的有活性氧类物质(reactive oxygen species,ROS),对维持细胞的氧化还原平衡有重要作用[31]。在植物抵御低温、高盐、干旱等逆境时,能对抗逆基因的表达进行调控,从而增强植物抗逆性[32]。

