荧光素/层状钇氢氧化物复合体的发光性能及对Hg2+的识别
李 建 苏飞飞 国 荣 梁足培*, 马淑兰*,
(1潍坊学院化学化工与环境工程学院,潍坊 261061)
(2北京师范大学化学学院,北京 100875)
0 引 言
近年来,以无机层状化合物为主体、有机物为客体的有机-无机杂化材料,由于在催化、离子交换、传感和光化学等方面的广泛应用[1-2],成为研究热点。无机层状化合物具有独特的结构和性能,且种类众多,如金属硫化物[3],金属磷酸盐和膦酸盐[4],以及层间客体可交换且层电荷密度高的层状金属氧化物[5]。层状稀土金属氢氧化物(LRHs)是一种新型的二维材料,其化学式为 RE2(OH)6-mAm/x·n H2O(RE:稀土离子;A:层间客体阴离子),由带正电荷的稀土氢氧化物主体层板和层间客体阴离子构成[6],在离子交换[7]、催化[8]、光致发光[9]等方面有广泛应用。由于层间客体种类可变,层板结构可调,可制得多样化、多功能的复合材料,在光学领域具有重要应用[10-11]。研究人员将有机物插入LRHs以制备性能优良的光功能性材料[12-13]。我们研究组将多种苯多羧酸类化合物插入LRHs[14-17],但工作重心均围绕复合材料在固态下的荧光性能。近期,我们研究组发现阴离子表面活性剂1-辛烷磺酸钠(OS)可加速LRH材料的剥离,并且剥离后复合体的发光性能与固态下的差异很大[18-21],扩展了LRH材料的应用范围。
在环境和生理等方面,化学传感器对过渡金属及重金属离子的检测具有重要意义[22-23]。在化学传感器中,荧光传感具有操作简单,响应速度快,成本低及可对金属离子实时监测等优异特性,受到研究者广泛关注[24-25]。但LRHs材料作为荧光传感器检测金属离子的报道很少。Byeon研究组[26]报道了利用Tb掺杂LYH检测Cr4+,由于LYH∶x Tb激发态能级与Cr4+的吸收波长重叠,形成一内部能量传递体系。他们还研究了Eu∶LGdH[27]对钒酸根离子的检测。以上工作大部分是利用层板RE3+的发光性能变化来实现离子检测的目的,且都是有关阴离子识别的报道,未见金属阳离子识别的研究。基于LRHs层间客体的荧光传感性质的研究则更少。最近,我们课题组[28]研究了荧光素/OS-LYH复合体对Fe3+的识别性能,是首次利用LRHs层间客体的发光性能检测金属阳离子的报道。
由于Hg2+的高毒性,近年来引起人们极大关注[29]。然而,Hg2+应用于许多领域,例如农业、食物保鲜、牙科及报纸等行业[30]。汞离子被认为是所有金属离子中毒性最强的污染物之一[31-33]。在金属阳离子中,汞离子存在形式最丰富,Hg2+具有很强致癌性和急性细胞毒性,对人体中枢神经系统的危害极大。Hg2+易通过皮肤,呼吸系统,细胞膜和胃肠组织侵入人体,导致神经疾病如肢体疼痛症、享-罗二氏征、水俣病等[34-35]。天然存在的甲基汞(通过水生系统中汞离子的生物甲基化形成),即有机形式的汞离子被普遍认为是造成各种神经疾病的主要原因。这种甲基汞积聚在食物链中,人体摄入后可轻易穿过血脑屏障,对人体健康造成致命影响[36-38]。无机汞离子Hg2+比有机形式的MeHg+肾毒性更强,因为它们积累在肾近端小管细胞中[39]。因此,对汞离子的有效检测非常重要[40-42]。
荧光素(fluorescein,缩写FN)是一种光活性有机化合物,结构如图1所示。将其和OS作为有机客体共同插入LYH层间,LYH层板的限域作用和OS的协同效应,可带来特殊的发光性能,利用此发光性能,可用作荧光传感识别金属离子。研究发现所得FN/OS-LYH复合体在甲酰胺中剥离所得胶体与固态时呈现不同的发光性能。更重要的是,FN/OS-LYH对Hg2+显示出优异的识别特性。此工作为LRH复合体应用于离子识别的荧光化学传感研究提供了重要数据。
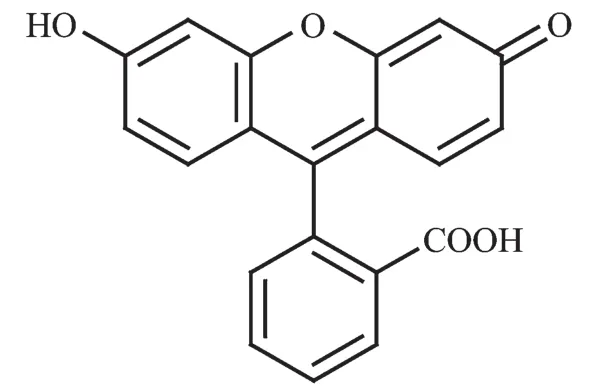
图1 荧光素(fluorescein,FN)的结构图Fig.1 Structure of the fluorescein(FN)
1 实验部分
1.1 NO3-LYH前体的制备
以 Y(NO3)3·6H2O 为原料,HMT 为水解试剂[21],通过水热反应合成NO3-LYH前体。具体反应过程:将 Y(NO3)3·6H2O(1 mmol),HMT(1mmol)和 NaNO3(13 mmol)溶于80mL去离子水,90℃下在Teflon水热釜中加热12 h。过滤得产物,用去离子水洗涤,40℃真空干燥24 h。
1.2 FN钠盐的制备
取0.06 mmol(0.021 g)FN,加入等物质的量的NaOH(0.06 mmol,0.002 4 g),溶于 50 mL 水,然后蒸干溶剂,得粉末状固体,为FN的钠盐。
1.3 OS-LYH和FN/OS-LYH的制备
复合体通过离子交换法合成。为合成OS-LY H,首先将3mmol(0.649 g)OS溶解在80mL去离子水中,然后将0.43 mmol(~0.078 g)NO3-LYH粉末分散到上述溶液中,70℃下在Teflon釜中反应24 h,过滤得产物,用去离子水洗涤,40℃真空干燥24 h。对FN/OS-LYH复合体,首先将0.06mmol(0.021 g)FN和0.06mmol(0.002 4 g)NaOH溶于80mL去离子水,得到淡黄色溶液,然后加入2.94 mmol(0.635 g)OS,保持有机物(FN+OS)物质的量的总和为3mmol。此时FN与OS物质的量之比为1∶49。之后,将0.43 mmol(0.078 g)的NO3-LYH粉末分散到上述溶液中。70℃下Teflon釜中反应24 h,过滤收集固体,去离子水洗涤,40℃真空干燥24 h。
1.4 复合体对金属离子的识别实验
将0.03 g FN/OS-LYH粉末分散到30 mL甲酰胺中,机械振荡2 h,获得半透明胶体悬浮液。向3 mL胶态悬浮液中加入1mL浓度为70mmol·L-1的Hg2+,Mg2+,Co2+,Ni2+,Cu2+,Zn2+,Pb2+和 Cd2+的水溶液(采用相应硝酸盐配置溶液)。测定溶液的荧光光谱(λex=350 nm)。
1.5 不同浓度Hg2+的识别实验
将0.03 g FN/OS-LYH复合体粉末分散到30 mL甲酰胺中,机械振荡2 h,获得半透明胶体悬浮液。向3mL胶体悬浮液中加入1mL不同浓度Hg2+水溶液。测定溶液的荧光光谱(λex=350 nm)
1.6 样品表征所用的仪器和工作条件
X射线粉末衍射仪分析 (XRD,X′PertPROMPD衍射仪,荷兰 PANalytical公司,Cu Kα靶,λ=0.154 18 nm,扫描管压、管流分别为40 mA和40 kV,步长0.2°,扫描范围大角为 4.5°~70°,小角为 0.8°~6°);傅里叶红外光谱(FT-IR,Nicolet-360红外光谱仪,美国Nicolet公司,扫描范围 4 000~400 cm-1);扫描电子显微镜(SEM,HITACHIS-4800),日本日立公司,操作电压10.0 kV,工作距离6mm;荧光光谱(PL)分析(固体荧光采用RF-5301 PC荧光分光光度计,日本岛津公司;液体荧光采用Cary Eclipse荧光分光光度计,澳大利亚VARIAN公司);CHN元素分析测试(Vario EL元素分析仪,德国Elementar公司);等离子电感耦合原子发射光谱 (ICP-AES,Jarrel-ASH ICAP-9000,德国斯派克分析仪器公司)。
2 结果与讨论
2.1 复合体的结构与组成
利用X射线衍射仪(XRD)对NO3-LYH前体和复合体的结构进行表征。图2为NO3-LYH,OS-LYH和FN/OS-LYH复合体的XRD图。图2a为NO3-LYH的XRD图[43],衍射峰的峰型尖锐,说明样品结晶度很好。在0.89、0.45和0.29 nm处观察到一系列(00l)衍射峰,为层状化合物的特征衍射,层间距为0.89 nm。单纯OS插层的复合体,即OS-LYH复合体的层间距为2.01 nm(图2b)。FN和OS共插层的复合体FN/OS-LYH的 XRD图(图2c)中,层间距仍为 2.01 nm,与单纯OS插层复合体的层间距相近,说明LYH层间主要由OS支撑。除2.01 nm主相外,还存在一个层间距稍小的相,可能是FN插层相对应的衍射。所有样品在0.31 nm处出现衍射峰,为LRH层板的(200)晶面衍射[43]。
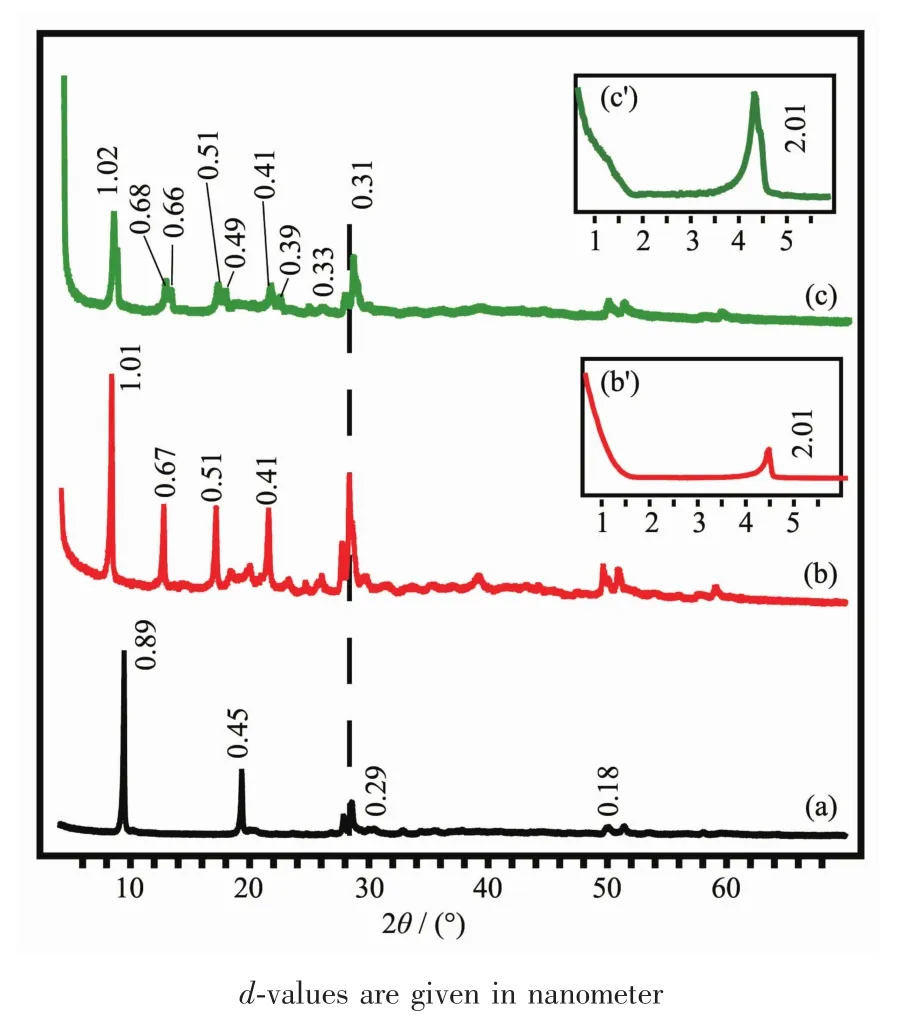
图2 NO3-LYH前体(a)和复合体OS-LYH(b,b′),FN/OS-LYH(c,c′)的 XRD 图Fig.2 XRD patterns of NO3-LYH precursor(a)and composites of OS-LYH(b,b′)and FN/OS-LYH(c,c′)
图3为样品的FT-IR谱图。FN钠盐(FN-Na)的IR谱如图3a所示,1 636 cm-1为C=O的特征吸收峰,1 576和1 464 cm-1处的吸收分别属于COO-的C=O 和C-O的吸收[44]。 对OS(图3b),1 199和1 068 cm-1为 SO3-的特征吸收,2 852~2 921 cm-1对应-CH2和-CH3基团的伸缩振动。NO3-LYH的IR谱如图3c所示,1 384 cm-1处尖锐及强的吸收峰为NO3-的ν3振动吸收。复合体的IR如图3d所示,复合体中NO3-吸收几乎完全消失,表明NO3-被交换。此外,2 922和2 853 cm-1处脂肪族C-H的伸缩振动,以及1 171和1 049 cm-1处SO3-的特征吸收,表明OS引入层间。同时,1 593和1 464 cm-1处观察到C=O和C-O伸缩振动,表明FN阴离子进入层间。以上证据说明复合体的成功合成。
基于ICP,CHN和电荷平衡等方面综合分析,LYH前体和复合体的估算组成如表1所示。在制备的复合体中发现,分析得到的FN与OS物质的量之比与实验起始加入的FN与OS物质的量之比一致,计算所得理论元素含量与实验测定值符合良好,说明2种有机物基本按比例插入LYH层间形成复合体。
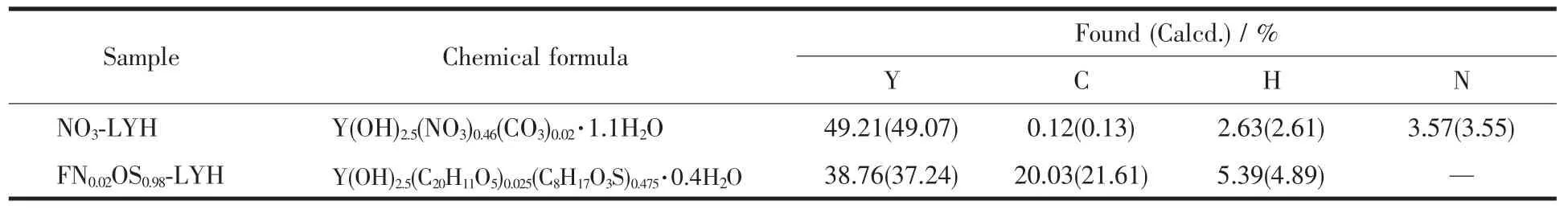
表1 NO3-LYH前体和FN/OS-LYH复合体的化学组成式Table 1 Chem ical compositions of NO3-LYH and FN/OS-LYH composite
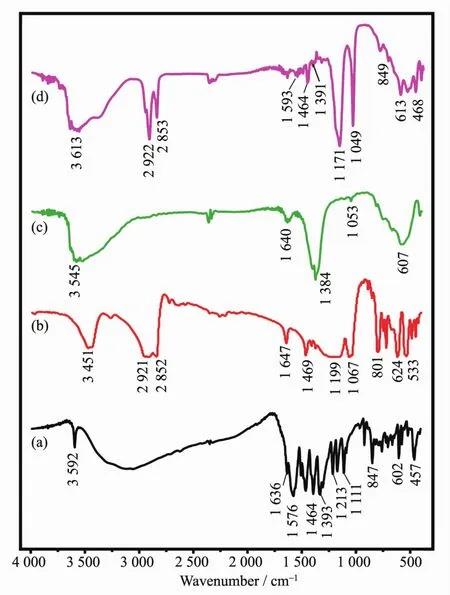
图3 FN-Na(a),OS(b),NO3-LYH(c)和FN/OS-LYH复合体(d)的IR谱图Fig.3 FT-IR spectra of FN-Na(a),OS(b),NO3-LYH(c)and FN/OS-LYH composite(d)
2.2 样品的形貌分析
为进一步研究样品的结构与形貌,采用扫描电镜(SEM)进行观察,如图4所示。可看出,样品呈现表面粗糙的片状形貌。NO3-LYH晶体(图 4a,a′)主要生长为正六面体的片状结构,其中部分晶体生长为柱状或花状聚集体。与已报道的拉长的六边形形貌的NO3-LGdH[15]相比,本文合成的NO3-LYH样品更倾向于较短边长的结晶。复合体 FN/OS-LYH(图 4b,b′)呈现出与前体NO3-LYH相似的形貌,此形貌的保持表明复合体合成过程为拓扑结构插层。

图 4 NO3-LYH 前体(a,a′)和复合体 FN/OS-LYH(b,b′)的SEM照片Fig.4 SEM images of NO3-LYH(a,a′)and FN/OS-LYH(b,b′)
2.3 固态发光性能
图5为FN-Na盐和复合体FN/OS-LYH的固态发射光谱。对FN-Na(图5a),不论使用何种激发波长,都未观察到任何发射峰,可能是由于FN-Na浓度聚集造成的荧光淬灭[18]。复合体FN/OS-LYH(图5b),在564 nm呈现明显的黄绿光发射(λex=480 nm),该发射光为FN阴离子的特征发射。
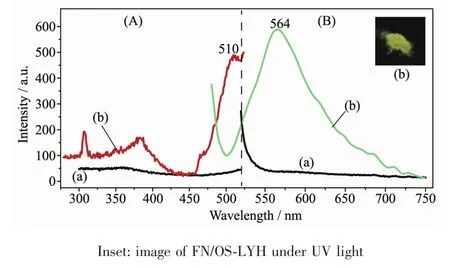
图5 FN-Na(a)和复合体FN/OS-LYH(b)的固态荧光激发 (A)和发射 (B)谱图Fig.5 Excitation(A)and emission(B)spectra of FN-Na(a)and FN/OS-LYH composite(b)in solid state
2.4 胶体态的发光性能
研究了FN-Na盐在甲酰胺溶液和复合体在甲酰胺中剥离所得胶体的发光性能。甲酰胺中,FN-Na呈黄绿光发射(572 nm,图6A-a),相比于FN在碱性水溶液[45-46]中的发射波长(约500 nm)发生红移。分析发射波长不同的原因,甲酰胺的-NH2可能与FN阴离子的-OH发生作用,可能导致FN的-OH去质子以及结构转换。剥离后复合体FN/OS-LYH呈现540 nm绿光发射(图6A-b)。FN/OS-LYH的发射相对于自由的FN阴离子发生显著蓝移(32 nm),这可能是因为FN阴离子所处的微环境发生变化,大量OS阴离子及正电性LRH层板与FN阴离子间存在相互作用。图6B为复合体对应的CIE1931色度图,发射坐标所在区域与发射光颜色一致。

图6 (A)甲酰胺中FN-Na(a)和FN/OS-LYH(b)的发射谱;(B)样品的CIE1931色度图Fig.6 (A)Emission spectra of FN-Na(a)and FN/OS-LYH composite(b)in formamide;(B)CIE 1931 chromaticity diagram of the samples
2.5 发光机理分析
从以上发光性质分析可见,复合体中FN和OS对发光波长均有影响,此处的发光中心是荧光素FN离子,呈现绿光发射。与FN-Na盐(572 nm)相比,复合体的发射峰位置发生蓝移(540 nm),且发射强度增强。这可能归因于OS的稀释效应以及LYH层板的限域效应。据Ogawa和Kuroda报道,表面活性剂可在一定程度上减缓光敏物质的分子间团聚[47],改善发光性能。本实验中,表面活性剂(OS)可起到稀释有机物FN的作用,避免其团聚,增强发光强度[48-49]。LYH层板元素为Y,为不发光的稀土元素,与其他发荧光的稀土元素相比价格较低,可节约成本[50]。在本实验体系中,阴离子表面活性剂OS既影响发射强度又改变发射峰位置,与已报道结果有所不同[51]。发射峰位置的变化可能是因为OS与FN阴离子和带正电LYH层板作用时,FN所处微环境改变。刚性分子FN和柔性分子OS发生超分子作用,可能导致FN构型变化,进而改变FN的能级,使其发射峰位置移动。
2.6 复合体的离子识别性能
研究了复合体FN/OS-LYH对于金属离子的识别能力。图7为加入不同金属离子后,FN/OS-LYH的荧光光谱。当激发波长为350 nm时,发射光谱在525 nm处有最强峰。当复合体分散于甲酰胺+H2O混合液中,相较于分散在纯甲酰胺溶液而言,发射波长发生蓝移,由538 nm移动至525 nm,可能是由于H2O存在产生的影响[28]。在离子识别过程中,不同金属离子导致发光强度不同。添加Zn2+和Pb2+时发光强度增强。 而其他离子如 Mg2+,Cd2+,Ni2+,Co2+,Cu2+和Hg2+等均减弱发光强度。值得注意的是,Hg2+减弱复合体荧光发射的程度最大。
图8为加入金属离子前后复合体在525 nm处的荧光强度。相比于其他离子,Hg2+具有明显的淬灭效果,可能是由于Hg2+与FN阴离子(羧基O和羟基O原子)间具有较强的配位能力;此时,Hg2+与LYH正电性层板可进行阳离子交换,进而与有机物FN-作用,影响由LYH层板限域导致的发光增强,最终导致发光减弱或淬灭。同时,Hg2+与OS-、FN-的静电吸引,也会拉近FN-,导致其浓度聚集效应使荧光减弱。FN/OS-LYH复合体可望用于识别Hg2+的荧光化学传感。

图7 不同金属离子与FN/OS-LYH混合的发射光谱Fig.7 Emission spectra of FN/OS-LYH colloid mixed with variousmetal ions

图8 FN/OS-LYH加入不同金属离子后在发射波长525 nm处的荧光强度Fig.8 Fluorescence intensity of FN/OS-LYH at525 nm whenmixed with differentmetal ions
进一步研究了Hg2+浓度对发光强度的影响。随Hg2+浓度增加,复合体的发射强度逐渐减弱(图9)。Hg2+可能与FN离子的氧配位,导致发光淬灭。如图10所示,以悬浮液的相对荧光强度为纵坐标,Hg2+浓度为横坐标,绘制Stern-Volmer图。淬灭效应可用Stern-Volmer方程解释,I0/I=1+KsvcM,其中I0和I分别是加入Hg2+前后的荧光强度,cM为金属离子的浓度。由图可知,低浓度范围内所得淬灭常数(Ksv)为4.82×102L·mol-1,相对强度与离子浓度的线性相关系数为0.997,检出限 (3σ/slope[27])为2.73×10-7mol·L-1。与文献值对比,如银三角形纳米片多层薄膜[52]对 Hg2+的检测限为 2.24×10-6mol·L-1,本 FN/OSLYH复合体的检测限更低,表明该复合体对Hg2+的识别能力更强,识别选择性高。
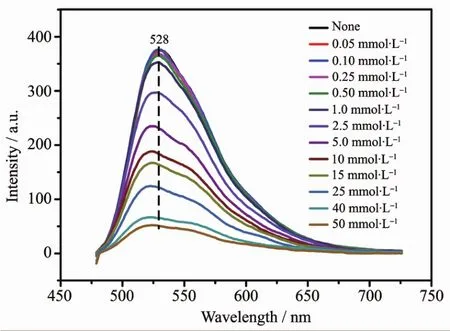
图9 FN/OS-LYH与不同浓度Hg2+混合后的发射谱Fig.9 Emission spectra of FN/OS-LYH in fomamidewith the addition of various concentrations of Hg2+(0~50mmol·L-1)in fomamide
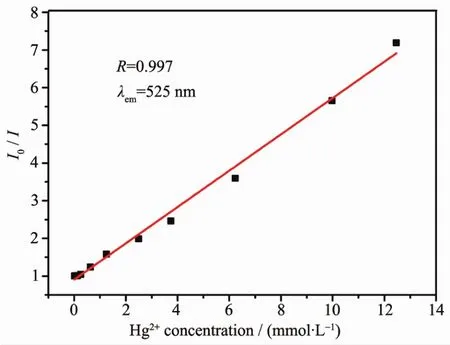
图10 FN/OS-LYH的相对荧光强度I0/I与Hg2+浓度(0~14mmol·L-1)的关系曲线Fig.10 Plot of Hg2+concentration dependence(0~14 mmol·L-1)on I0/I of FN/OS-LYH
3 结 论
通过离子交换反应,将荧光素(FN)和表面活性剂1-辛烷磺酸根阴离子(OS)共插入LYH层间,得到FN/OS-LYH复合体。固态下,有机物FN不发光,LYH层板增强了FN的发光,呈现黄绿光(564 nm);甲酰胺中,由于OS的共插层,所得复合体很容易剥离。剥离后所得胶体发射绿光(540 nm),与单纯有机物FN的甲酰胺溶液发射的黄绿光(572 nm)相比也发生蓝移。表面活性剂OS和LYH层板对发光均有重要影响。剥离的FN/OS-LYH复合体对Hg2+具有很好的识别选择性,淬灭常数为4.82×102L·mol-1,检测限 2.73×10-7mol·L-1,可用于 Hg2+识别的荧光化学传感器。此工作可拓展LRH类材料作为荧光传感进行金属离子识别方面的应用,为新型LRH复合材料的开发及应用提供了新方向。

