原位恶性黑素瘤单细胞分离及拉曼光谱测定
彭洋 陈挺杰 张婧秋 樊姣荣 朱佳 丁晓岚 李航
100034北京大学第一医院皮肤科 皮肤病分子诊断北京市重点实验室(彭洋、陈挺杰、张婧秋、李航);北京大学微电子学系微米/纳米加工技术国家级重点实验室(樊姣荣、朱佳);北京大学人民医院皮肤科(丁晓岚)
恶性黑素瘤(简称恶黑)发病率逐年升高,侵袭性强、病死率高,严重威胁患者健康和生命[1],根据侵袭程度可分为原位恶黑和侵袭性恶黑[2]。早期诊断、早期治疗能够显著改善恶黑患者的预后[3⁃5]。早期原位恶黑细胞在表皮基底层散在增生,不呈巢,因此通过消化原位恶黑标本分离所得的细胞混悬液所含黑素瘤细胞比例较低,尚需进一步纯化才能获得可供研究的高浓度黑素瘤细胞。黑素来源细胞(黑素瘤细胞、黑素细胞)在细胞悬液状态下的形态特征,如细胞直径、胞质颗粒化程度(即光镜下的胞质非均质化程度,可能与细胞内色素颗粒、黑素小体、细胞代谢过程中的产物、细胞器等结构有关)与其他来源的细胞是否存在差异,目前尚缺乏此类研究。本研究使用标准化试剂盒消化原位恶黑标本获得的细胞混悬液,尝试依据细胞的大小、形态、胞质成分、颗粒化程度等指标的差异,区分角质形成细胞与黑素(瘤)细胞,并据此探索一套分离、纯化原位恶黑中活性黑素(瘤)细胞的技术平台,为后续从单细胞层次研究原位恶黑相关的发病机制、细胞学改变以及新的鉴别诊断指标提供新线索。
一、对象与方法
1.对象:北京大学第一医院皮肤科2015年10月至2016年4月确诊的9例原位恶黑、5例侵袭性恶黑以及5例交界痣患者。患者均接受了原发灶切除手术,肿瘤标本行组织病理检查。本研究通过北京大学第一医院医学伦理委员会批准(批号:2014[702]),患者均签署知情同意书。
2.细胞系与试剂:黑素细胞系(PIG1)由美国Loyola University的Caroline Le Poole教授馈赠,恶黑细胞系(A375)由北京大学肿瘤医院肾癌与黑色素瘤科郭军、孔燕、斯璐教授馈赠,永生化角质形成细胞系(HaCaT)由北京大学第一医院皮肤科吴艳教授馈赠。胎牛血清、青链霉素、HMGS、Medium 254培养基(美国Gibco公司),DMEM培养基、磷酸盐缓冲液(PBS,美国HyClone公司),台盼蓝(美国Sigma公司),RECELL表皮细胞分离试剂盒(澳大利亚Avita公司),S100抗体、AE1/AE3抗体、Melan⁃A抗体、山羊抗小鼠IgG抗体(美国OriGene公司),羊血清工作液、二氨基联苯胺显色液(北京中杉金桥生物技术有限公司)。
3.细胞培养:A375细胞与PIG1细胞分别在含10%胎牛血清、1%青链霉素、1%HMGS的Medium 254培养基中,37℃、100%湿度、5%CO2条件下培养。HaCaT细胞于含10%胎牛血清、1%青链霉素的DMEM培养基中,37℃、100%湿度、5%CO2条件下培养。
4.细胞混悬液制备:术中留取常规病理检查所需肿瘤组织后,将剩余肿瘤组织按RECELL表皮细胞分离试剂盒标准操作流程进行消化处理[6]:将肿瘤组织放入专用反应盒中,加入试剂盒专用消化酶消化60 min,人工剥离表皮,冲洗并收集表皮细胞混悬液。分离后取少量细胞做台盼蓝染色验证细胞活性,分离15、30、45、60 min时存活率分别为83.3%、70%、50%、10%,即分离后可获得高比例的活性表皮细胞,15~60 min内细胞存活率随着时间延长而降低。
5.涂片离心及免疫细胞化学鉴定:每份标本分别取0.5ml细胞混悬液在cytospin3型自动涂片离心机中以1 600 r/min(离心半径10 cm)离心涂片2 min,使细胞贴附于阳离子防脱玻片上,免疫细胞化学两步法[7]对细胞涂片分别进行S100、Melan⁃A和AE1/AE3免疫细胞化学鉴定。丙酮固定、双氧水和羊血清工作液处理后分别加入鼠源抗S100、Melan⁃A和AE1/AE3抗体,并以PBS作为对照,于4℃孵育12h,在复温并洗脱之后加入山羊抗小鼠IgG抗体,于37℃孵育30 min,随后滴加二氨基联苯胺显色液显色并以苏木精染色,最后经过脱色脱水以及二甲苯立体化和树脂封片后置于显微镜下观察,每份标本分析100个细胞,分别统计其中黑素来源细胞(S100和/或melan⁃A阳性)和角质形成细胞(AE1/AE3阳性)的比例。
6.细胞形态分析:在细胞悬液状态下,对A375细胞、PIG1细胞、HaCaT细胞、原位恶黑分离细胞、侵袭性恶黑分离细胞、交界痣分离细胞进行形态学观察和测量。每种细胞系及每份来自患者的标本分析100个细胞,统计细胞直径、胞质颗粒化程度(非均质化区域占胞质面积的百分比)。
7.细胞纯化:利用有限稀释法[8]分别将来源于5例原位恶黑患者的表皮单细胞分离到96孔板中,依据胞质颗粒化程度高低从表皮单细胞中纯化黑素来源细胞,具体方法为:在光镜下观察每一孔板中单细胞的胞质颗粒化程度,收集胞质高颗粒化的细胞(非均质化区域占胞质面积>50%),每份标本共收集200个细胞。将纯化所得细胞离心涂片和S100免疫细胞化学染色,每份标本分析100个细胞,统计评估纯化后黑素来源细胞(S100阳性)的比例,计算纯化效率。
8.原位恶黑细胞的拉曼光谱测定:为进一步研究纯化得到的原位恶黑细胞的拉曼光谱特征(反映肿瘤细胞膜表面的微观结构及介电特征),采用电化学自组装生长的金纳米颗粒作为表面增强拉曼活性衬底,通过金纳米颗粒与细胞膜紧密结合,增强细胞膜表面生物分子的拉曼信号,从而实现单细胞水平的拉曼光谱检测。分别将从1例原位恶黑和1例交界痣患者标本分离得到的原位恶黑细胞和交界痣细胞悬液滴于金纳米颗粒表面增强拉曼活性衬底,在光镜下确定细胞位置,利用显微共焦激光拉曼光谱仪扫描得到细胞膜表面的拉曼强度分布,以拉曼峰谱表征不同类型细胞的细胞膜表面生物分子特征。拉曼光谱仪检测参数:激光波长633 nm,功率5 mW,50倍物镜。
二、结果
1.黑素来源细胞分离效率:见表1。原位恶黑、侵袭性恶黑、交界痣标本间S100阳性率、Melan⁃A阳性率差异有统计学意义(均P<0.05),原位恶黑中S100阳性率低于侵袭性恶黑(t=7.2,P<0.05),而与交界痣间差异无统计学意义(t=2.1,P>0.05)。原位恶黑Melan⁃A阳性率低于侵袭性恶黑(t=9.2,P<0.05),高于交界痣(t=9.0,P<0.05)。3种标本来源细胞AE1/AE3阳性率差异无统计学意义。
表1 原位恶性黑素瘤、侵袭性恶性黑素瘤、交界痣分离所得细胞混悬液中S100、Melan⁃A、AE1/AE3阳性率(±s,%)
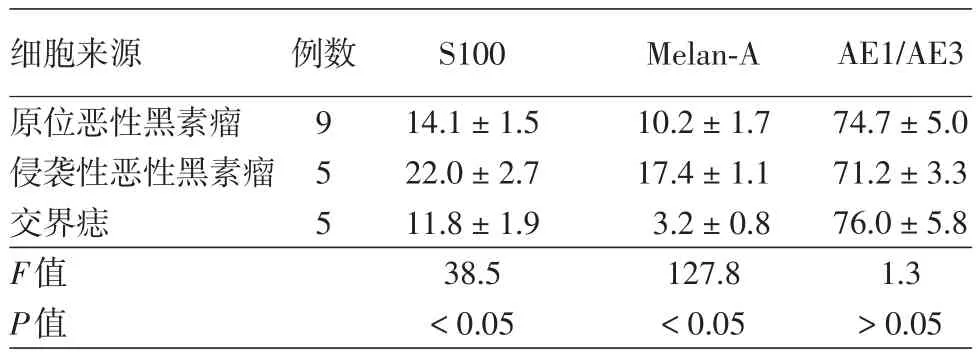
表1 原位恶性黑素瘤、侵袭性恶性黑素瘤、交界痣分离所得细胞混悬液中S100、Melan⁃A、AE1/AE3阳性率(±s,%)
细胞来源原位恶性黑素瘤侵袭性恶性黑素瘤交界痣F值P值例数9 5 5 S100 14.1±1.5 22.0±2.7 11.8±1.9 38.5<0.05 Melan⁃A 10.2±1.7 17.4±1.1 3.2±0.8 127.8<0.05 AE1/AE3 74.7±5.0 71.2±3.3 76.0±5.8 1.3>0.05
2.黑素瘤细胞形态特征分析:原位恶黑、侵袭性恶黑、交界痣标本中分离所得的细胞混悬液中,黑素来源细胞与角质形成细胞直径之间差异均无统计学意义(P>0.05),而颗粒化程度间差异均有统计学意义(P<0.05)。见表2。A375、PIG1、HaCaT细胞系细胞直径差异无统计学意义(P>0.05);颗粒化程度差异有统计学意义(P<0.05),A375、PIG1细胞胞质颗粒化程度均高于HaCaT细胞(t值分别为18.0、17.0,P<0.05)。见表3。
表2 不同来源的黑素(瘤)细胞与角质形成细胞直径、胞质颗粒化程度比较(±s)
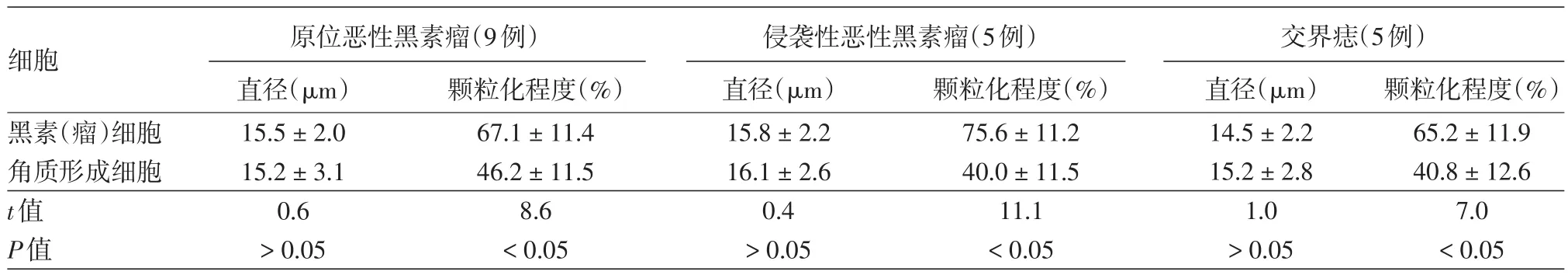
表2 不同来源的黑素(瘤)细胞与角质形成细胞直径、胞质颗粒化程度比较(±s)
细胞黑素(瘤)细胞角质形成细胞t值P值原位恶性黑素瘤(9例)直径(μm)15.5±2.0 15.2±3.1 0.6>0.05颗粒化程度(%)67.1±11.4 46.2±11.5 8.6<0.05侵袭性恶性黑素瘤(5例)直径(μm)15.8±2.2 16.1±2.6 0.4>0.05颗粒化程度(%)75.6±11.2 40.0±11.5 11.1<0.05交界痣(5例)直径(μm)14.5±2.2 15.2±2.8 1.0>0.05颗粒化程度(%)65.2±11.9 40.8±12.6 7.0<0.05
表3 三种细胞系直径与胞质颗粒化程度比较(±s)
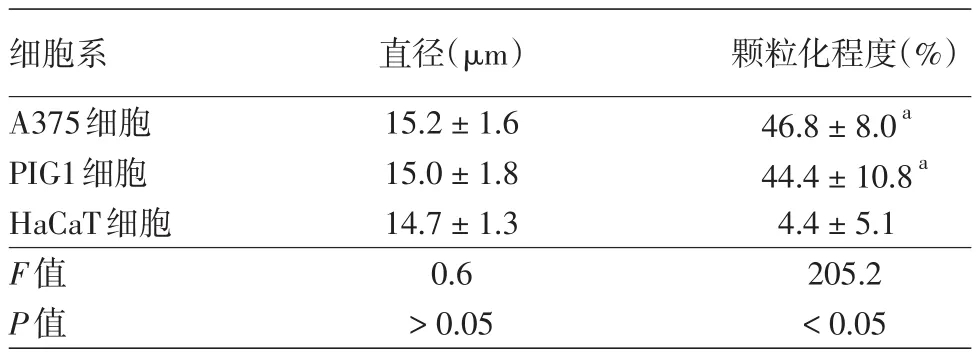
表3 三种细胞系直径与胞质颗粒化程度比较(±s)
注:n=299。a与HaCaT胞质颗粒化程度比较差异有统计学意义,P<0.05
细胞系A375细胞PIG1细胞HaCaT细胞F值P值直径(μm)15.2±1.6 15.0±1.8 14.7±1.3 0.6>0.05颗粒化程度(%)46.8±8.0a 44.4±10.8a 4.4±5.1 205.2<0.05
3.原位恶黑细胞纯化效率:原位恶黑中的黑素瘤细胞比例纯化前为(13.4±0.5)%,纯化后提高到(22.2±1.0)%,纯化前后差异有统计学意义(t=8.0,P<0.05),平均纯化效率为165.7%。
4.原位恶黑细胞拉曼光谱特征:电镜下,衬底元件表面均匀分布金纳米颗粒,细胞贴附在该衬底元件表面(图1)。单细胞拉曼光谱检测结果显示,原位恶黑细胞和交界痣细胞的拉曼光谱峰值区域不重叠(图2)。
三、讨论
从原位恶黑标本中分离并纯化具有活性的黑素瘤细胞是研究原位恶黑的前提。有文献报道,利用黑素细胞特异性培养技术可逐步纯化黑素细胞[9]。由于肿瘤细胞基因组不稳定,在经过多次增殖、传代后,肿瘤细胞可能产生与原发疾病不相关的基因突变或染色体变异,干扰后续实验分析。既往还曾利用胶原酶、胰酶消化皮肤制备细胞悬液,然而制备过程中,处理时间、温度、消化酶的浓度难以精确控制,实验过程很容易对细胞造成损伤,或者降低分离效率[10]。近年RECELL试剂盒被批准临床应用,该标准试剂盒提供了专用的反应装置和消化酶,可高效地获得具有活性的表皮细胞混悬液,已应用于移植表皮单细胞治疗烧伤和白癜风等[11⁃12]。
本文采用RECELL试剂盒分离得到的表皮单细胞悬液,主要包括角质形成细胞和黑素细胞(在肿瘤标本中还包含黑素瘤细胞)。利用免疫细胞化学染色区分这两种细胞并结合相应细胞系进行形态学分析,我们观察到角质形成细胞和黑素(瘤)细胞在单细胞悬液状态下,存在一定的形态学差异,主要体现在黑素(瘤)细胞胞质的颗粒化程度高于角质形成细胞。经过有限稀释法分选出胞质高颗粒化程度的细胞后,黑素瘤细胞纯度有显著提高,提示利用黑素(瘤)细胞与角质形成细胞在胞质颗粒化程度方面的差异进行形态区分具有可行性。

图1 金纳米颗粒表面增强拉曼活性衬底和细胞贴附其表面的电镜图片 1A:衬底元件表面均匀分布金纳米颗粒(红色箭头);1B:细胞贴附在该衬底元件表面(黄色箭头)

图2 原位恶性黑素瘤及交界痣细胞拉曼光谱 原位恶性黑素瘤细胞和交界痣细胞的拉曼光谱峰值区域不重叠。左上角细胞图像为所测单细胞的显微镜下形态
受限于有限稀释法对细胞分选的效率较低,最终纯化得到的细胞总量仅为102个左右,而免疫荧光共染过程中存在多次洗脱抗体的操作,不可避免地损失大量细胞,实验可行性较差。我们采用离心涂片联合免疫细胞化学染色鉴定不同来源的细胞,从而避免细胞损失。细胞免疫分子标记选择方面,我们在确定标本分别为原位恶黑、侵袭性恶黑、交界痣的前提下,分别选取S100、Melan⁃A、AE1/AE3鉴定相应标本中的黑素来源细胞和角质形成细胞。不可否认仅选用S100和Melan⁃A两种黑素细胞相关免疫标记进行检测,会遗漏部分特殊免疫表型的黑素瘤细胞,导致对黑素来源细胞游离状态的形态分析存在偏倚。这也可能是利用本纯化方案仅可有限提高黑素(瘤)细胞比例,仍无法纯化得到高纯度黑素(瘤)细胞的原因。通过反复纯化或借助流式细胞仪对细胞胞质颗粒化差异的自动分选均有望进一步提高纯化效率,以获取高纯度黑素(瘤)细胞用于后续细胞生物学实验。
拉曼散射效应是一种由分子振动和晶格振动导致的非弹性散射,可以表征特定的化学基团,其不同的峰谱对应生物分子中不同的化学键,而峰值强度对应于这个化学键的数量。由于不同生物样品表面化学基团成分存在差异,可检测到不同的拉曼光谱特征,从而可以实现对生物样品的识别和检测,目前已经被广泛应用于各种生物样品研究。在肿瘤研究中,可用于区别肿瘤细胞和正常细胞[13]。近期也有研究初步证明了其在鉴别恶黑和良性色素痣中的价值[14],我们的实验完成了对原位恶黑单细胞的拉曼光谱检测,为利用这项技术鉴别良恶性黑素细胞奠定了基础。
我们利用标准化的表皮消化技术,从原位恶黑标本中分离得到了活性表皮细胞,结合细胞免疫化学染色、细胞形态分析和有限稀释法,分选出胞质高颗粒化程度的细胞,从而提高了黑素瘤细胞的比例,并初步研究了其拉曼光谱特征。研究结果提示,胞质颗粒化程度可作为重要的分选指标,用于发展并完善黑素(瘤)细胞的纯化技术,有望解决原位恶黑细胞获取的技术瓶颈,为进一步研究原位恶黑的细胞遗传学和生物学特征提供可能。

