组织蛋白酶D调控皮肤成纤维细胞降解晚期糖基化终末产物的研究
许新雅 许庆芳 郑跃 黎钰莹 黄云芬 龚子鉴 陆春 赖维
510630广州,中山大学附属第三医院皮肤科
晚期糖基化终末产物(AGE)是蛋白质、脂类、核酸等大分子物质的游离氨基与还原糖通过非酶糖化反应生成不可逆及不易降解的大分子棕色产物。AGE在光老化皮肤中大量堆积,并在光老化多个环节中起重要作用[1]。AGE被巨噬细胞、成纤维细胞等胞吞后,可被泛素蛋白酶体或溶酶体蛋白酶降解[2⁃4]。我们发现,光老化的人皮肤成纤维细胞溶酶体组织蛋白酶B(CatB)、CatD等表达降低以及对吞入胞内AGE降解减少,且尚不清楚何种蛋白酶调控皮肤成纤维细胞可降解吞入胞内的AGE。本研究观察蛋白酶活性抑制剂、慢病毒转染介导的蛋白酶高表达对皮肤成纤维细胞降解吞入胞内AGE的影响。
材料与方法
一、 实验材料
Dulbecco改良Eagle高糖培养基(DMEM)、胰酶、胎牛血清、磷酸盐缓冲液(PBS)、青链霉素均为美国Gibco公司产品;牛血清白蛋白(BSA)、AGE⁃BSA(美国Biovision公司);一抗兔抗人CatD⁃IgG抗体、内参兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)多克隆IgG抗体、二抗辣根过氧化物酶(HRP)-羊抗兔IgG均为美国Cellsignalingtechnology公司产品。二喹啉甲酸(BCA)蛋白定量试剂盒(美国Pierce公司)。增强化学发光(ECL)显色试剂盒(美国Millipore公司),预染Marker(加拿大Mbi fermentas公司)。总RNA提取试剂Trizol(美国Invitrogen公司)。PrimeScript RT Master Mix反转录试剂盒和SYBR Premix EX TaqTM试剂盒(日本Takara公司)。CatB、CatD、CatL活性检测试剂盒(美国Biovision公司)。蛋白酶抑制剂CA074Me、天冬氨酸酶抑制剂(pepstatin A)、MG⁃132均为美国MedChemExpress公司产品。酶联免疫检测仪(美国Biotek公司),流式细胞仪(美国BD Biosciences公司),激光扫描共聚焦显微镜(德国ZEISS公司)。
二、 方法
1.原代皮肤成纤维细胞培养:取中山大学附属第三医院泌尿外科健康儿童包皮环切术后的包皮组织,所选人群年龄5~9岁,平均6岁。参照文献[5]分离培养皮肤成纤维细胞,第3代细胞冻存。细胞复苏后4~10代细胞行后续实验。在予AGE⁃BSA孵育细胞前及AGE⁃BSA孵育细胞过程中,均以含2%胎牛血清细胞培养液培养各组细胞。本研究经过中山大学附属第三医院伦理委员会批准。
2.CCK8法检测蛋白酶抑制剂对细胞活性的影响:将细胞按5×103个/孔密度接种于96孔板,每孔含100 μl细胞培养液。实验分4组,每组各设3个复孔,即细胞培养24h后,各组分别加入1 μmol/L CA074Me、75 μmol/L pepstatin A、1 μmol/L MG⁃132及等量PBS(对照组)。孵育4h,去除抑制剂,每孔加入10 μl CCK8试剂,37℃孵育4h,酶联免疫检测仪上测定A450值,细胞增殖率=(实验组A值-空白A值)/(对照组A值-空白A值)×100%。另设37.5、75、150 μmol/L pepstatin A组及空白对照组(加PBS处理),步骤同上,检测各组细胞增殖活性,实验重复3次。
3.荧光法检测成纤维细胞CatB、CatD、CatL、20S蛋白酶体酶活性:提取CA074Me组、pepstatin A组、1 μmol/L MG⁃132组及相应对照组的总蛋白,BCA法蛋白定量。取50 μl细胞裂解后上清液加入50 μl反应缓冲液,混合后分别加入CatB+CatL、CatD及20S蛋白酶体相应的底物7-氨基-4-三氟甲基香豆素(AFC)、7-甲氧基-4-乙酰基香豆素(MCA)及荧光多肽底物(LLVY⁃R110),使其终浓度为200 μmol/L,37℃孵育1.5h。多功能酶标仪分别检测游离AFC[激发光波长(λex)400 nm,发射光波长(λem)505 nm],MCA(λex 328 nm,λem 460 nm),LLVY⁃R110(λex 480 nm,λem 520 nm)的荧光强度。计算每组细胞用酶标仪检测的荧光强度值与其蛋白浓度比值即为该组细胞酶的相对活性。
分别提取37.5、75和150 μmol/L pepstatin A组及对照组总蛋白,BCA法蛋白定量。按上述实验步骤,多功能酶标仪分别检测游离MCA荧光强度。计算每组MCA荧光强度与蛋白浓度比值即为细胞酶的相对活性。
4.流式细胞仪检测蛋白酶抑制剂对皮肤成纤维细胞降解吞入胞内AGE⁃BSA的影响:参照前期研究[6],以200 mg/L AGE⁃BSA为本实验浓度。实验分为8组,对照组、CA074Me组、pepstatin A组和MG⁃132组细胞分别加入PBS、1 μmol/L CA074Me、75 μmol/L pepstatin A和1 μmol/L MG⁃132孵育4h;AGE⁃BSA组、AGE⁃BSA+CA074Me组、AGE⁃BSA+pepstatin A组和AGE⁃BSA+MG⁃132组分别加入PBS、1 μmol/L CA074Me、75 μmol/L pepstatin A、1 μmol/L MG⁃132 孵育4h(设为0h点)后,加入200 mg/L AGE⁃BSA孵育细胞8h(设为8h点),再去除AGE⁃BSA,分别以含相应抑制剂的新鲜培养基继续培养24h(设为32h点),收集这3个时间点各组细胞,流式细胞仪检测吞入胞内AGE⁃BSA荧光强度。实验重复3次。
5.ELISA检测皮肤成纤维细胞对吞入胞内AGE⁃BSA的降解率:设37.5、75、150 μmol/L pepstatin A组,孵育细胞4h(设为0h点)。之后各组加入200 mg/L AGE⁃BSA孵育8h(设为8h点),再去除AGE⁃BSA并分别以含相应浓度pepstatin A的新鲜培养基继续培养24h(设为32h点),收集8h和32h点各组细胞蛋白并以BCA法进行蛋白定量。按照AGE ELISA试剂盒说明操作,绘制标准曲线。根据各样品A值计算AGE浓度。AGE⁃BSA降解率 =(T8h-T32h)/T8h,T8h、T32h分别为8h、32h时的AGE浓度。
6.慢病毒转染皮肤成纤维细胞:高表达CatD慢病毒(pCDH⁃CMV⁃MCS⁃EF1⁃CatD⁃copGFP)及空载病毒由上海吉玛公司构建。将细胞消化并接种至6 cm培养皿,每孔5×104,待细胞生长至70%融合时转染。实验分为3组:空白对照组,不予处理;空载病毒转染组(空载转染组),细胞中加入空载病毒液;CatD高表达慢病毒转染组(CatD转染组),细胞中加入高表达CatD慢病毒。感染复数MOI=100,混匀,置于细胞培养箱。24h后换液,倒置荧光显微镜下观察(λex 488 nm,λem 507 nm),转染成功的细胞有绿色荧光蛋白表达。每皿随机取3个无重叠视野,同一视野下分别以荧光显微镜计算荧光阳性细胞,以普通显微镜计算细胞总数,荧光率=(阳性细胞数/细胞总数)×100%。
7.RT⁃PCR检测皮肤成纤维细胞CatD mRNA表达变化:按上述实验分组,用Trizol试剂盒方法提取空白对照组、空载转染组和CatD转染组总RNA。检测方法同文献[7]。CatD上游引物序列5′⁃AGAAGCTGGT GGACCAGAACATC⁃3′,下游引物序列5′⁃TCCAGGT GGACCTGCCAGTA⁃3′,扩增片段长度 163 bp;GAPDH上游引物序列5′⁃GCACCGTCAAGGCTGAG AAC⁃3′,下游引物序列5′⁃TGGTGAAGACGCCAGTG GA⁃3′,扩增片段长度138 bp。
8.Western印迹法检测皮肤成纤维细胞CatD蛋白表达变化:方法同文献[7]。按上述分组,提取空白对照组、空载转染组和CatD转染组的总蛋白,置-80℃保存。蛋白定量、电泳,电转到聚偏氟乙烯膜上。各组分别加入一抗兔抗人CatD⁃IgG(1∶1 000稀释),兔抗人GAPDH⁃IgG(1∶4 000),4℃摇床孵育过夜,TBST液洗膜,加入HRP-羊抗兔IgG(1∶2 000),37℃孵育1h,TBST液洗膜3次,ECL显色。实验重复3次。
9.高表达CatD慢病毒转染对成纤维细胞降解吞入胞内AGE⁃BSA的影响:按上述分组,高表达CatD慢病毒转染细胞48h后,加入AGE⁃BSA孵育8h后去除,以新鲜培养基继续培养24h。ELISA法检测各组细胞AGE⁃BSA浓度,计算降解率。
10.统计学处理:采用SPSS 20.0统计软件,各组数据均以±s表示。两独立样本间比较采用独立样本t检验,同一组不同处理前后比较采用配对t检验,多组间比较采用单因素方差分析,组间两两多重比较采用LSD⁃t检验。P<0.05被认为差异有统计学意义。
结 果
一、 蛋白酶抑制剂对皮肤成纤维细胞CatB+CatL、CatD及蛋白酶体活性的影响
CA074Me组、75 μmol/L pepstatin A组及MG⁃132组细胞增殖活性分别为(97.36±0.97)%、(96.60±0.70)%、(97.23±1.44)%,对照组为100%,4组间差异无统计学意义(F=1.525,P>0.05)。
CA074Me组 CatB+CatL 酶活性、75 μmol/L pepstatin A组CatD酶活性及MG⁃132组蛋白酶体活性分别为0.90±0.04、0.83±0.10、11.59±1.64,均显著低于相应对照组(分别为1.18±0.05、1.20±0.05、21.85 ± 3.91,t值分别为8.317、5.985、4.196,均P<0.05)。因此,本实验所选用的抑制剂浓度均可有效抑制相应的酶活性。
二、 蛋白酶抑制剂对皮肤成纤维细胞降解吞入胞内AGE⁃BSA的影响
见图1。流式细胞仪检测显示,细胞在8h点,无AGE⁃BSA处理的对照组、pepstatin A组、CA074Me组和MG⁃132组AGE⁃BSA荧光强度均分别显著低于相对应加AGE⁃BSA处理组,t值分别 为 21.765、24.573、25.822、22.552,均P<0.05。去除AGE⁃BSA 24h后,CA074Me+AGE⁃BSA组和MG⁃132+AGE⁃BSA组胞内AGE⁃BSA荧光强度与同时间点AGE⁃BSA组差异无统计学意义(均P>0.05),但均较其相应8h点显著下降(配对t值分别为4.778、6.154,均P< 0.05)。而pepstatin A+AGE⁃BSA组8h和32h点的荧光强度差异无统计学意义(配对t=0.887,P>0.05),但均分别显著高于AGE⁃BSA组(均P<0.05)。
三、 不同浓度pepstatin A对皮肤成纤维细胞降解吞入胞内AGE⁃BSA的影响
CCK8法检测显示,37.5、75、150 μmol/L pepstatin A组及对照组细胞增殖活性差异无统计学意义;荧光法检测显示,CatD酶活性差异有统计学意义(P<0.05),且各浓度pepstatin A组显著低于对照组(均P<0.05)。见表1。
ELISA 检测结果显示,37.5、75和150 μmol/L pepstatin A组24h内对胞内AGE⁃BSA降解率差异有统计学意义(P<0.05),见表1。组间两两比较差异亦有统计学意义(均P<0.05)。
四、 慢病毒转染上调皮肤成纤维细胞CatD表达和活性
见图2、3。慢病毒转染细胞48h后,空白对照组细胞未见荧光,空载转染组和CatD转染组荧光率均>80%。CatD转染组、空白对照组、空载转染组间CatD mRNA、蛋白表达及酶活性差异均有统计学意义(均P< 0.05)。见表2。LSD⁃t检验显示,CatD转染组CatD mRNA、蛋白表达及酶活性显著高于空白对照组及空载转染组(均P<0.05),但空白对照组与空载转染组相比差异无统计学意义(均P>0.05)。
五、 高表达CatD对皮肤成纤维细胞降解吞入胞内AGE⁃BSA的影响
ELISA显示,AGE⁃BSA组、空载转染 +AGE⁃BSA组和CatD转染+AGE⁃BSA组细胞对吞入胞内AGE⁃BSA的降解率分别为14.57%±0.21%、14.67%±0.61%和20.33%±1.52%,差异有统计学意义(F=24.33,P< 0.05)。LSD⁃t检验显示,CatD转染 +AGE⁃BSA组明显高于另2组(均P<0.05),且另2组间差异无统计学意义(P>0.05)。
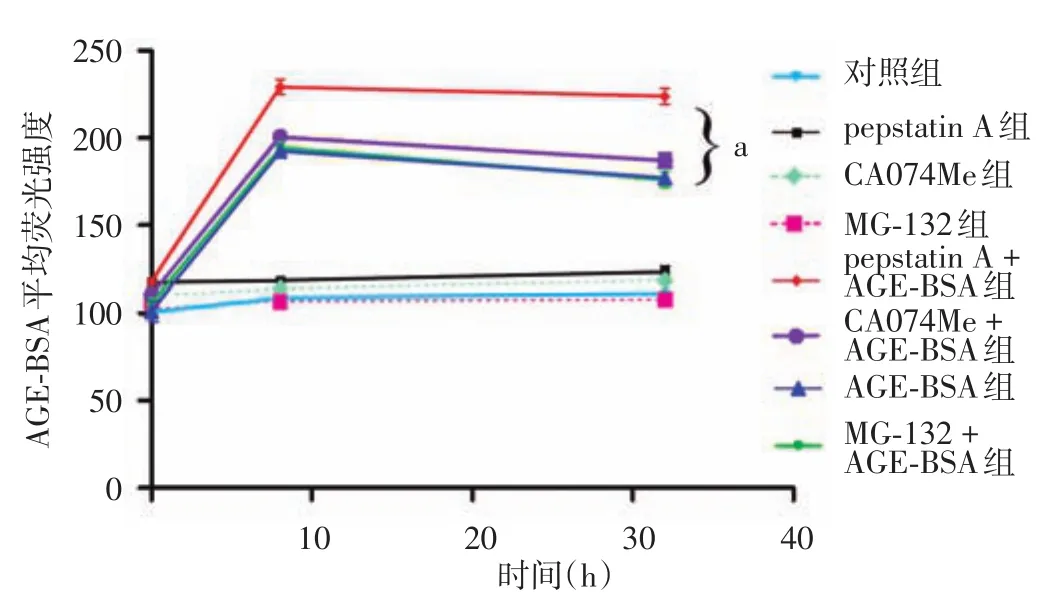
图1 流式细胞仪检测蛋白酶活性抑制剂对皮肤成纤维细胞降解吞入胞内AGE⁃BSA的影响 a:与AGE⁃BSA组相比,P<0.05
表1 不同浓度pepstatin A对皮肤成纤维细胞增殖活性、CatD活性和降解胞内AGE的影响(±s)
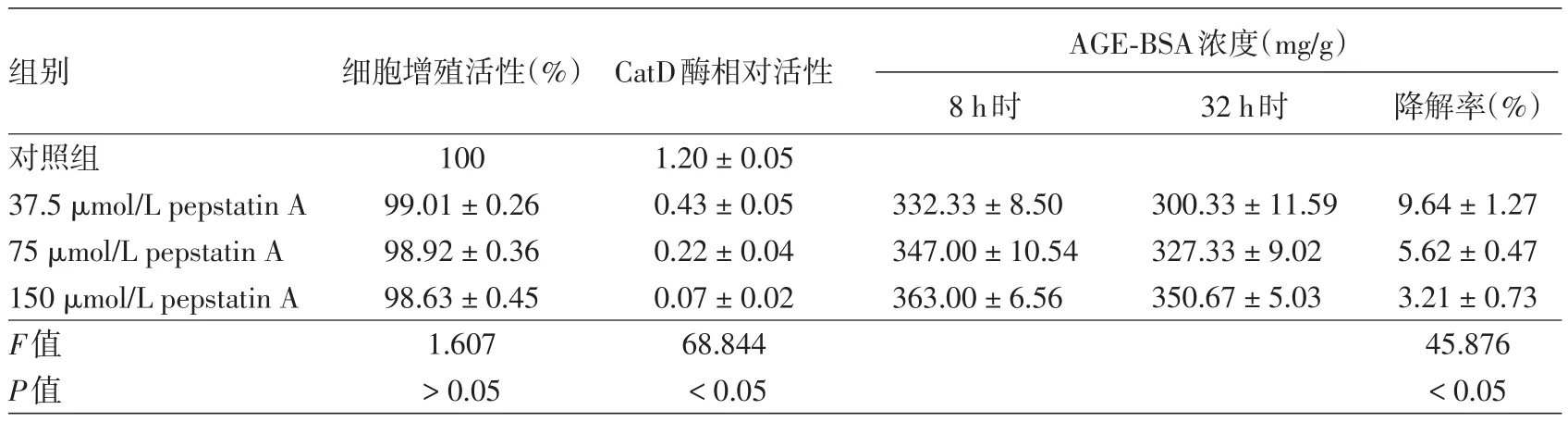
表1 不同浓度pepstatin A对皮肤成纤维细胞增殖活性、CatD活性和降解胞内AGE的影响(±s)
注:n=3。pepstatin A:天冬氨酸酶抑制剂;CatD:溶酶体组织蛋白酶D;AGE⁃BSA:晚期糖基化终末产物-牛血清白蛋白
组别 细胞增殖活性(%)32h时AGE⁃BSA浓度(mg/g)8h时 降解率(%)对照组37.5 μmol/L pepstatin A 75 μmol/L pepstatin A 150 μmol/L pepstatin A F值P值100 99.01±0.26 98.92±0.36 98.63±0.45 1.607>0.05 CatD酶相对活性1.20±0.05 0.43±0.05 0.22±0.04 0.07±0.02 68.844<0.05 332.33±8.50 347.00±10.54 363.00±6.56 300.33±11.59 327.33±9.02 350.67±5.03 9.64±1.27 5.62±0.47 3.21±0.73 45.876<0.05
讨 论
既往认为AGE极难降解,而现在发现,AGE可被巨噬细胞、成纤维细胞等胞吞后被溶酶体CatB、CatL、CatD或泛素蛋白酶体降解清除[2⁃4]。我们前期研究已发现[8],皮肤成纤维细胞可胞吞和降解胞外AGE,光老化抑制了皮肤成纤维细胞对吞入胞内AGE降解。值得注意的是,光老化皮肤成纤维细胞中蛋白酶体活性以及一些组织蛋白酶表达和活性均下降[9],提示AGE降解减少可能与该酶表达及活性下降有关。然而,哪种蛋白酶参与调控皮肤成纤维细胞降解吞入胞内AGE尚不清楚。
本实验先以流式细胞仪研究抑制蛋白酶活性对皮肤成纤维细胞降解吞入胞内AGE影响。结果显示,抑制CatB、CatL及蛋白酶体活性对皮肤成纤维细胞降解吞入胞内AGE⁃BSA无显著影响,但抑制CatD活性可显著降低皮肤成纤维细胞对吞入胞内AGE⁃BSA的降解。然后,我们采用ELISA检测不同浓度CatD抑制剂pepstatin A对皮肤成纤维细胞降解吞入胞内AGE⁃BSA的影响,发现pepstatin A可抑制皮肤成纤维细胞降解吞入胞内AGE⁃BSA,呈浓度依赖性。因pepstatin A除了抑制CatD活性外,还抑制CatE活性。为排除CatE的调控作用,我们进一步通过构建CatD过表达慢病毒载体,研究特异性上调皮肤成纤维细胞CatD表达和活性对其降解吞入胞内AGE⁃BSA影响,结果显示,高表达CatD可显著促进皮肤成纤维细胞对吞入胞内AGE⁃BSA的降解。

图2 荧光显微镜下观察慢病毒转染成纤维细胞的绿色荧光蛋白表达情况(×100) 2A:空白对照组;2B:空载病毒转染组;2C:CatD高表达慢病毒转染组
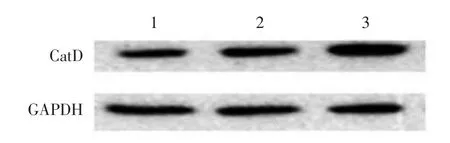
图3 Western印迹法检测各组成纤维细胞CatD蛋白表达变化1:空白对照组;2:空载病毒转染组;3:CatD高表达慢病毒转染组
表2 慢病毒转染对皮肤成纤维细胞CatD mRNA及蛋白表达和CatD酶活性的影响(±s)

表2 慢病毒转染对皮肤成纤维细胞CatD mRNA及蛋白表达和CatD酶活性的影响(±s)
注:n=3。CatD蛋白相对表达量=CatD灰度值/GAPDH灰度值。CatD:溶酶体组织蛋白酶D
组别空载病毒转染组CatD高表达慢病毒转染组空白对照组F值P值CatD mRNA(2-ΔΔCt)0.21±0.02 2.43±0.10 0.21±0.02 1 507.90<0.05 CatD蛋白相对表达量0.92±0.04 1.51±0.05 0.96±0.04 135.76<0.05 CatD酶相对活性1.19±0.06 3.14±0.08 1.20±0.06 879.76<0.05
有学者证实[10],在老年大鼠神经元中CatD表达增高,且与脂褐素等衰老相关蛋白沉积位置相重合,提示CatD很可能在降解细胞内堆积的变性蛋白中起重要作用。CatD还含有很强降解变性蛋白的肽链内切酶,与公认能降解AGE的胃蛋白酶有类似化学结构,且AGE在溶酶体酸性环境中变性后更易与蛋白水解酶的肽键结合并被降解[11]。更为重要的是,CatD可直接参与并调控细胞自噬[12⁃13],进而调控 AGE在溶酶体内的降解。然而,目前研究揭示溶酶体和泛素蛋白酶体在降解吞入胞内变性蛋白中起协同作用。Stolzing等[2]以AGE⁃BSA孵育体外培养神经小胶质细胞,发现AGE⁃BSA能被胞吞,然后被胞内20S蛋白酶体和溶酶体酶降解。但Bulteau等[3]发现,羧乙基赖氨酸(AGE主要结构之一)能抵抗20S蛋白酶体降解。Grimm等[4]以纯化CatD、CatB以及20S蛋白酶体等分别孵育AGE,发现20S蛋白酶体完全不能降解AGE,CatD、CatB能降解AGE,其中CatD降解活性显著高于CatB。随后,他们又研究鼠胚胎成纤维细胞和巨噬细胞系RAW264.7细胞对胞外AGE的降解,发现CatD在降解吞入胞内的AGE中起重要作用[10]。这些不同的研究结果可能与采用不同的细胞系、不同种类及浓度AGE有关。溶酶体其他蛋白酶和蛋白酶体是否调控皮肤成纤维细胞降解其他种类AGE有待进一步研究。
CatD在皮肤成纤维细胞降解吞入胞内AGE中起重要作用,而我们的前期研究发现光老化皮肤及皮肤成纤维细胞CatD表达均下降,并且光老化抑制了皮肤成纤维细胞对吞入胞内AGE的降解。本实验仅从皮肤成纤维细胞模型上研究,并证实了CatD对胞内AGE降解的调控作用,而在动物模型、人体光老化皮肤中CatD表达是否与AGE堆积相关尚未研究。

