电感耦合等离子体发射光谱定量分析的节样省时探索
孙晓玉, 宋晓红, 刘雅琼,2, 杨思宇, 李月琪, 赵倩倩, 王京宇,2
(1. 北京大学 公共卫生学院, 北京 100191; 2. 北京大学 医药卫生分析中心, 北京 100191; 3. 岛津企业管理(中国)有限公司北京分析中心, 北京 100020)
如何高效利用血清进行多元素定量分析已成为分析检测领域一个重要的课题[1]。生命科学的研究已进入多组学时代,金属组学、基因组学、代谢组学等研究都需消耗较多血液样品[2]。然而研究中收集的血清样品量通常十分有限,若进行常规金属组学元素分析就消耗较多的血清样品,将会限制血清多组学同步研究。
微波消解已广泛应用于样品前处理,但血清样品中元素含量较低,微波消解过程会引入外来元素污染及易挥发元素损失,且操作成本高,不适于大规模样品检测[3]。相关研究表明,采用直接稀释法对血清样品进行前处理可满足检测需求,但需选择合适的稀释倍数以减少基体干扰[4]。电感耦合等离子体发射光谱仪(ICP-OES)进行常规样品分析时,较多的待测液浪费在浸润管路,只有小部分待测液产生的信号真正被检测器收集[5]。
本实验通过优化ICP-OES血清多元素定量分析过程中前处理方法、信号采集延迟时间和采样留置时间等,提高样品使用效率。
1 实验设备及试剂
主要设备:ICP-OES:日本岛津公司(Shimadzu),ICPE 9800。
主要试剂:
单元素标准溶液有Na、S、P、K、Ca、Fe、Mg、Zn、Cu、Y。
质量控制标准物质:Trace Elements Serum L-1,挪威SERO公司,REF:201405,LOT:1309438。
2 实验方法
2.1 ICP-OES工作条件
ICP-OES2工作条件见表1。

表1 ICP-OES工作条件
2.2 样本
合作医院体检健康的成年人,空腹静脉血离心所得血清,置-20 ℃冷藏备用。本实验经过北京大学伦理委员会审核批准。
2.3 样品前处理
用1% HNO3将血清直接稀释10、20、40倍,制成不同浓度待测液,同时加入内标元素Y,内标质量浓度为200 μg/L。
2.4 确定最小进样体积
(1) 确定信号采集延迟时间:将ICPE 9800信号采集延迟时间分别设置成14、16、18……32 s等,在不同信号采集延迟时间下分别检测待测液。检测过程中,仪器连续曝光3次,并分别报告3次曝光测定值。默认情况下,最终测定结果是3次曝光测定值的平均值。以K元素为参考元素,分析K元素3次曝光测定值随信号采集延迟时间的变化趋势,确定最佳信号采集延迟时间。
(2) 确定采样留置时间:按照上一步结果设定信号采集延迟时间,进样管置于待测液时开始测定。测定时将进样管分别留置于待测液内10、12、14……28 s后取出置于清洗液中。以K元素为参考元素,分析K元素3次曝光测定值随采样留置时间的变化趋势,确定最佳采样留置时间。
(3) 确定最小取样量:根据信号采集延迟时间和采样留置时间确定血清最小取样量。
2.5 建立标准曲线
根据血清中各待测元素的浓度,配制标准溶液,应用本研究所建方法测定标准溶液,建立各元素标准曲线。各元素标准溶液质量浓度见表2。
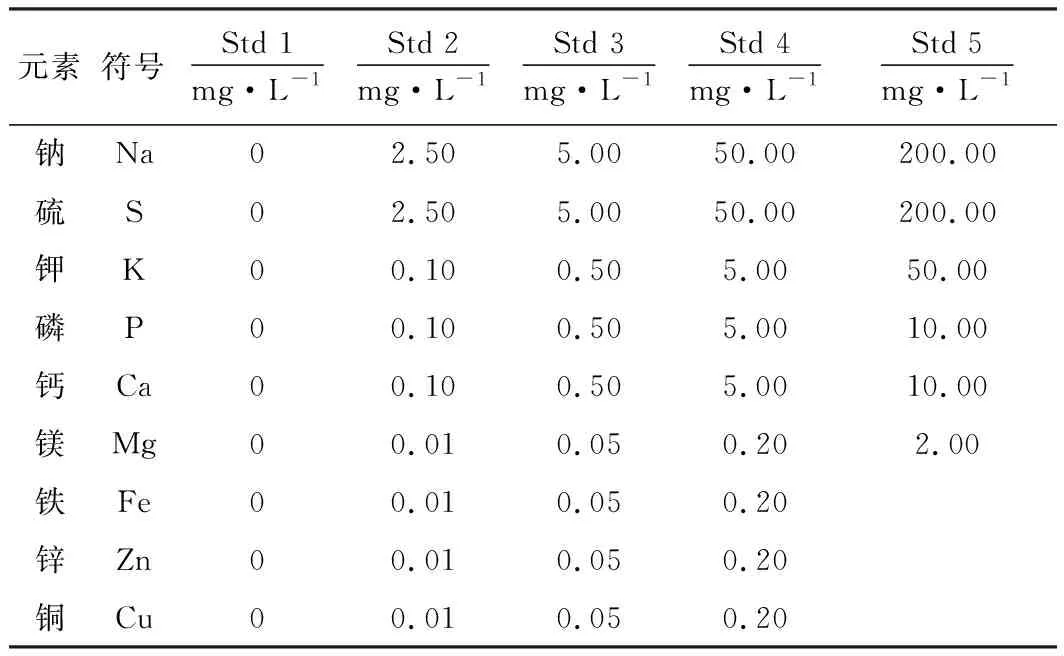
表2 标准曲线中各元素的质量浓度
3 实验结果
3.1 血清前处理
测定不同稀释倍数的血清样品,结果表明血清样品直接稀释10倍和20倍时,精密度较差,稀释40倍时精密度较好(见表3)。同时,稀释10倍和20倍时易造成ICP-OES进样系统堵塞及ICP火焰熄灭,稀释40倍时则有效避免上述情况。因此,采用40倍直接稀释进行血清样品前处理。
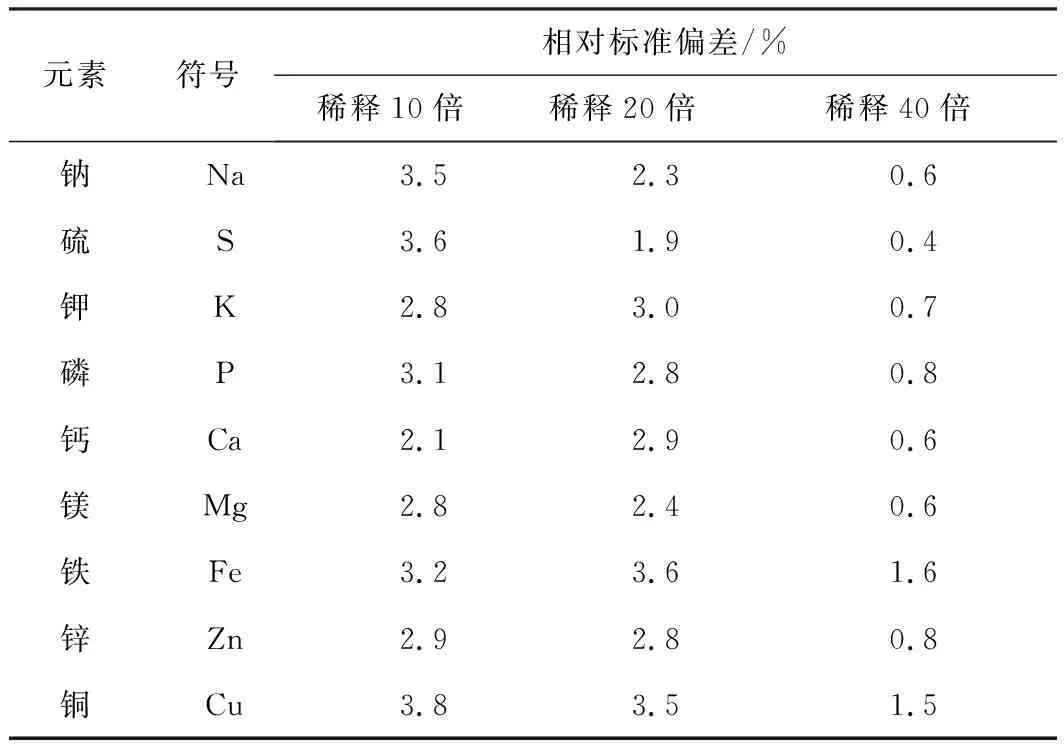
表3 不同稀释倍数下各元素精密度(n=10)
3.2 信号采集延迟时间
不同信号采集延迟时间下K元素的信号强度见图1。

图1 不同信号采集延迟时间下钾元素的信号强度
由图1可知:3次曝光测定值随信号采集延长时间的增加变化不同,第1次曝光测定值在信号采集延迟时间为14~24 s内快速升高,26 s后达到稳定;第2次曝光测定值在信号采集延迟时间为14~18 s内快速升高,20 s后达到稳定;第3次曝光测定值在信号采集延迟时间为14~32 s内均保持稳定。
已知每次曝光时间为5 s,则3次曝光的信号采集时间为15 s。当信号采集延迟时间设置较短时,虽测定已开始,但血清待测液并未到达ICP火焰或其信号未达到平衡。因此,只有当血清待测液进入到ICP中且信号达到稳定时,检测器才应采集信号。根据第1次曝光测定值的趋势可知,信号采集延迟时间大于28 s时,3次曝光所采集的信号均为血清待测液的稳定信号。因此,将最佳信号采集延迟时间定为28 s。
3.3 采样留置时间
不同采样留置时间下K元素的信号强度见图2。
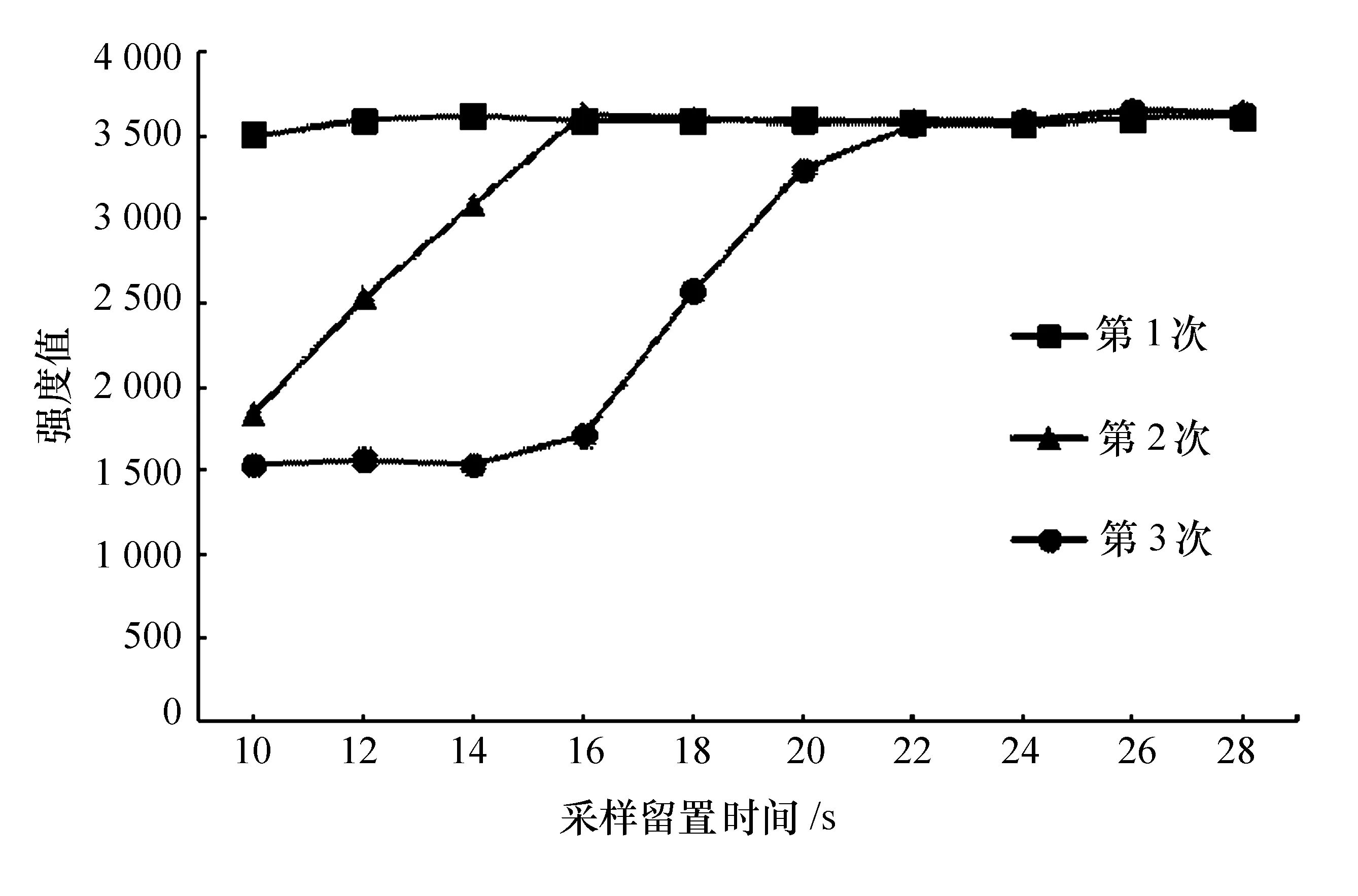
图2 不同采样留置时间下钾元素的信号强度
由图2可知:3次曝光测定值随采样留置时间的增加变化不同,第1次曝光测定值在10~28 s内均保持稳定;第2次曝光测定值在10~16 s内快速升高,之后达到稳定;第3次曝光测定值在10~14 s内保持在1 550左右,14~22 s内快速升高,之后达到稳定。
当采样留置时间较短时,进入到仪器内的待测液无法满足3次曝光所需体积。根据第3次曝光测定值的趋势可知,当采样留置时间大于24 s时,3次曝光所采集的信号均为血清待测液的稳定信号。因此,将最佳采样留置时间定为24 s。
3.4 最小进样量
将进样管插入某一血清稀释液内,记录10 min内血清稀释液消耗体积。结果可知,10 min约消耗11.8 mL血清稀释液,则每秒消耗约20 μL血清稀释液。由采样留置时间为24 s可知,完成一次检测约需0.48 mL血清稀释液,即12μL血清原液。鉴于进样过程中有部分待测液会残留在进样管或EP管中,故在实际操作中取15 μL血清于EP管中,用1% HNO3稀释40倍至0.60 mL待测。
3.5 进样系统清洗时间
采用本研究所建方法进行测定,调整清洗时间为10、15、20 s,观察清洗效果发现,清洗15 s以上时,信号已回到基线水平。
3.6 标准曲线线性
各元素的标准曲线方程及相关系数见表4。
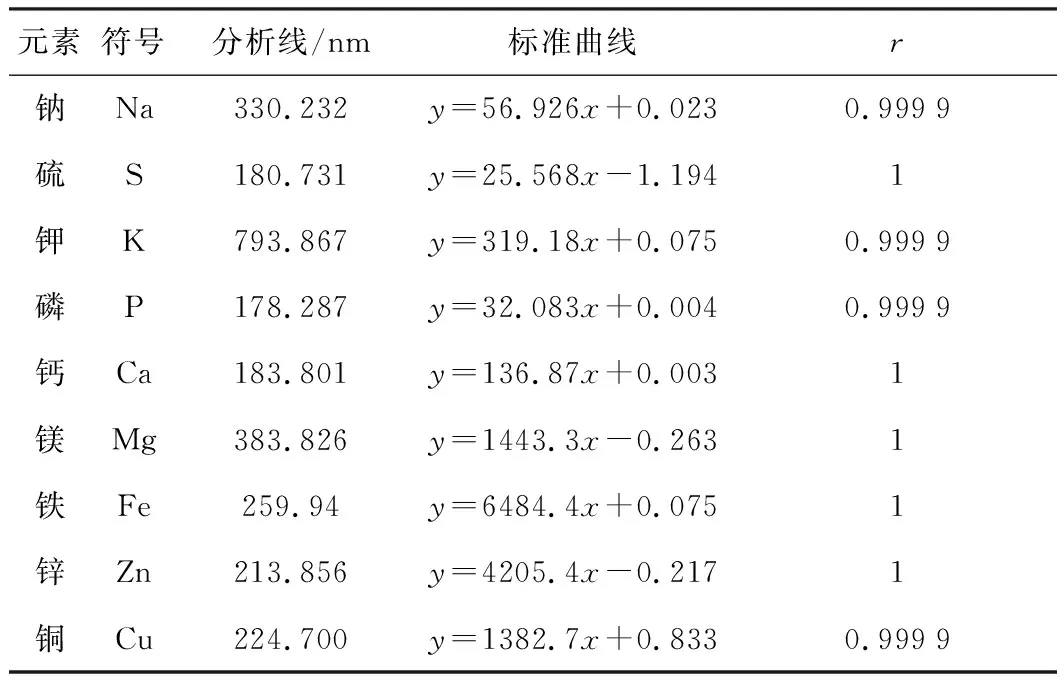
表4 各元素标准曲线方程及相关系数r
3.7 检测限和方法精密度
在最佳实验条件下连续测定11份空白溶液,以11次空白值的3倍标准偏差对应浓度为各元素的检出限,10倍标准偏差对应浓度为定量下限(见表5)。

表5 各元素检出限与定量下限

表5(续)
应用该方法对相同血清样品进行6次独立测定,计算测定结果的相对标准偏差得到日内精密度;应用该方法对相同的血清样品连续测定6 d,计算测定结果的相对标准偏差得到日间精密度,结果见表6。
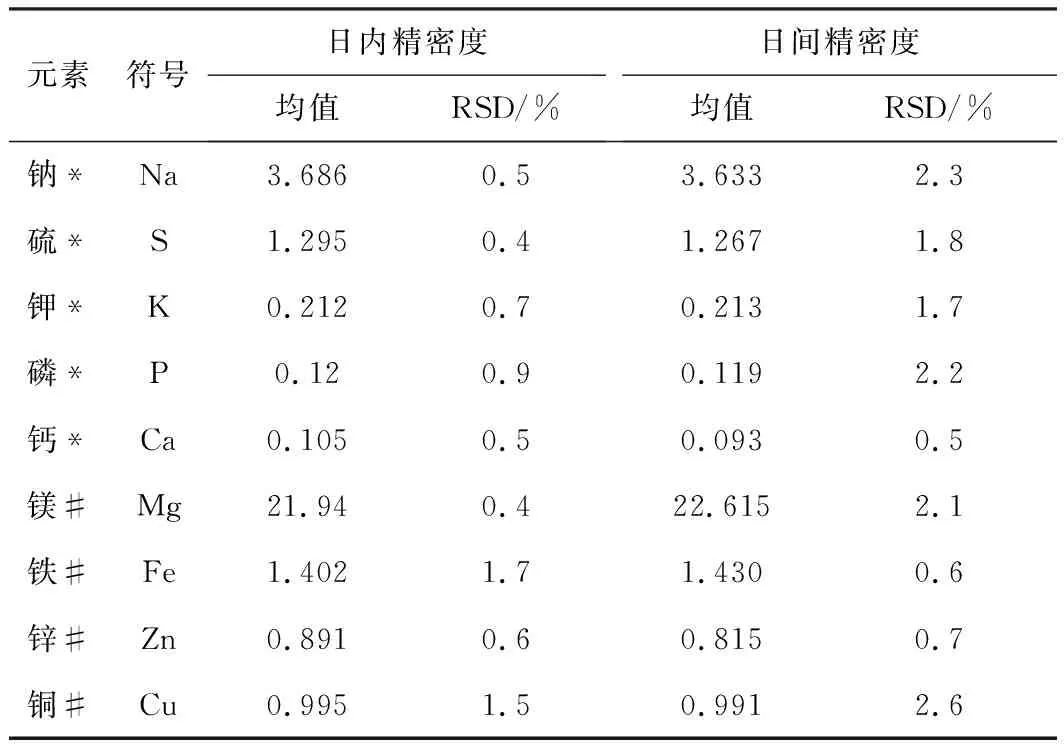
表6 各元素精密度(n=6)
注:*均值单位:mg/L,#均值单位:μg/L。
从表6可知,Na、S、K、P、Ca、Mg、Fe、Cu和Zn元素的日内精密度RSD均小于2%,日间精密度RSD均小于3%。
3.8 加标回收率
加标回收实验是在测定样品的同时,于某一样品的子样中加入一定量的标准物质并进行测定,将其测定结果扣除样品的测定值。得到加标回收率见表7。

表7 各元素加标回收率(n=6)
注:*测定值、加标量和加标试样测定值单位:mg/L,#测定值、加标量和加标试样测定值单位:μg/L。
由表7可知,Na、S、K、P、Ca、Mg、Fe和Cu元素的加标回收率均在100.0%~105.0%之间,Zn元素的加标回收率均为110.5%。
3.9 血清标准物质检测
人血清标准物质测定结果见表8。
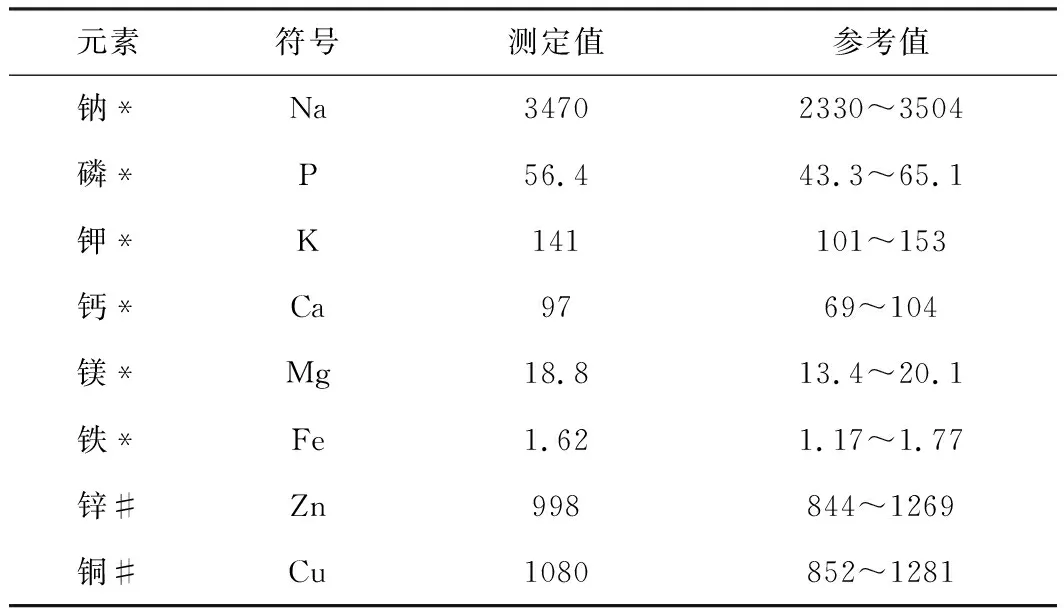
表8 血清标准物质测定结果(n=6)
注:*测定值和参考值单位:mg/L,#测定值和参考值单位:μg/L。
由表8可知,Na、P、K、Ca、Mg、Fe、Zn和Cu元素的人血清标准物质测定值都在参考值范围内,该人血清标准物质不含S元素。
4 讨论
任何样品在进行检测之前都需要经过一定的前处理,徐进力等[6]的研究表明,采用直接稀释进行前处理时,如果稀释倍数较低,则进样系统易发生堵塞进而影响检测结果的准确性;如果稀释倍数过大,则又会因元素含量过低而达不到理想的灵敏度,其分析信号强度将显著减弱,检测结果会产生较大的误差。稀释倍数较低条件下,随着检测样品数量的增加,无机盐会沉积在炬管、雾化器和雾化室中,导致样品测定值产生波动[7]。本研究的结果与上述一致,将血清直接稀释10倍和20倍时,进样系统易堵塞并导致ICP火焰熄火,且血清样品在较低稀释倍数下测定结果稳定性较差。因此本研究选用40倍稀释是相对合理的血清稀释倍数。当然,对于浓度较低的待测元素,在样品数不多的前提下也可以采用10倍或者20倍稀释,其相对标准偏差小于4%(参见表3)。
本研究所用仪器默认设置信号采集延迟时间为30 s,曝光时间每次30 s、清洗时间30 s,且需在待测液充满管路后才能开始检测过程,因此默认条件下测定一个样品至少需150 s,而实际测定过程往往更长。本研究所建方法将信号采集时间与检测时间相结合,利用浸润管路的溶液进行测定,只需进样24 s即可准确测定。此外,由于进样体积减少,故只需15 s即可完成清洗过程。因此,采用本方法只需39 s即可完成一个检测周期,相较默认方法节省80%的样品消耗量和74%的检测时间,且测定结果准确、可靠。
常规方法进行血清多元素分析时,往往需要0.2~0.5 mL血清才能完成一个样品的测定[8-10]。李海龙等[11]进行血清中多种元素的电感耦合等离子体发射光谱法直接测定实验时,提取0.4 mL血清,直接稀释定容到10.0 mL后上机测定。李萌等[12]进行血清多元素分析时,取0.5 mL血清处理后定容到2.1 mL后上机测定。严海英等[13]利用微波消解测定疾病人群血清中的微量元素时,取1.0 mL血清,前处理后定容到10.0 mL上机测定。本研究建立的微量血清多元素定量分析方法仅需约15 μL血清,显著减少了血清样本消耗量,有望实现指血、足跟血、耳血中多元素定量分析和满足婴幼儿检测需求。
5 结论
本研究采用直接稀释的前处理方法,对ICP-OES进样技术进行优化,建立了一种微量血清多元素定量分析的方法,测定了血清中Na、S、K、P、Ca、Mg、Fe、Zn和Cu元素的含量,并对该方法进行方法学评价。结果表明,该方法较默认方法节省80%的血清样品和74%的检测时间,且测定结果准确、可靠,提高了血清样本利用效率,有利于多组学生同步研究的顺利开展。

