贫营养细菌固体菌剂发酵工艺的优化
张 娜, 赵 辉, 李雅楠, 马 甜, 苏建宇
(宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点实验室,宁夏银川 750021
近年来,由于农田大量的开垦、农业高强度的利用、过度放牧及自然灾害等原因,导致土壤贫瘠化问题越来越普遍,给居民生活、工农业生产等带来严重危害[1-2]。目前主要通过植物、化学及微生物修复途径改良贫瘠土壤,努力恢复生态系统的功能已经成为目前研究的热点之一。从根本上改善贫瘠土壤性状,微生物改良是最佳的选择,具有巨大的潜力,但目前尚未得到广泛的研究及应用[3]。研究发现,贫瘠环境中存在对贫瘠极端环境具很强适应能力的贫营养菌,而对贫营养菌的研究主要基于水环境及医疗卫生等方面,关于对荒漠化、贫瘠化土壤的改良方面的研究却鲜见报道。已有研究表明,贫营养细菌在干旱贫瘠环境中能够很好地生长代谢,具解磷解钾分泌大量胞外多糖等功能[4-7],可有效稳定表层土壤颗粒,提高土壤肥力,为其他植物及微生物的生长提供营养物质,对干旱贫瘠土壤的改良具有重要意义[8]。功能微生物已被研制成固体菌剂广泛应用,固体菌剂具生产成本低、环保、方便快捷等诸多优势,而芽孢杆菌为其理想菌种资源[9-11],芽孢具抗逆性强、易于保存与储藏等优势。固体菌剂发酵基质一般选择廉价且来源广泛的豆粕、米糠、黄豆饼粉、麸皮及其他微量元素[12-15]。我国每年农林业生产产生大量有机废弃物,其中经焚烧等方式处理浪费的有机养分资源约有6 000万t,严重污染环境,利用这些农林有机废弃物作为固体菌剂发酵基质,不仅可以充分有效地利用有机养分资源、减少环境污染,而且可以改善土壤生物活性,提高土壤养分含量[11],但采用农林有机废弃物制备贫营养细菌固体菌剂的研究尚未见报道。本研究以实验室前期分离保存的1株贫营养细菌为基础,结合粉碎的桑树枝条及枣树枝条为主要基质,通过单因素试验、正交试验对贫营养细菌固体菌剂发酵工艺进行优化,并对优化后固体菌剂的养分含量进行测定,为其在生产上的应用奠定基础。
1 材料与方法
1.1 材料
菌株,由笔者所在试验室从干旱贫瘠土壤中分离筛选纯化,为兼性贫营养细菌,经鉴定为枯草芽孢杆菌,产芽孢,命名为P4,具较强的解磷解钾及产胞外多糖能力,在改良贫瘠土壤中具重要意义。
粉碎的枣树枝条、桑树枝条由宁夏回族自治区灵武市森保科技开发有限公司提供,过筛后分别混匀装袋备用。硫酸铵[(NH4)2SO4]、氯化钠(NaCl)、氯化钙(CaCl2)、硫酸镁(MgSO4·7H2O)、磷酸氢二钾(K2HPO4·3H2O),均为分析纯。
1.2 培养基
贫营养菌基本培养基:(NH4)2HPO41 g、KNO31 g、(NH4)2SO40.5 g、K2HPO4·3H2O 1.3 g、NaCl 5 g、MgSO4·7H2O 0.41 g、蒸馏水1 000 mL,pH值约为7.3,121 ℃高压灭菌30 min。葡萄糖(配制成一定浓度的葡萄糖母液于115 ℃下单独灭菌25 min,加入到贫营养菌基本培养基中使葡萄糖浓度为15 mg/L),固体培养基加入15~20 g/L琼脂粉。
平板计数培养基:采用NA培养基。基本固体发酵培养基:枣树枝条60%(桑树枝条 34.46%)、麸皮5%、NaCI 0.1%、K2HPO4·3H2O 0.1%、MgSO4·7H2O 0.02%、(NH4)2SO41%、CaCl20.01%。
1.3 试验方法
本试验于宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点试验室中完成,试验时间为2016年6—11月。
1.3.1 P4菌剂的基本发酵培养 保存的P4菌平板划线活化菌种,接种环接种至液体培养基中(葡萄糖浓度为 15 mg/L),在37 ℃、150 r/min下摇床振荡培养24 h,为Ⅰ级种液;取2 mLⅠ级种液转接至细菌基本培养基中(葡萄糖浓度为5 g/L)扩大培养48 h,为Ⅱ级种液,培养后的菌液D600 nm为1.4左右,菌量达1.81×108CFU/mL左右。
基本固体发酵培养基中pH值为7.0,料水比(质量比)1 ∶1.5 且接种量为15%,置于28 ℃恒温培养箱中静止培养2 d,每间隔12 h扣料1次,使其均匀生长,采用平板菌落计数法统计P4菌在固体发酵中的生长情况,设3个重复。
1.3.2 P4菌剂培养基条件的优化
1.3.2.1 单因素条件筛选试验 分别以麸皮、枣树枝条、(NH4)2SO4、NaCI、CaCl2、MgSO4·7H2O、K2HPO4·3H2O添加量为单因素,编号分别为A、B、C、D、E、F、G。通过测定固体菌剂中活菌数及芽孢数量确定每种因素中较优水平。
1.3.2.2 正交试验 在单因素试验结果基础上确定正交试验分析的因素与水平,采用SPSS 19.0统计软件设计正交试验L27(313)优化培养基配方,正交试验的因素水平见表1。以活菌数为指标,每个处理进行3次重复,为了证实正交试验分析法的可靠性,在最佳培养基成分配比下对活菌数进行3次平行试验。
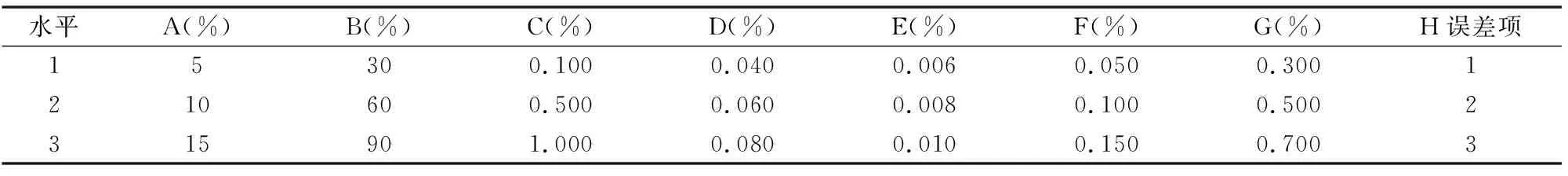
表1 贫营养细菌P4菌剂培养基条件的优化正交试验的因素水平
1.3.3 P4固体菌剂发酵条件的优化 在正交试验确定培养基组分最优组合的基础上,考察培养基厚度(0.5、1.5、2 cm)、料水比(1 ∶0.5、1 ∶1、1 ∶1.5、1 ∶2)、接种量(1%、5%、10%、15%、20%)及pH值(5、6、7、7.5、8) 4个培养条件对活菌数及芽孢的影响。
1.3.4 P4菌剂中菌数的测定 P4菌剂中菌数采用平板菌落计数法;芽孢数的测定:取培养好的固体菌剂,梯度稀释后于80 ℃恒温水浴10 min,取出后立即冷却10 min,涂板培养48 h后进行计数。
1.3.5 固体菌剂养分含量的测定 全氮、灰分、总有机物及有机质含量的测定参照NY 525—2012《有机肥料》;碱解氮含量采用碱解扩散法测定[16];纤维素、半纤维素、木质素含量参考文献测定[17]。
1.3.6 数据分析 利用Excel 2010、SPSS 19.0软件对试验数据进行分析处理。
2 结果与分析
2.1 P4固体菌剂培养基条件的优化
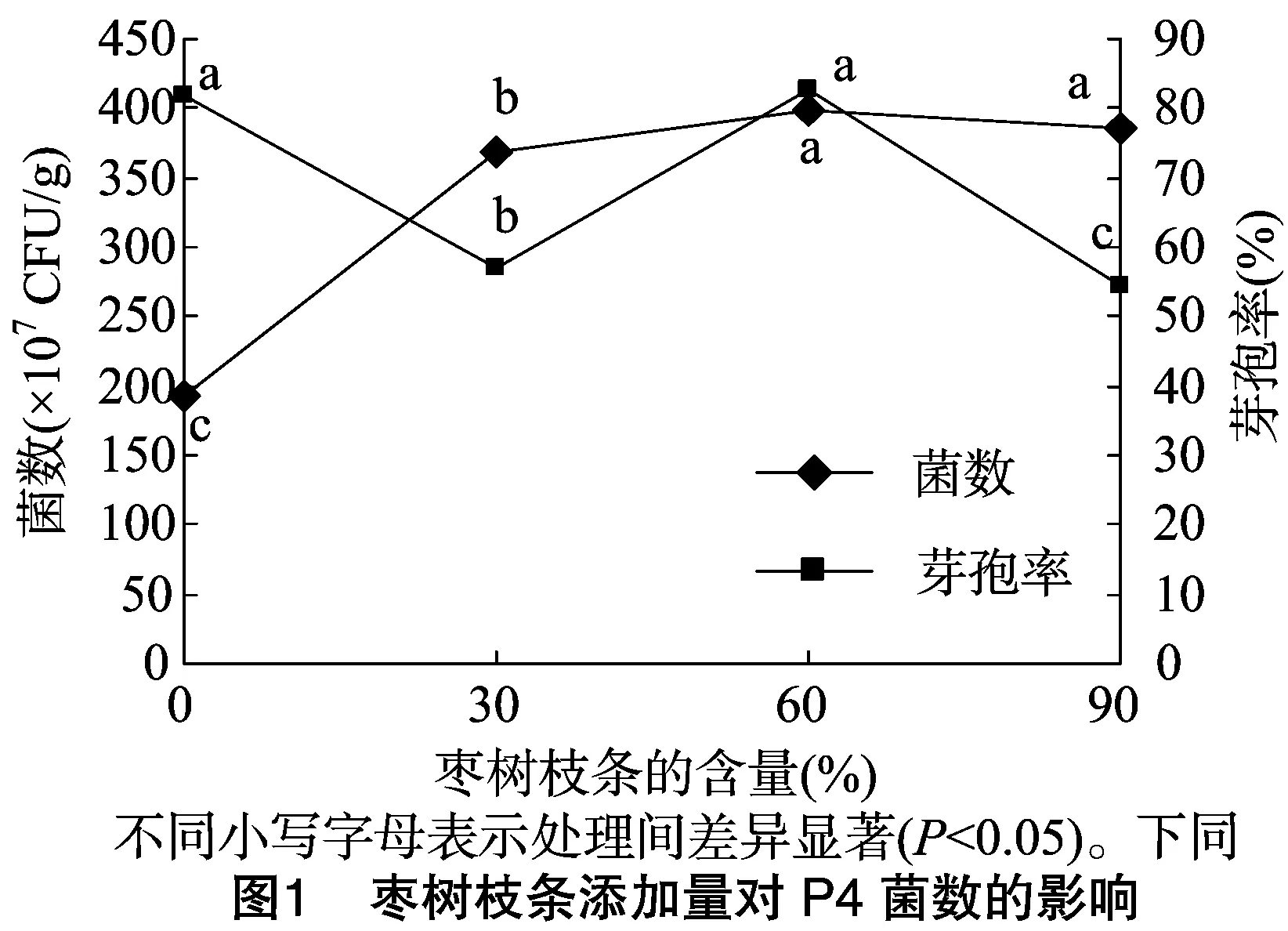
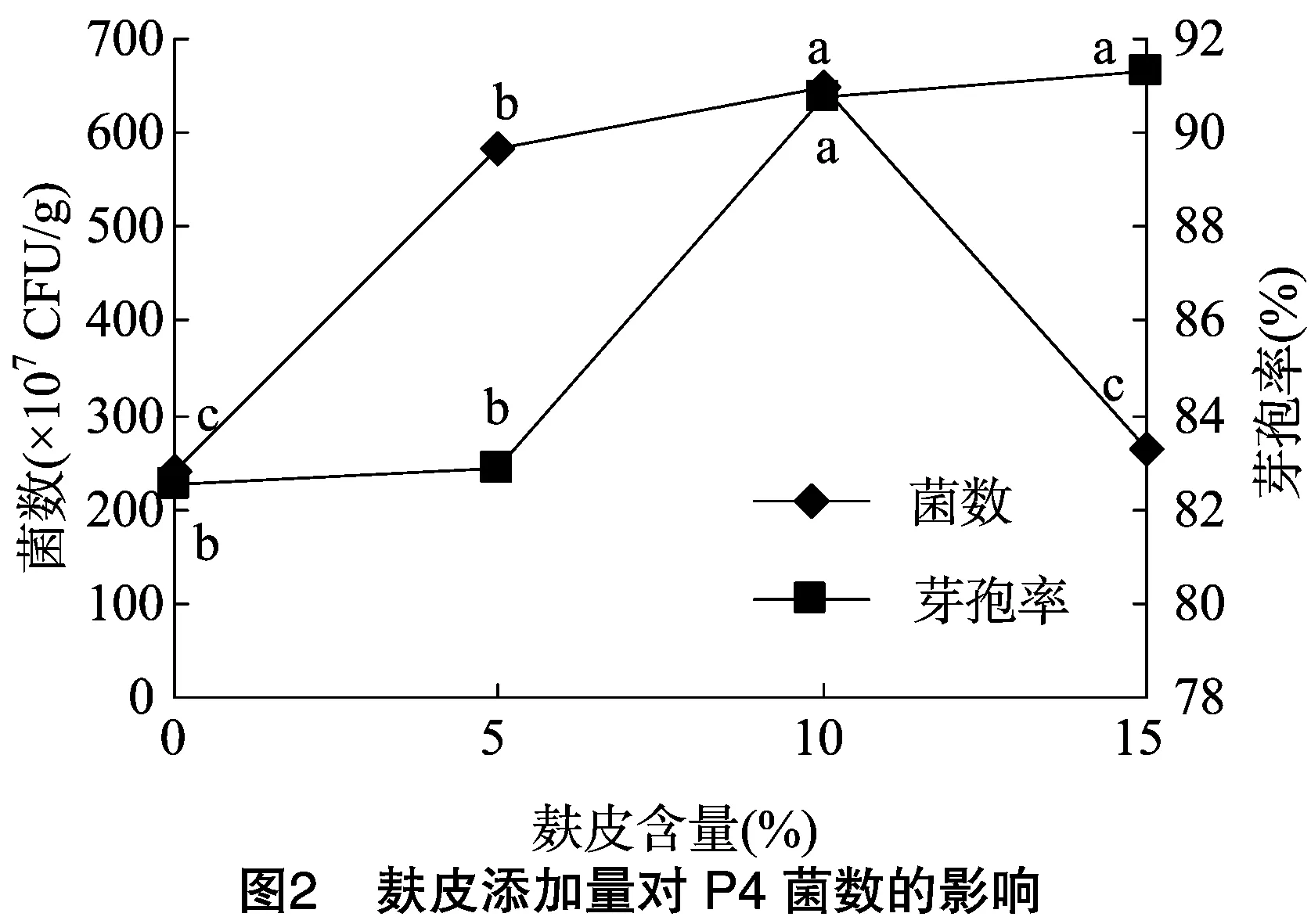
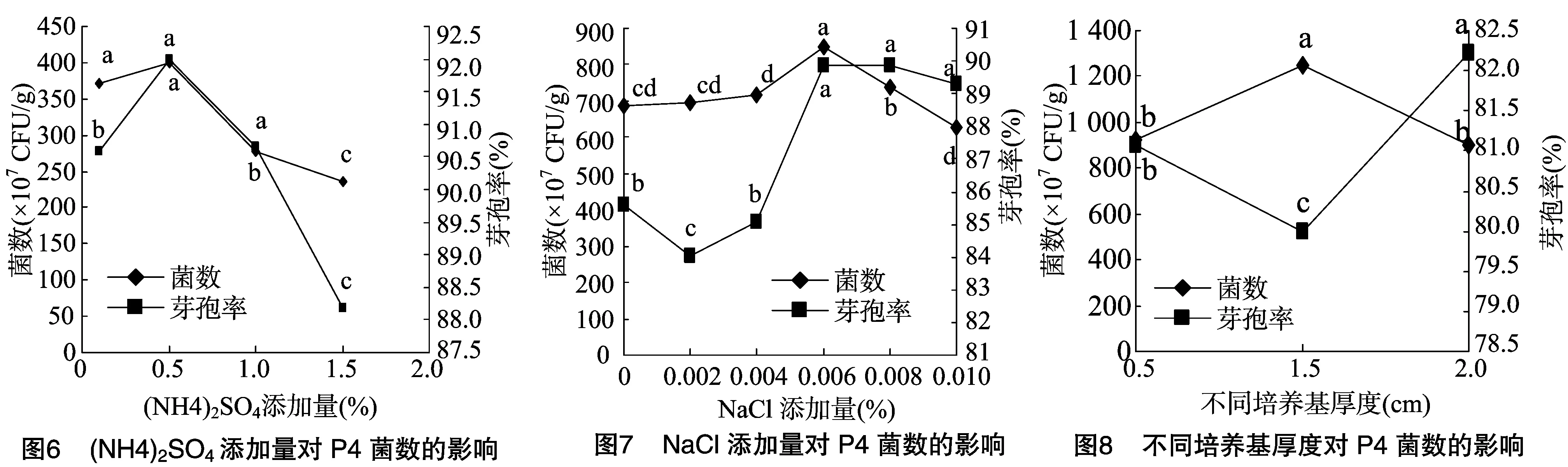
2.1.1 单因素试验结果与分析 枣树枝条中含纤维素、半纤维素及糖分等营养物质,固体培养基中添加量优势较为明显,图1显示,当培养基中枣树枝条添加量为60%(即桑树枝条添加量为34.46%)时,菌数达3.98×109CFU/g,与添加量为90%(桑树枝条4.46%)时无显著差异,但芽孢率达82.91%,显著优于添加量为90%的组分。麸皮为芽孢杆菌菌剂制备中常用的原料,图2显示,在5%~10%范围内培养基中菌数及芽孢率较高,当添加量为10%时,菌数达6.50×109CFU/g,芽孢率达 90.77%,显著高于其他浓度。K2HPO4·3H2O、MgSO4·7H2O参与细菌细胞壁的形成[18],其中镁离子是微生物生长代谢中必不可少的酶的激活剂,图3显示,培养基硫酸镁添加量为0.10%时,菌数达7.50×109CFU/g,显著高于其他组分;由图4可知,K2HPO4·3H2O的添加量为0.5%时,菌数达4.40×109CFU/g,芽孢率达86.36%,显著高于其他组合。已有学者研究表明,吡啶二梭酸钙是活菌数形成芽孢的重要组成成分[18-19],溶液中钙离子促进芽孢的形成,但过量的钙离子会与磷酸盐反应生成不溶性沉淀,造成培养液中磷元素的损失,由图5可知,当培养基中CaCl2的添加量为0.008%时,菌数达9.34×109CFU/g,芽孢率达90.94%,显著高于其他组分。由图6显示,(NH4)2SO4添加量为0.5%时,菌数达4.00×109CFU/g,芽孢率达92.00%,显著优于其他组合。由图7可知,NaCl添加量为0.06%时,菌数达8.50×109CFU/g,芽孢率达89.88%,显著优于其他组合。单因素试验结果显示,枣树枝条、麸皮、MgSO4·7H2O、K2HPO4·3H2O、CaCl2、(NH4)2SO4、NaCl的添加量分别为60%、10%、0.1%、0.5%、0.008%、0.5%、0.06%。

2.1.2 正交试验结果与分析 采用SPSS 19.0统计软件设计合适的正交试验(表2)进一步优化培养基组分,方差分析见表3。通过正交试验结果直观分析表结果显示,各因素对菌数影响程度的顺序为:A>B>G>D>F>C>E,H为误差项。根据各因素水平对应的平均值k可以推断,采用方案A1B1C1D3E3F1G2可获得较高的菌落数。方差分析表如表3所示:A的P值为0.017,B的P值为0.028,在α=0.05水平上均具有显著性(P<0.05),可见培养基中枣树枝条及麸皮的添加量对固体菌剂中活菌数效果影响显著,而C、D、E、F、G因素不具有显著性(P>0.05),最优组合为A1B1C1D3E3F1G2,得出结果与直观分析结果一致。

表2 正交试验结果直观分析
正交最优组合为A1B1C1D3E3F1G2,即枣树枝条30%(桑树枝条64.46%),麸皮5%,(NH4)2SO40.1%,NaCl0.08%,CaCl20.01%,MgSO4·7H2O0.05%,K2HPO4·3H2O0.5%。正交表中无最优项,后续试验验证最优组合菌数及芽孢率分别为3.45×1010CFU/g,芽孢率达94.45%,优于其他组合,验证正交试验的可靠性。
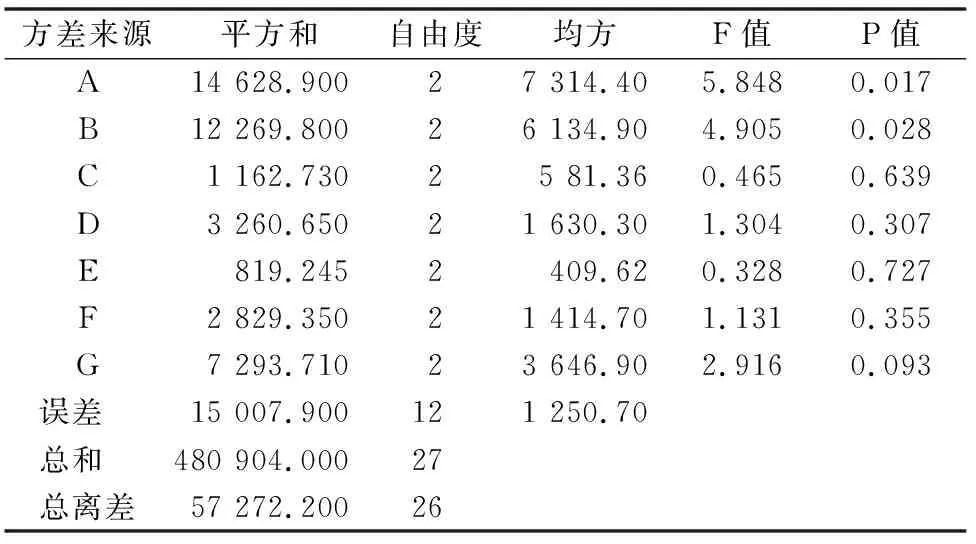
表3 正交试验的方差分析
注:F0.95(2,10)=4.10,F0.99(2,10)=7.56
2.2 固体菌剂培养条件优化
2.2.1 培养基厚度对P4菌数的影响 由图8可知, 培养基厚度对P4菌数影响较大,当培养基厚度为1.5cm时培养基P4菌数及芽孢数达到最大,菌数达12.5×109CFU/g,芽孢率达80.00%,显著优于其他培养基厚度。培养基厚度太薄会加速水分的挥发,使得菌剂容易缺水,而当培养基厚度过厚时细菌生长过程中的二氧化碳及氧气的扩散、营养物质的吸收及代谢产物的形成、酶的催化等都会受到阻碍[20],所以培养基过厚会影响P4菌的正常生长代谢。综上所述,最优培养基厚度选为1.5cm。
2.2.2 料水比对P4菌数的影响 含水量在固体发酵中会直接影响到菌体的正常生长、代谢,是一个非常关键的因素。图9所示,随着培养基中含水量的增加,P4菌数及芽孢率呈现明显的上升趋势,培养基中含水量太少,导致营养物质无法很好地溶解,固体基质膨胀度太低,菌体正常生长、代谢会受到抑制。培养基料水比为1 ∶1与1 ∶1.5培养基中的菌数无显著差异,为了防止培养后期因水分的蒸发而使得菌数下降,选择料水比为1 ∶1.5时为宜,菌数达 1.2×1010CFU/g,芽孢率达87.5%,而继续增加水分会导致基质内透气性差,使得氧气不足,对菌体生长造成影响。
2.2.3 接种量对P4菌数的影响 由图10可见,当菌液接种量在1%~15%时,P4菌数及芽孢率随接种量的增大而上升,当接种量为15%时,菌数达8.00×109CFU/g,芽孢率达87.88%,显著高于其他组分,但接种量继续增大反而不利于菌体的生长。综上所述,最优菌液接种量为15%。
2.2.4pH值对P4菌数的影响pH值会影响细菌细胞膜上的电荷,影响其对营养物质的吸收,合适的pH值会促进菌体的生长及代谢[21]。目前,由于固体发酵含水量一般较少,相对于液体发酵,其pH值难以检测,一般选择调节培养基的初始pH值。由图11可见,pH值在5.0~7.0内随着pH值增加,P4菌数及芽孢率均呈现上升趋势,固体发酵最适pH值为7.0,菌数达1.5×1010CFU/g,芽孢率达80.00%,与刘唤明等的研究[22]相符,但当pH值继续增加时,菌数及芽孢率均呈现下降趋势。综上所述,最适pH值为7.0。

2.3 最优条件下固体菌剂验证
配制最佳培养基组成,培养条件选择最优,优化后的固体菌剂菌数达4.5×1010CFU/g,芽孢率达94.57%,均显著高于其他组分。
2.4 固体菌剂养分含量的测定
优化后的固体菌剂各养分含量为全氮 (18.30±0.035)g/kg,碱解氮(1.56±0.028)g/kg,灰分(10.45±0.207)%,纤维素(18.54±0.735)%,半纤维素(9.465±0.516)%,木质素(18.54±0.735)%,总有机物达(89.55±0.207)%。该固体菌剂养分含量均很高,有效改良干旱退化土壤。大部分微生物无法直接分解利用纤维素,半纤维素等营养物质,目前已通过从自然界直接筛选、原生质体融合育种、诱变育种及基因工程育种等方式获得了多株降解枝条、作物秸秆等的微生物[23],目前研究最多的为白腐真菌[24]。后期可采用经白腐真菌等高效降解菌处理过的粉碎枝条为固体基质,提高粉碎枝条的利用率。
3 结论与讨论
诸多研究表明,固体菌剂可有效促进土壤养分的转化、释放及分解,固体菌剂包括不同具解磷解钾及固氮等功能的细菌,可有效促进作物生长、提高土壤养分[25-26]。采用特殊环境中的贫营养细菌改造相应恶劣的生态环境,是目前一种新型改善土壤荒漠化、贫瘠化途径[27],贫营养细菌长期生存在贫瘠环境甚至更极端的环境中,对外界环境的变动性具强大的快速基因调控能力。本研究中的贫营养细菌为兼性贫营养菌,降低生产成本。固体基质主要选用粉碎的枣树枝条和桑树枝条,不但能有效解决枝条焚烧导致的环境污染问题,提高产业附加值,还可为制备固体菌剂提供新型的优质原料。
本试验通过单因素试验、正交试验对贫营养细菌固体菌剂发酵工艺进行优化,并对优化后的固体菌剂各养分含量进行测定。通过正交试验设计筛选出麸皮,枣树枝条2个显著影响菌体生长的关键因素,固体发酵最佳培养基组成为:枣树枝条30%(桑树枝条64.46%),麸皮5%,(NH4)2SO40.1%,NaCl0.08%,CaCl20.01%,MgSO4·7H2O0.05%,K2HPO4·3H2O0.5%。优化培养条件为培养基厚度1.5cm,料水比 1 ∶1.5,接种量15%,pH值7.0。优化条件下菌数达4.5×1010CFU/g,芽孢率达94.57%,与其他学者采用玉米粉、豆饼粉等基质优化结果一致。优化后的固体菌剂养分含量为:全氮18.30g/kg,碱解氮1.56g/kg,灰分10.45%,纤维素 18.54%,半纤维素9.465%,木质素18.54%,总有机物达 89.55%。本研究为该菌剂开发及应用提供了理论基础。该固体菌剂可对贫瘠土壤的理化性质、持水性有一定的改善,后续须试验验证固体菌剂对贫瘠土壤的改良效应,此外在工业化生产中很难达到实验室小试效果,今后迫切须要解决如何使工业化生产达到小试效果的问题。

