微藻种类对其热解质量损失规律和产物及动力学的影响
王浚浩,张 雨,杨优优,左照江,马中青※
微藻种类对其热解质量损失规律和产物及动力学的影响
王浚浩1,张 雨1,杨优优2,左照江3,马中青1※
(1. 浙江农林大学 工程学院 浙江省竹资源与高效利用协同创新中心,临安 311300;2. 浙江农林大学农业与食品科学学院,临安 311300;3. 浙江农林大学林业与生物技术学院,临安 311300)
微藻是一种新型的可再生生物质资源,采用快速热解技术,可得到高品质的先进液体燃料和高附加值化学品。该文采用热重-红外联用仪、快速热解-气质联用仪和分布式活化能动力学模型(distribution activation energy model,DAEM)对莱茵衣藻(,CDR)、小球藻(,CRV)和铜绿微囊藻(,MCA)的热解行为开展了研究,系统地对比了3种微藻在化学组成、热解失重规律、动力学、热解产物等方面的差异,并对微藻的热解机理进行了探讨。结果表明:1)3种微藻的热解过程可分为3个阶段,分别为干燥段、快速热解段和炭化阶段,其中铜绿微囊藻失重率最大,达到17.34 %/min,且随着升温速率的增加,TG/DTG(thermogravimetry/differential thermogravimetry)曲线往高温一侧移动;2)红外光谱分析结果表明微藻热解主要产物为CH4、CO2、含C=O键的脂肪酸、含N-H键和C-N键的酰胺类化合物,其中莱茵衣藻热解产生的CH4质量分数最高,铜绿微囊藻热解产生的含C=O键化合物质量分数最高;3)铜绿微囊藻的活化能数值最高,随着转化率增加,活化能从100增加到680 kJ/mol;4)Py-GC/MS分析表明小球藻热解产生的含氧化合物质量分数最高,达到30.89%,铜绿微囊藻热解产生的酚类化合物、芳香族碳氢化合物、胺和酰胺类和其他含氮化合物的质量分数最高,分别达到10.41%,13.46%,13.87%和14.27%。本文可为微藻的能源化利用提供科学和基础数据。
热解;动力学;微生物;微藻;热重-红外联用;热解-气质联用
0 引 言
微藻是一类真核单细胞微生物,主要由蛋白质、脂类和多糖组成,是一种新型的可再生生物质资源[1-3]。近年来,微藻快速热解技术取得了快速发展,在较快的升温速率和较短的停留时间条件下,它能把低品质的微藻转化为高附加值化学品[4-5],现已成为研究热点[6-7]。
微藻快速热解液体产物的性质主要受微藻种类、热解反应器类型、热解工艺等因素的影响[6-7]。微藻的种类是首要影响因素,黄永福[8]对小球藻和盐生杜氏藻的热解产物的产率及特性进行了对比研究,结果发现在550 ℃时盐生杜氏藻的生物油产率(64.87%)略高于小球藻(60.67%)。王君等[9]对龙须菜、角叉菜和马尾藻3种海藻的热解失重规律及动力学开展了对比研究,结果发现角叉菜的热解活化能与热稳定性均最低。Chen等[10]对浒苔,钝顶螺旋藻和微拟球藻3种微藻的热解产物的产率及特性进行了对比研究,结果表明钝顶螺旋藻和微拟球藻的生物油产率最高,而浒苔的生物炭产率最高。Wang等[11]和Kebelmann等[12]通过对微藻中的脂类、蛋白质和多糖等组分的热解试验发现,脂质通过脱羧、脱羰反应以及裂解的形式转化为烃、羧酸和酯;蛋白质通过脱羧、脱氨反应、烃残基碎裂、肽键的二聚和断裂反应转化为酰胺、胺、腈、酯、烃和N-杂环化合物;碳水化合物通过脱水反应转化为酮和醛。
此外,不同的热解反应器也会对热解液体产物的产生显著影响,如热重-红外联用仪(TGA-FTIR)和快速热解炉-气相色谱/质谱联用仪(Py-GC/MS)[13-14]。郝小红等[15]利用TGA对裂殖壶藻的热失重规律和活化能开展了研究,结果表明热失重主要为干燥、快速热解和炭化阶段。Söyler等[16]利用TGA-FTIR研究了杜氏盐藻的热解挥发分组分,发现挥发分主要由小分子气体组分(CO2、H2O和CH4)和有机组分(醇类、醛类、酸类和酚类)组成。然而,除了小分子气体组分,红外光谱无法有效区分含有同类官能团的有机挥发分组分并进行定性分析。而快速热解炉-气相色谱/质谱联用仪(Py-GC/MS)可利用GC/MS的质谱图和相对峰面积法可对单个热解组分实现在线的定量和定性分析。Almeida等[17]利用Py-GC/MS对小球藻和钝顶螺旋藻的热解产物进行了研究,发现微藻热解可产生轻质芳烃和含氮杂环化合物等高附加值化学品。Zhao等[18]利用Py-GC/MS对等鞭金藻和小球藻的热解产物进行了研究,与纤维素类生物质热解产物相比,微藻热解会产生大量的含氮杂环化合物,其质量分数可达209 mg/g。
本文选取了3种典型的微藻,包括莱茵衣藻()、小球藻()和铜绿微囊藻(),根据三者中蛋白质、脂类和碳水化合物的质量分数差异,开展其热解行为的对比研究,目前还未见相关文献报道。分别采用热重-红外联用仪(thermogravimetry-fourier infrared spectrometer, TG- FTIR)、快速热解-气质联用仪(pyrolysis-gas chromatography mass spectrometer, PY-GC/MS)和分布式活化能动力学模型(distribution activation energy model,DAEM)对莱茵衣藻、小球藻和铜绿微囊藻的热解行为开展了研究,系统地对比了3种微藻在化学组成、热解失重规律、动力学、热解产物等方面的差异,并对微藻的热解机理进行了探讨。
1 材料与方法
1.1 微藻的选取和培养
1.1.1 藻种选取
本文选取了3种典型的微藻,分别为莱茵衣藻(,CDR)、小球藻(,CRV)和铜绿微囊藻(, MCA)。铜绿微囊藻和小球藻的品种分别为FACHB- 912和FACHB-25,均由中国水生生物研究所淡水藻类培养物保藏中心提供,根据Rippka等[19]提供的方法在BG-11培养基中进行培养。
1.1.2 藻种培养
莱茵衣藻品种为cc-125野生型mt+ [137c],由美国杜克大学提供,根据Gorman等[20]提供的方法在TAP培养基(tris-acetate-phosphate medium)中进行培养。当藻细胞密度达到中间对数期时,利用6 000 g/min离心机离心分离5 min并收集;收集后马上使用冷冻干燥机(LGJ-18D,上海比朗仪器制造有限公司)进行冷冻干燥;然后将其放置于40 ℃的真空烘箱中24 h至恒定质量;最后将微藻进行研磨和筛选,使其粒径保持在120~150m,用以开展化学组分分析和热解试验。
1.2 微藻的元素分析、生物化学组分和热值测定
1.2.1 分析仪器
采用元素分析仪(Vario EL III,德国Elementary公司)的CHNS模式对微藻的有机元素组分进行测定,其中氧元素通过差减法求出;微藻的热值采用微机量热仪(ZDHW-300A,鹤壁市科达仪器仪表有限公司)进行 测定。
1.2.2 分析方法
根据Pohndorf等[21]文献报道对微藻的脂类质量分数法进行测定,将0.1 g干燥的藻类样品加入5 mL氯仿:甲醇(体积比2∶1)溶液中,在振荡器中搅拌1 h,离心分离后将沉积的藻类干燥并称质量,利用公式(1)计算脂类质量分数1。
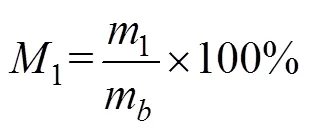
式中1为脂质质量,g;m为微藻原料的质量,g。
根据凯氏定氮法(GB/T 6432-1994),利用凯氏定氮仪(Kjeltec TM2100)对微藻中蛋白质的质量分数进行测定。碳水化合物的质量分数测定可以通过质量守恒的方法来测得[18]。
1.3 微藻的热解试验
1.3.1 热重红外联用(TGA-FTIR)分析
采用热重红外联用仪(TGA 8000-Frontier, 美国PerkinElmer公司)对微藻的热解失重规律及其热解挥发分的组分进行分析,其中热重和红外分析仪之间采用保温为285 ℃的气体传输管路进行连接。每次试验,将30 mg的微藻粉末加入Al2O3坩埚,以5、10、20和 30 ℃/min的升温速率从室温升至800℃,载气为高纯氮气(99.999%),流量为45 mL/min。傅里叶红外分析仪的分辨率和光谱区域分别为4 cm-1和500~4 000 cm-1,频谱扫描时间间隔为8 s。
1.3.2 快速热解-气相色谱/质谱联用(Py-GC/MS)分析
采用快速热解炉(CDS 5200, 美国Chemical Data Systems公司)和气相色谱/质谱(7890B-5977B, 美国Agilent Technologies公司)联用仪对微藻快速热解产物实现在线分析。每次试验,以石英棉为上下垫层并在石英管正中间加入0.1 mg微藻。热解炉以20 ℃/ms的升温速率升至不同的热解终温(450、550、650、750、850和950 ℃),热解温度保持时间为20 s,热解产物通过GC/MS实现在线记录和分析。载气为高纯氦气(99.999%),载气He 流速1 mL/min,传输线和进样口温度为分别为280、230 ℃,色谱柱为HP-5MS毛细管柱(30 m×0.25 mm×0.25m),分流比为1∶50。柱箱的升温程序为:从40 ℃(保持3 min)以10 ℃/min升至280 ℃(保持3 min)。质谱工作条件为:70 eV, 质荷比(/)为50~400,离子源温度230 ℃,四级杆温度150 ℃,全扫描模式,溶剂延迟时间3 min。根据NIST谱库并结合相关研究文献,对热解产物进行组分鉴定和相对含量分析,用峰面积归一化法计算各组分相对含量[22]。
1.4 热解动力学分析
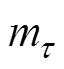
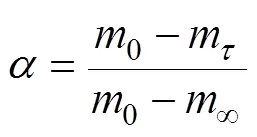
式中为质量转化率;0为藻类的初始质量,mg;m为时刻对应的藻类质量,mg;∞为热解温度达到最大值时的剩余质量,mg。
DAEM模型是计算非等温热解动力学普遍采用的一种活化能计算方法,活化能和转化率关系式如(3)所示。
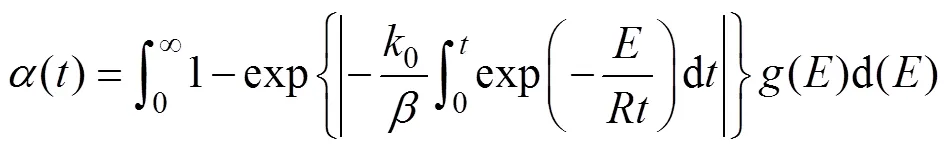
式中0是指前因子,min-1;是活化能,kJ/mol;是摩尔气体常数,8.314×10-3kJ/(K·mol);是升温速率, ℃/min;是热力学温度,K;()代表活化能分布函数,见公式(4)。
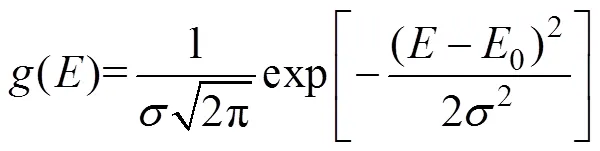
式中0为平均活化能,为标准差;将(4)、(3)合并得到公式(5)
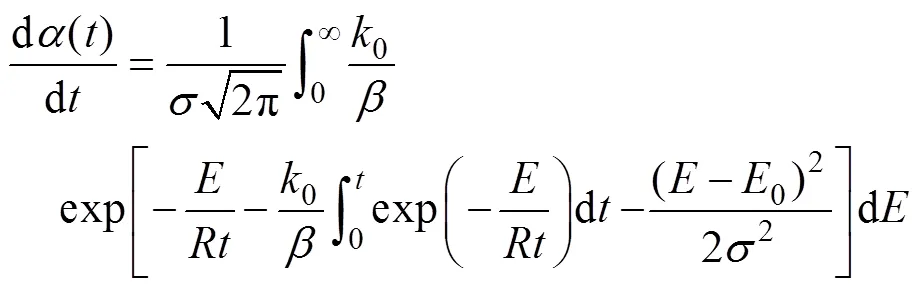
通过进一步的积分整理可得公式(6)
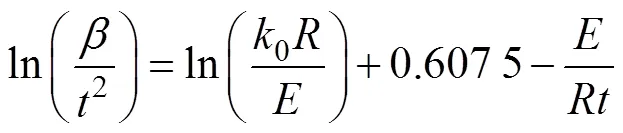
本文中,研究在转化率相同的条件下,通过改变不同的升温速率,使得ln(/2)与1/成线性函数关系,通过斜率-/求出活化能,通过截距ln(0/)+ 0.607 5求出指前因子。
2 结果与分析
2.1 3种微藻的元素、化学组分和热值分析
3种微藻的元素、化学组分和高位热值分析见表1。
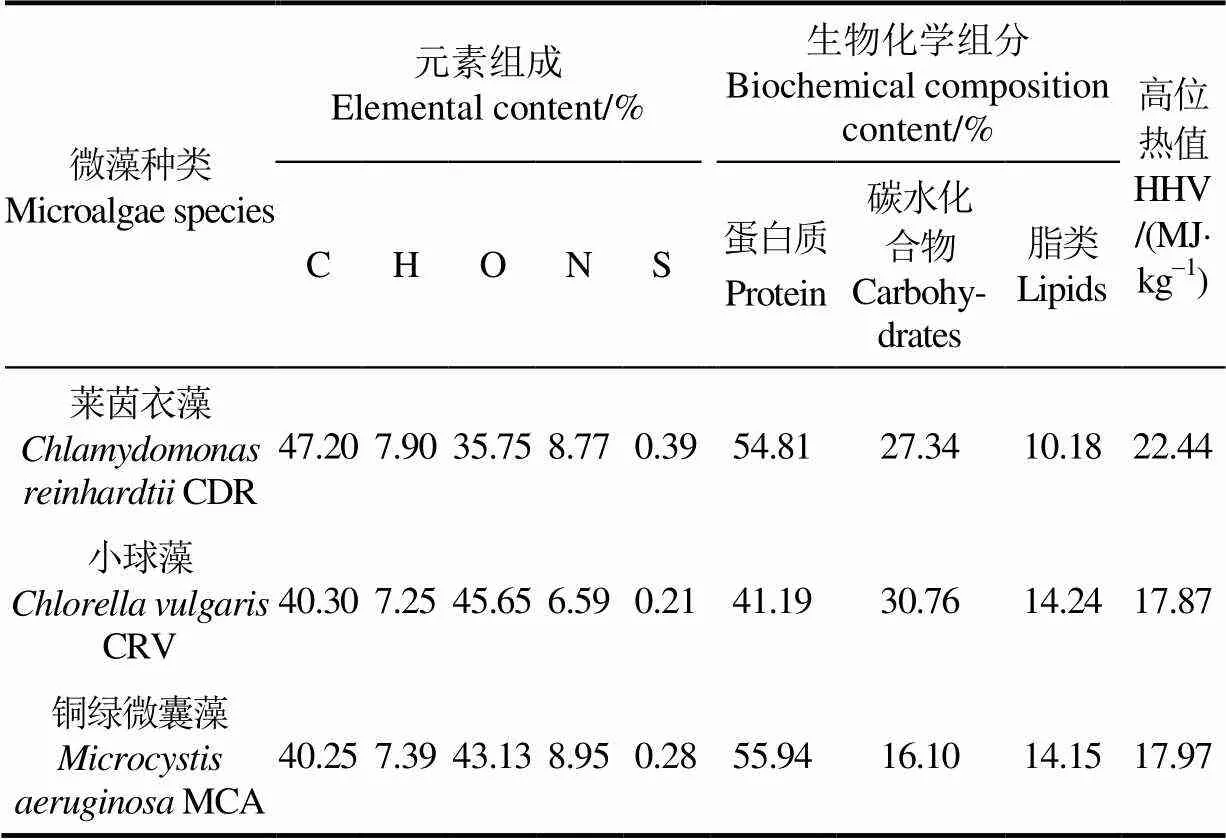
表1 铜绿微囊藻、小球藻和莱茵衣藻的元素、化学组分和高位热值分析
表1中莱茵衣藻的C和H质量分数最高,分别为47.2%和7.9 %,因此其热值也最高,达到22.44 MJ/kg;铜绿微囊藻中蛋白质质量分数最高,达到55.94 %; 小球藻中碳水化合物和脂类质量分数最高,分别为30.76%和14.24%。
2.2 微藻的TGA(Thermogravimetry analysis)分析
图1为3种微藻在不同升温速率时(5、10、20和30 ℃/min)的TG-DTG曲线。3种藻的热解过程可以分为3个阶段:干燥段、快速热解段和慢速热解(炭化)阶段。1)在干燥段,温度范围为30~150℃,出现微小的失重峰,主要来自于自由水的蒸发[13]。铜绿微囊藻在该阶段的峰值失重率轻微高于莱茵衣藻和小球藻,主要是因为铜绿微囊藻的含水率略高于莱茵衣藻和小球藻。2)在快速热解阶段,温度范围为150~550 ℃,3种藻类热解失重率约为60%,主要来自于微藻中蛋白质、脂类和碳水化合物等主要组分的热降解[20]。其中莱茵衣藻仅有一个失重尖峰(2号峰),而小球藻和铜绿微囊藻除了存在失重尖峰外(2号峰),还存在一个微弱的失重肩峰(3号峰),并且铜绿微囊藻在峰值处的失重率最大,达到17.34 %/min,主要原因是铜绿微囊藻中蛋白质和脂类质量分数更高,根据蛋白质和脂类的单独热重曲线可知,而蛋白质和脂类更易在此阶段发生热解[23-24]。Maurya等[25]通过不同升温速率(5、10、20和35 ℃/min)对去除脂类的小球藻进行热重规律分析发现,在升温速率35 ℃/min,温度为302 ℃时,去除脂类的小球藻在峰值处的最大失重率仅为-8.91%/min,与本文中小球藻在温度为327 ℃时峰值处的最大失重率-13.8 %/min差距很大,说明脂类对藻种热解行为的显著影响。3)在慢速热解(炭化)阶段,温度范围为550~800 ℃,快速热解阶段残余的固体物质通过慢速热解转化为生物质炭[24]。
结合图1可知,升温速率对微藻的热解行为有显著影响,随着升温速率的增加:1)一方面3种微藻的TG/DTG曲线逐渐往高温一侧移动,因为微藻是一种热的不良导体,其次微藻颗粒本身也存在温度梯度,随着升温速率的增加,试样颗粒内的温度梯度增加,从而导致了热滞后现象的发生[26];2)另一方面,取相同温度点的失重率数值,随着升温速率增加,单位时间内的失重率逐渐增加,主要原因是升温速率增加加强了热重反应炉和样品内部之间的热传导,使得失重率增加[27]。
2.3 3种微藻的FTIR分析
图2 a、2b、2c为升温速率为20 ℃/min时3种微藻热解的3D-FTIR图,由图可知,热解挥发分存在6个显著的特征红外吸收带,分别位于3 734、2 938、2 360、1 770、950和667 cm-1处,证明此5类物质为挥发分的主要组分。图2 d为3种藻在失重率峰值处的2D-FTIR图,利用特征吸收峰所对应的官能团可对8类挥发分进行鉴定,主要分为无机气体组分和有机组分:1)相较于有机组分,无机小分子气体组分(H2O、CH4和CO2)的特征峰更加清晰,其中3 750 cm-1处为O-H键的伸缩振动,代表的是水分子(H2O),主要来自于干燥阶段自由水的蒸发和热解阶段结合水的生成[28];2 890 cm-1处主要是C-H键的伸缩振动,代表的是CH4,主要来自于热解过程中甲基(-CH3)和亚甲基(-CH2-)的断裂[29];2 368和667 cm-1处主要是C=O键的伸缩振动,代表的是CO2,主要来自于热解阶段脱羧基(-COOH)和脱羰基(-C=O)反应[30]。2)有机组分的鉴定:1 740 cm-1为C=O键的伸缩振动,代表的是脂类化合物,主要来自于微藻中脂类和脂肪酸组分的热降解[16];1 545 cm-1处为N-H键和C-N键的对称伸缩和对称变形振动,称为酰胺Ⅱ红外特征带,主要来自于含氮的蛋白质组分热解产物,包括十六碳酰胺、亮氨酸、苏氨酸等[31];1 396 cm-1为C-H键和C-O键的伸缩振动,主要来自于微藻中脂肪和碳水化合物组分热解产生的烷烃、醇类或酚类物质[32];1 250 cm-1为C-O-C键的伸缩振动,主要来自于微藻热解产生的醚类物质[33];950 cm-1处为Si-O键和P-O-P键伸缩振动,其中Si-O键主要来自于微藻中的无机组分(硅磷酸盐),P-O-P键主要来自于核酸热解产生的磷酸二酯和磷脂[32]。

图1 3种微藻在不同升温速率下的热重(TG)和微分热重(DTG)曲线
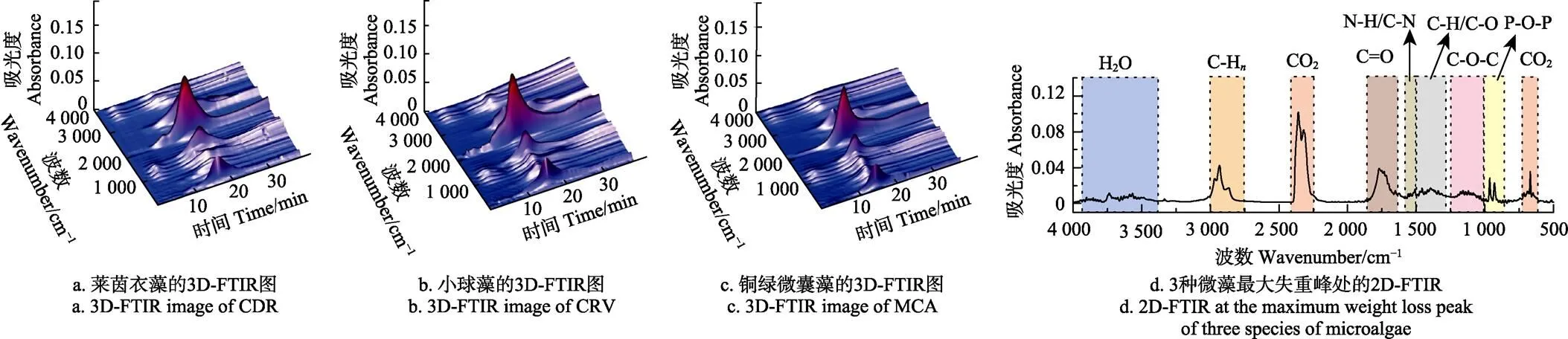
图2 3种微藻在升温速率为20 ℃×min-1时热解的红外光谱(FTIR)分析
2.4 3种微藻的主要挥发分组分分析
图3为3种微藻热解过程4种主要挥发分组分的吸光度随温度增加的演变规律,根据Lambert-Beer定律,特征吸收峰的吸光度越高,对应挥发分的相对质量分数也就越高[28-29]。1)图3a为H2O的演变规律,主要有2个释放峰,第2个峰的质量分数远高于第1个峰。第1个峰在100~200 ℃,此阶段的H2O主要来自于干燥阶段水分的蒸发;第2个峰在200~500 ℃,3种藻类的水分释放集中在200~500 ℃的峰,这和DTG曲线的阶段1一致。此阶段的H2O主要来自于快速热解阶段中结合水的生成,源于微藻组分(蛋白质、脂类和碳水化合物)的脱羟基反应。其中铜绿微囊藻热解产生的水分质量分数最高,因为水分主要来自于其高质量分数的蛋白质(55.94%)在330~350 ℃发生的分解[24]。2)图2b为CH4的演变规律,3种微藻在200~600 ℃范围内均出2个现峰,这和DTG曲线阶段2和阶段3一致,其中第1个峰的强度远高于第2个峰。第1个峰主要来自碳水化合物(290 ℃)和蛋白质(330 ℃),第2个峰主要来自少量蛋白质和大部分脂类(410 ℃)[24]。第1个峰是主要成分碳水化合物和蛋白质的降解,造成第1个峰比第2个高。而3种藻类脂类质量分数普遍较低(10%左右),莱茵衣藻的第2个肩峰显得较为平缓,其他2种藻类虽出现尖峰,但吸光度也远小于第1个峰。其中莱茵衣藻的CH4组分质量分数高于其他2种藻类,主要原因是CH4主要来自于脂类,DNA和蛋白质中脱甲基(-CH3)反应[33],源于脂类中脂肪酸烃链的断裂以及蛋白质和碳水化合物的分解[23]。而莱茵衣藻中碳水化合物和蛋白质质量分数总和(82.15%)远超其他2种藻类(小球藻71.95%、铜绿微囊藻70.74%),使得其热解CH4质量分数最高。3)图3c为CO2的演变规律,在200~500 ℃出现1个释放峰,此处和DTG曲线所在的阶段2最大失重率处相一致,主要来自于微藻组分的源于脱羧基和脱羰基反应,是几种挥发分组分中质量分数最高的物质,3种微藻产生的CO2质量分数非常接近。4)如图3d为含C=O键的有机化合物的演变规律,在200~500 ℃出现1个释放峰,这和DTG曲线阶段2一致,主要是蛋白质和脂类引起[24],C=O伸缩振动峰源于脂类中甘油三酸酯[34]以及蛋白质中的酰胺Ⅰ类[35]。铜绿微囊藻的高脂质质量分数和高蛋白质质量分数分别为14.15%和55.94%,显示最大吸收强度和最高吸收峰。
2.5 3种微藻的动力学分析
图4a、4b、4c为3种藻类的DAEM动力学模型的线性拟合曲线, 当转化率在0.05~0.7范围内,拟合曲线的相关系数2整体上都超过0.9,说明拟合效果非常理想,据此计算得到的活化能数值也比较稳定可靠。图4d为转化率与活化能之间的关系,随着转化率的增加,3种藻的活化能数值呈现上升的趋势,铜绿微囊藻的活化能从100增加到680 kJ/mol,小球藻的活化能从40增加到265 kJ/mol,莱茵衣藻的活化能从20增加到250 kJ/mol。铜绿微囊藻、小球藻和莱茵衣藻的平均活化能分别为171.63、148.56和155.75 kJ/mol,其中铜绿微囊藻的活化能数值最高。Peng等[36]通过FWO(Flynn Wall Ozawa)和KAS(Kissinger Akahira Sunose)动力学模型计算小球藻的活化能分别为110.5~146和105.2~111 kJ/mol,与本文中通过DAEM法计算小球藻的活化能数值具有很好的参考性,也说明了DAEM动力学模型对微藻热解行为及其动力学研究的适用性和可行性。活化能数值大小与微藻的组分(蛋白质、脂肪和碳水化合物)的质量分数及其各自的热稳定性存在显著关联性[37],Bui等[38]利用热重分析仪对蛋白质、脂肪和碳水化合物组分的单独热解行为开展了研究,发现蛋白质和脂肪的热稳定性更好,活化能数值更高,而铜绿微囊藻的蛋白质质量分数显著高于其他2种藻,脂类质量分数也相对较高,因此导致铜绿微囊藻的热解活化能数值最高。
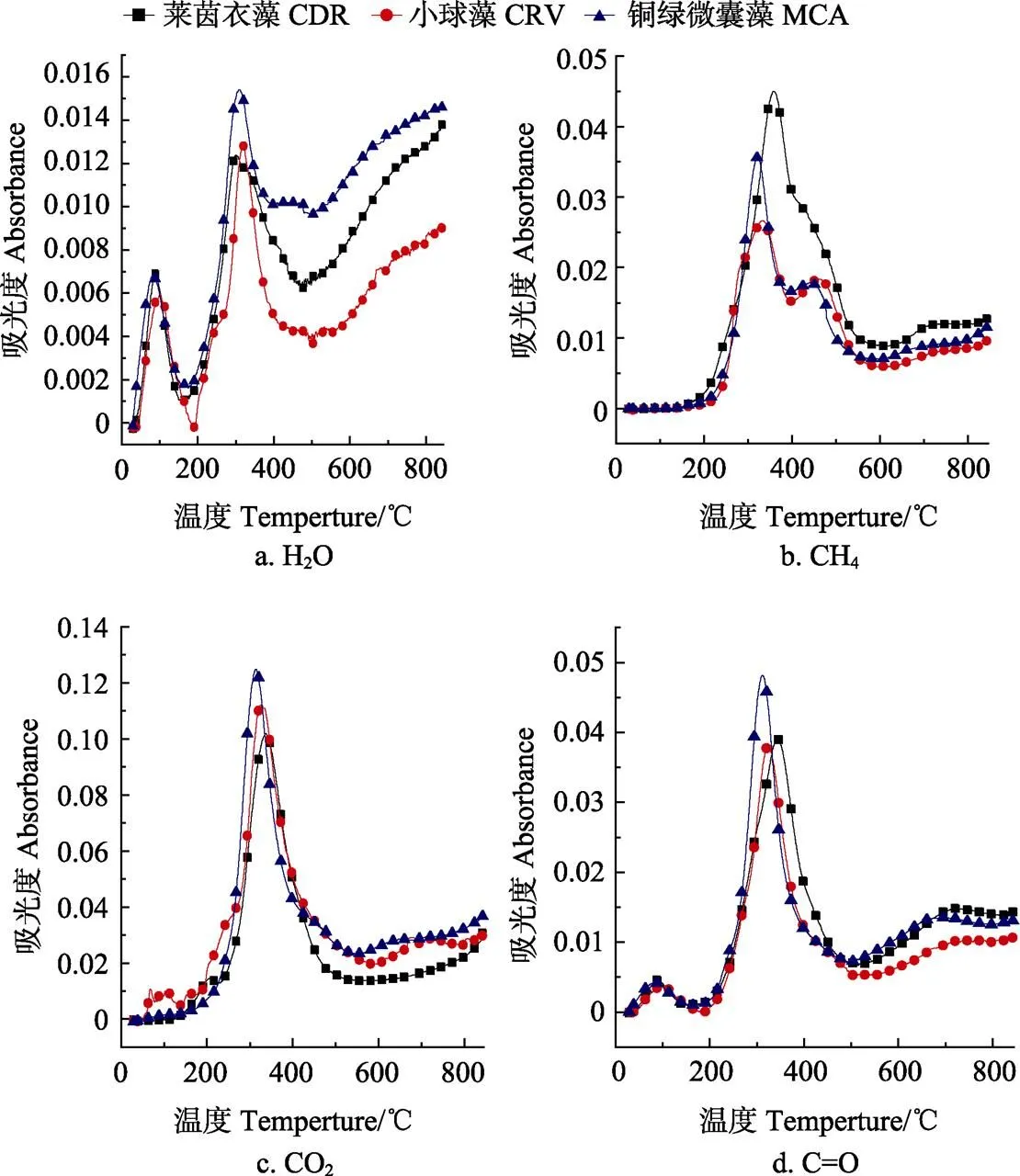
图3 3种微藻热解主要挥发分演变规律
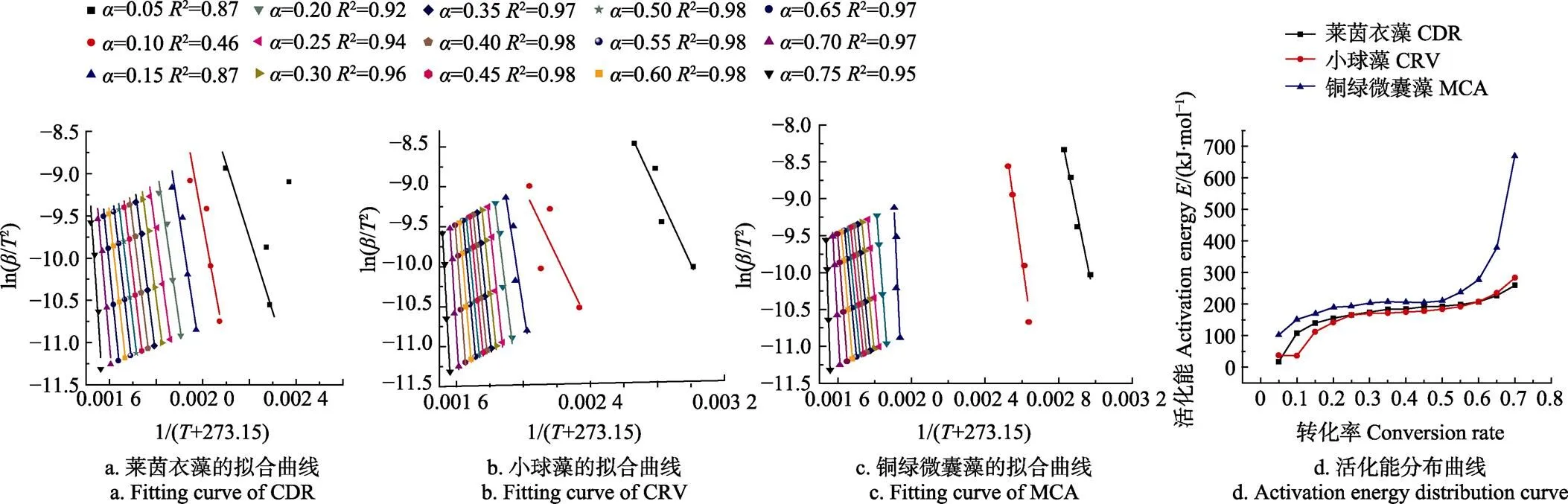
注:a为转化率。
2.6 3种微藻的Py-GC/MS分析
表2列出了3种微藻在典型热解温度(550 ℃)下的生物油产物种类。由于微藻的基本组分中含有蛋白质,是1种高含氮聚合物,因此与纤维素类生物质的热解油的组分存在显著差异,主要体现在含氮化合物,如吲哚、吡咯和苯乙腈等[39]。蛋白质包含吡啶、吲哚、吡咯、酰胺等多种含氮化合物,蛋白质的原始结构氨基酸是许多热解产品的来源,如微藻蛋白中的絡氨酸和苯丙氨酸在很多芳香族碳氢化合物中如甲苯、苯酚中均有发现,而大量芳香烃的生成和腈的产生也和微藻蛋白的酰胺脱水缩合反应有关[39]。
图5为3种藻类快速热解产物质量分数差异图。图5a为非芳香族碳氢化合物和含氧化合物的质量分数差异,根据GC/MS解谱结果可知,以上2类产物主要为碳原子数在10~25的长直链烷烃、烯烃、醛酮类、脂肪酸和酯类。Wang等[39]报道以上2类物质主要来自于微藻中脂类和碳水化合物组分的热解,脂类的主要组分为长碳链的甘油三酯,热解时由于C-C键断裂、羧酸的环化和芳构化产生了较多的脂类衍生物。碳水化合物热解会产生大量的酮醛类、醇类等含氧化合物。由于小球藻中碳水化合物质量分数最高,因此其热解产生的含氧化合物质量分数最高,达到30.89%。图5b为酚类化合物和芳香族碳氢化合物的质量分数变化,黄永福[8]和Anand等[40]报道蛋白质组分热解主要产生酚类化合物和芳香族碳氢化合物,而铜绿微囊藻中蛋白质质量分数最高,因此其热解产生的酚类化合物和芳香族碳氢化合物质量分数最高,分别为10.41%和13.46%。图5c为胺和酰胺类以及其他含氮化合物的质量分数变化,包括含氮芳香族衍生物、吲哚、腈类、萘、酰胺等,此类含氮化合物的主要来源就是氮N元素的蛋白质组分,因为蛋白质中的主 要结构单元为氨基酸[41],而铜绿微囊藻中蛋白质质量分数最高,因此铜绿微囊藻热解产生的胺和酰胺类以及其他含氮化合物的质量分数最高,分别达到13.87%和14.27%。
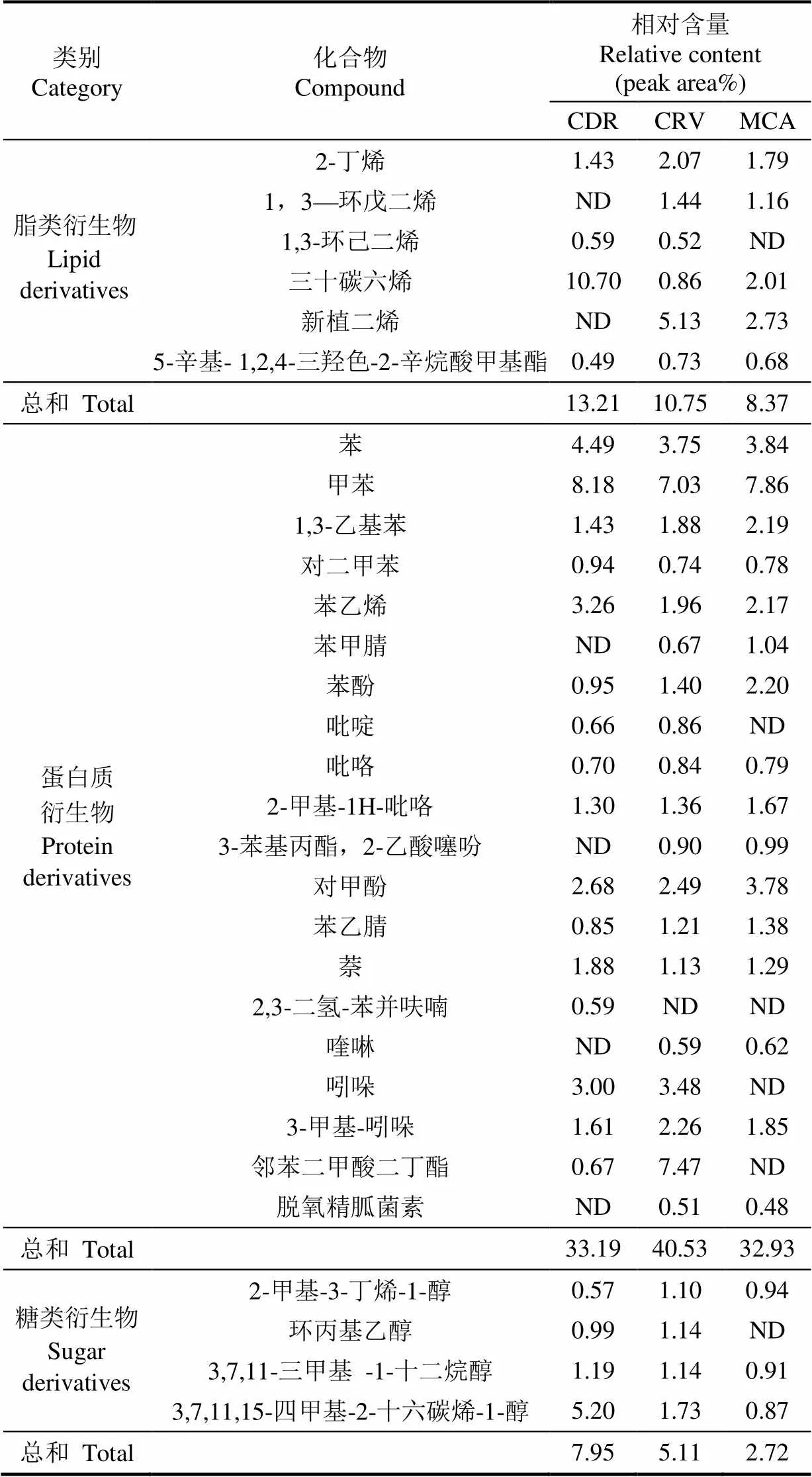
表2 热解温度为550 ℃时3种微藻快速热解典型产物
注:ND,未鉴定。
Note:ND, not dentified.
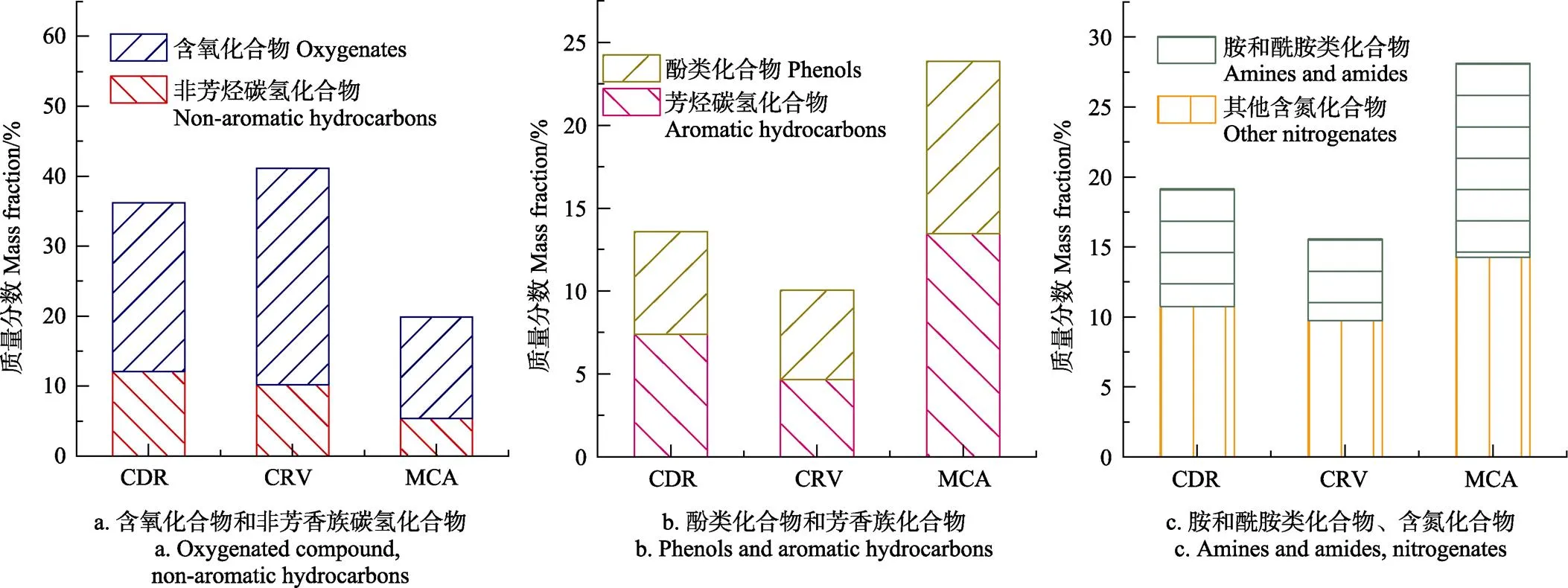
图5 3种藻类快速热解生物油中各组分质量分数
3 结 论
本文采用TG-FTIR、PY-GC/MS和DAEM动力学模型对莱茵衣藻、小球藻和铜绿微囊藻的化学组成、热解失重规律、动力学、热解产物等方面进行了对比研究,结果表明,由于3种微藻中蛋白质、脂质和碳水化合物的含量不同,导致3种微藻的热降解行为存在显著差异。
1)TGA分析表明铜绿微囊藻在快速热解阶段的失重率最大,达到17.34 %/min;
2)FTIR分析表明莱茵衣藻热解产生的CH4含量最高,铜绿微囊藻热解产生的含C=O键化合物含量最高;
3)动力学分析表明铜绿微囊藻的活化能数值最高,随着转化率增加,活化能从100增加到680 kJ/mol;
4)Py-GC/MS分析表明小球藻热解产生的含氧化合物质量分数最高,达到30.89%;铜绿微囊藻热解产生的酚类化合物、芳香族碳氢化合物、胺和酰胺类和其他含氮化合物的质量分数最高,分别达到10.41%、13.46%、13.87%和14.27%。
[1] 刘振强,陆向红,晏荣军,等. 高密度高含油率微藻培养研究进展[J]. 农业工程学报,2011,27(增刊1):210-217. Liu Zhenqiang, Lu Xianghong, Yan Rongjun, et al. Advances on technology of high density and high lipid microalgae culture[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(Supp.1): 210-217. (in Chinese with English abstract)
[2] 王忠江,隋超,王泽宇,等. 小球藻对不同沼液添加量培养液的适应性及净化效果[J]. 农业工程学报,2017,33(3):221-226. Wang Zhongjiang, Sui Chao, Wang Zeyu, et al. Adaptation of chlorella to culture liquid with different biogas slurry adding proportion and its purified effect[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(3): 221-226. (in Chinese with English abstract)
[3] 陈国,赵珺,苏鹏飞,等. 微藻产生物柴油研究进展[J]. 化工进展,2011,30(10):2186-2193. Chen Guo, Zhao Jun, Su Pengfei, et al. Progress in biodiesel production from microalgae[J]. Chemical Industry and Engineering Progress, 2011, 30(10): 2186-2193. (in Chinese with English abstract)
[4] 陈伟,杨海平,刘标,等. 温度对竹屑热解多联产产物特性的影响[J]. 农业工程学报,2014,30(22):245-252.Chen Wei, Yang Haiping, Liu Biao, et al. Effect of temperature on characteristics products derived from bamboo chips pyrolysis based on pyrolytic polygeneration[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(22): 245-252. (in Chinese with English abstract)
[5] 刘标,陈应泉,何涛,等. 农作物秸秆热解多联产技术的应用[J]. 农业工程学报,2013,29(16):213-219. Liu Biao, Chen Yingquan, He Tao, et al. Application of cogeneration technology of gas-liquid-solid products pyrolyzed from crop straw[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(16): 213-219. (in Chinese with English abstract)
[6] Chen W S, Lin B J, Huang M Y, et al. Thermochemical conversion of microalgal biomass into biofuels: A review[J]. Bioresource Technology, 2015, 184: 314-327.
[7] Kumar G, Shobana S, Chen W S, et al. A review of thermochemical conversion of microalgal biomass for biofuels: Chemistry and processes[J]. Green Chemistry, 2017, 19: 44-67.
[8] 黄永福. 普通小球藻和盐生杜氏藻的快速热解特性研究[D]. 武汉:华中科技大学,2013. Huang Yongfu. Research on Fast Pyrolysis Characteristics of Chlorella vulgaris and Dunaliella salina[D]. Wuhan: Huazhong University of Science & Technology, 2013. (in Chinese with English abstract)
[9] 王君,李德茂,张明旭,等. 三种海藻的热解特性及动力学分析[J]. 海洋与湖沼,2006,37(4):304-308. Wang Jun, Li Demao, Zhang Mingxu, et al. Thermolysis and kinetics of the three kinds of seaweed[J]. Oceanologia Etlimnologia Sinica, 2006, 37(4): 304-308. (in Chinese with English abstract)
[10] Chen W, Yang H P, Chen Y Q, et al. Algae pyrolytic poly-generation: Influence of component difference and temperature on products characteristics[J]. Energy, 2017, 131: 1-12.
[11] Wang X, Sheng L L, Yang X Y. Pyrolysis characteristics and pathways of protein, lipid and carbohydrate isolated from microalgae Nannochloropsis, sp[J]. Bioresource Technology, 2017, 229: 119-125.
[12] Kebelmann K, Hornung A, Karsten U, et al. Intermediate pyrolysis and product identification by TGA and Py-GC/MS of green microalgae and their extracted protein and lipid components.[J]. Biomass & Bioenergy, 2013, 49: 38-48.
[13] 马中青,支维剑,叶结旺,等. 基于TGA-FTIR和无模式函数积分法的稻壳热解机理研究[J]. 生物质化学工程,2015(3):27-33. Ma Zhongqing, Zhi Weijian,Ye Jiewang, et al. Determination of pyrolysis characteristics and kinetics of rice husk using TGA-FTIR and model-free integral methods[J]. Biomass Chemical Engineering, 2015(3): 27-33. (in Chinese with English abstract)
[14] 马中青,马乾强,王家耀,等. 基于TG-FTIR和Py-GC/MS的生物质三组分快速热解机理研究[J]. 科学技术与工程,2017,17(9):59-66. Ma Zhongqing, Ma Qianqiang, Wang Jiayao, et al. Study on the fast pyrolysis mechanism of the three pseudocomponents of biomass (cellulose, hemi-cellulose and lignin) using TG- FTIR and Py-GC/MS[J]. Science Technology and Engineering, 2017, 17(9): 59-66. (in Chinese with English abstract)
[15] 郝小红,王亚兵,金晶,等. 微藻热解特性及动力学分析[J]. 能源工程,2016,13(4):40-45. Hao Xiaohong, Wang Yabing, Jin Jing, et al. Pyrolysis characteristics and kinetics of microalgae[J]. Energy Engineering, 2016, 13(4): 40-45. (in Chinese with English abstract)
[16] Söyler N, Goldfarb J L, Ceylan S, et al. Renewable fuels from pyrolysis of Dunaliella tertiolecta: An alternative approach to biochemical conversions of microalgae[J]. Energy, 2017, 120: 907-914.
[17] Almeida H N, Calixto G Q, Chagas B M E, et al. Characterization and pyrolysis of Chlorella vulgaris and Arthrospira platensis: Potential of bio-oil and chemical production by Py-GC/MS analysis[J]. Environmental Science and Pollution Research, 2017, 24(16): 14142-14150.
[18] Zhao B W, Wang X, Yang X Y. Co-pyrolysis characteristics of microalgae Isochrysis and Chlorella: Kinetics, biocrude yield and interaction[J]. Bioresource Technology, 2015, 198: 332-339.
[19] Rippka R, Deruelles J, Waterbury J B, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria[J]. Microbiology, 1979, 111(6): 1-61.
[20] Gorman D S, Levine R P. Cytochrome fand plastocyanin: Their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi [J]. Proceedings of the National Academy of Sciences of the United States of America, 1965, 54(6): 1665-1669.
[21] Pohndorf R S, Camara A S, Larrosa A P Q, et al. Production of lipids from microalgae Spirulina sp.: Influence of drying, cell disruption and extraction methods[J]. Biomass & Bioenergy, 2016, 93: 25-32.
[22] 梅帅,赵凤敏,曹有福,等. 三种小球藻生物柴油品质指标评价[J]. 农业工程学报,2013,29(15):229-235. Mei Shuai, Zhao Fengmin, Cao Youfu, et al. Evaluation of quality items for biodiesel made from three kinds of Chlorella vulgaris[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(15): 229-235. (in Chinese with English abstract)
[23] Kebelmann K, Hornung A, Karsten U, et al. Intermediate pyrolysis and product identification by TGA and Py-GC/MS of green microalgae and their extracted protein and lipid components[J]. Biomass and Bioenergy, 2013, 49: 38-48.
[24] Vo T K,Ly H V,Lee O K,et al. Pyrolysis characteristics and kinetics of microalgal Aurantiochytrium sp. KRS101[J]. Energy, 2017, 118: 369-376
[25] Maurya R, Ghosh T, Saravaia H, et al. Non-isothermal pyrolysis of de-oiled microalgal biomass: Kinetics and evolved gas analysis[J]. Bioresource Technology, 2016, 221: 251.
[26] Li D M, Chen L M, Zhang X W, et al. Pyrolytic characteristics and kinetic studies of three kinds of red algae[J]. Biomass & Bioenergy, 2011, 35(5): 1765-1772.
[27] Park Y H,Kim J S,Kim S S,et al. Pyrolysis characteristics and kinetics of oak trees using thermogravimetric analyzer and micro-tubing reactor[J]. Bioresource Technology, 2009, 100(1): 400-405.
[28] Ma Z Q, Chen D Y, Gu J, et al. Determination of pyrolysis characteristics and kinetics of palm kernel shell using TGA-FTIR and model-free integral methods[J]. Energy Conversion and Management, 2015, 89: 251-259.
[29] Ma Z Q, Sun Q F, Ye J W, et al. Study on the thermal degradation behaviors and kinetics of alkali lignin for production of phenolic-rich bio-oil using TGA-FTIR and Py-GC/MS[J]. Journal of Analytical and Applied Pyrolysis, 2016, 117: 116-124.
[30] 马中青,徐嘉炎,叶结旺,等. 基于热重红外联用和分布活化能模型的樟子松热解机理研究[J]. 西南林业大学学报,2015,25(3):90-96. Ma Zhongqing, Xu Jiayan, Ye Jiewang, et al. Determination of pyrolysis characteristics and kinetics of Pinus sylvestris var. mongolica using TGA-FTIR and distributed activation energy model[J]. Journal of Southwest Forestry University, 2015, 25(3): 90-96. (in Chinese with English abstract)
[31] Movasaghi Z, Rehman S, Rehman I. Fourier transform infrared (FTIR) spectroscopy of biological tissues[J]. Applied Spectroscopy Reviews, 2008, 43(2): 134-179.
[32] Coates J. Interpretation of Infrared Spectra, A Practical Approach[M]. Chichester,Encyclopedia of Analytical Chemistry. John Wiley & Sons, Ltd, 2006.
[33] Michael F K F, Mary K S, Nadia Z M, et al. Pressure-tuning fourier transform infrared spectroscopic study of carcinogenesis in human endometrium[J]. Biospectroscopy, 1996, 2(3): 155-165.
[34] Wu J G, Xu Y Z, Sun C W, et al. Distinguishing malignant from normal oral tissues using FTIR fiber-optic techniques[J]. Biopolymers, 2001, 62(4): 185-192.
[35] Heinz F, Michael J, Leigh M, et al. A comparative infrared spectroscopic study of human breast tumors and breast tumor cell xenografts[J]. Biospectroscopy, 1995, 1(1): 37-45.
[36] Peng W M, Wu Q Y, Tu P G, et al. Pyrolytic characteristics of microalgae as renewable energy source determined by thermogravimetric analysis[J]. Bioresource Technology, 2001, 80(1): 1-7.
[37] Hu M, Chen Z H, Guo D B, et al. Thermogravimetric study on pyrolysis kinetics of Chlorella pyrenoidosa and bloom- forming cyanobacteria[J]. Bioresource Technology, 2015, 177: 41.
[38] Bui H H, Tran K Q, Chen W H. Pyrolysis of microalgae residues: A kinetic study[J]. Bioresource Technology, 2016, 199: 362.
[39] Wang K G. Pyrolysis and Catalytic Pyrolysis of Protein- and Lipid-rich Feedstock[D]. Ames: Iowa State University, 2014.
[40] Anand V, Sunjeev V, Vinu R. Catalytic fast pyrolysis of Arthrospira platensis, (spirulina) algae using zeolites[J]. Journal of Analytical & Applied Pyrolysis, 2016, 118: 298-307.
[41] Du Z Y, Hu B, Ma X C, et al. Catalytic pyrolysis of microalgae and their three major components: Carbohydrates, proteins, and lipids[J]. Bioresource Technology, 2013, 130(2): 777-782.
Weight-loss characteristics, components of bio-oil and kinetics during pyrolysis from different types of microalgae
Wang Junhao1, Zhang Yu1, Yang Youyou2, Zuo Zhaojiang3, Ma Zhongqing1※
(1.311300,; 2.311300,; 3.311300,)
As a kind of new-fashionable biomass material, microalgae has the advantages of large amount, fast-growing, high efficiency of photosynthesis, and less land for cultivating. Biomass fast pyrolysis technology is a promising technology to convert low-grade microalgae into high value-added advanced liquid bio-fuels and bio-chemicals. In this paper, a systematical comparison of components’ content, pyrolysis behaviors, kinetics, and evolved gas components, was carried out among 3 types of microalgae (Chlamydomonas reinhardtii, Chlorella vulgaris, and Microcystis aeruginosa) using thermogravimetric analyzer coupled with Fourier transform infrared spectrometry (TGA–FTIR), pyrolyzer coupled with gas chromatography/mass spectrometer (Py–GC/MS), and distributed activation energy model (DAEM). The result showed that: (1) Based on the TGA analysis, the thermal degradation process of microalgae was composed of 3 stages, namely drying stage (temperature range of 30-150 ℃), fast pyrolysis stage (temperature range of 150-550 ℃), and carbonization stage (temperature range of 550- 800 ℃), and the maximum weight loss rate was observed for Microcystis aeruginosa with a value of 17.34 wt.%/min; the TG/DTG (thermogravimetry/differential thermogravimetry) curves moved to the side of high temperature and the weightlessness rate unit time (wt.%/min) gradually increased as the heating rate increased. (2) The FTIR analysis indicated that there were 6 strong infrared characteristic absorption bands from microalgae pyrolysis, which located at 3734 cm– 1 (-OH), 2 938 cm- 1 (-CH3), 2 360 cm- 1 (-C=O), 1 770 cm- 1 (C=O), 950 cm- 1 (P-O-P) and 667 cm- 1 (CO2). These characteristic functional groups represented the main evolved gas components were CH4, CO2, compounds containing C=O bond, compounds containing N-H and C-N bonds, in which the maximum content of CH4 was evolved from Chlamydomonas reinhardtii, and the maximum content of compounds containing C=O bond was evolved from Microcystis aeruginosa. (3) Based on DAEM analysis, as conversion rate increased, the activation energy values of 3 types of microalgae increased. The activation energy of Microcystis aeruginosa increased from 100 to 680 kJ/mol, the activation energy of Chlorella vulgaris increased from 40 to 265 kJ/mol, and the activation energy of Chlamydomonas reinhardtii increased from 20 to 250 kJ/mol. Among the 3 types of microalgae, Microcystis aeruginosa had the maximum value of activation energy. (4) Based on the Py-GC/MS analysis, the whole components in the bio-oil could be divided into the following categories, such as alkanes, olefins, benzene series, alcohols, ethers, aldehydes, ketones, nitriles, furans, indoles, and acids. Among them, long-chain alkanes, olefins, aldehydes and ketones, fatty acids and esters were mainly derived from pyrolysis of lipids and carbohydrate, while phenols, aromatics, amines and amides, heterocyclic compounds containing nitrogen were mainly derived from pyrolysis of protein. Chlorella vulgaris produced the maximum content of oxygenates compounds reaching up to 30.89%, while Microcystis aeruginosa produced the maximum contents of phenols, aromatic hydrocarbons, amines and amides, and other compounds containing nitrogen reaching up to 10.41%, 13.46%, 13.87% and 14.27%, respectively. In summary, this paper would be useful to supply scientific and basic data for industrial application of microalgae.
pyrolysis; kinetics; microorganisms; microalgae; TGA-FTIR; Py-GC/MS
10.11975/j.issn.1002-6819.2018.19.031
S216
A
1002-6819(2018)-19-0239-09
2018-04-07
2018-06-30
国家自然科学基金(51706207);中国博士后科学基金(2017M611987);浙江省自然科学基金(LQ17E060002);浙江省与中国林科院省院合作林业科技项目(2017SY01);浙江省竹资源与高效利用协同创新中心开放基金(2017ZZY2-02)
王浚浩,主要从事生物质催化热解研究工作。 Email:m15990176516@163.com
马中青,主要从事生物质热解气化研究工作。 Email:mazq@zafu.edu.cn
王浚浩,张 雨,杨优优,左照江,马中青. 微藻种类对其热解质量损失规律和产物及动力学的影响[J]. 农业工程学报,2018,34(19):239-247. doi:10.11975/j.issn.1002-6819.2018.19.031 http://www.tcsae.org
Wang Junhao, Zhang Yu, Yang Youyou, Zuo Zhaojiang, Ma Zhongqing. Weight-loss characteristics, components of bio-oil and kinetics during pyrolysis from different types of microalgae[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(19): 239-247. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.19.031 http://www.tcsae.org

