甜叶菊褐斑病的病原菌鉴定及MeJA的抗病作用
崔晓霞,束红梅,蒋璐,何晓兰,巩元勇,倪万潮,郭书巧
甜叶菊褐斑病的病原菌鉴定及MeJA的抗病作用
崔晓霞,束红梅,蒋璐,何晓兰,巩元勇,倪万潮,郭书巧
(江苏省农业科学院经济作物研究所,南京 210014)
【目的】明确引起甜叶菊褐斑病的病原菌种类,分析MeJA在甜叶菊响应链格孢菌过程中的作用,为甜叶菊褐斑病的防治及抗病育种提供依据。【方法】对取自江苏省东台市富安镇甜叶菊生产基地的发病甜叶菊植株的叶片进行病原菌分离、纯化培养,观察菌落及分生孢子的形态、大小和病原菌的致病性。采用离体叶片接种的方法进行致病性测定。利用真菌通用引物ITS1和ITS4对7个致病菌株ST1-ST7的rDNA-ITS区进行扩增,对扩增产物进行回收和测序,并利用MEGA 7软件的邻接法(neighbor-joining,NJ)构建基于病原菌的rDNA-ITS序列和GenBank中相关链格孢菌序列的系统发育树,确定病原菌的种类。利用台盼蓝染色、光学显微镜观察分析链格孢菌分生孢子在甜叶菊叶片上的萌发状态及侵入叶片的方式。通过向马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)上外源添加MeJA分析其对链格孢菌菌丝生长的影响;对甜叶菊离体叶片饲喂MeJA并接种链格孢菌,观察叶片对链格孢菌的抗性;采用qPCR方法分析JA通路相关基因在甜叶菊叶片接种链格孢菌前后的表达情况。【结果】从甜叶菊发病叶片上共分离到7个菌株,所有菌株在PDA培养基上呈近圆形等径辐射生长,气生菌丝较为发达,初期为白色,后期逐渐变为不同程度的灰黑色,分生孢子单生或成链,多为近球形、倒棒状或倒梨形,大小为(20.5—45.5)×(6.5—16.0)μm。将所分离得到的菌株接种于甜叶菊离体叶片上,发现7个菌株对甜叶菊叶片致病程度存在一定差异,ST2、ST3和ST7 3个菌株侵染叶片后病斑扩展速度快,致病力较强。3个致病力较强的菌株的rDNA-ITS序列长度分别为569、570和570 bp,通过系统进化树分析,ST2、ST3与菌株KY814634.1、DQ491089.1等(、sp.,链格孢)的相似度达到99%—100%,ST7与菌株HQ402558.1(,细极链格孢)的相似度达到99%。对接种细极链格孢ST7分生孢子的甜叶菊叶片台盼蓝染色后的观察结果发现,分生孢子可以从孢子的头部、侧面、尾部多个位置萌发,从叶片的气孔和表皮细胞间隙侵入叶片表皮细胞内。外源施加浓度高于200 μmol·L-1的MeJA能有效抑制细极链格孢菌丝的生长;甜叶菊离体叶片饲喂100 μmol·L-1的MeJA后接种细极链格孢,病斑面积明显小于对照,表明MeJA可增强甜叶菊对细极链格孢的抗性;JA通路相关基因和在甜叶菊接种细极链格孢后上调表达,和反之下调表达,表明JA通路参与甜叶菊对细极链格孢的响应。【结论】江苏省东台市富安镇甜叶菊生产基地甜叶菊褐斑病的致病菌为链格孢菌。细极链格孢菌丝可以从叶片的气孔以及表皮细胞间隙侵入表皮细胞。外源施加MeJA能够有效增强甜叶菊叶片对细极链格孢的抗性,在甜叶菊褐斑病的防治中具有很好的应用前景。
甜叶菊;褐斑病;链格孢菌;病原菌鉴定;MeJA;信号通路
0 引言
【研究意义】甜叶菊()是菊科、甜叶菊属多年生草本植物。甜叶菊叶片富含黄酮类和甜菊糖苷类化学成分[1-2]。黄酮类化合物具有抗肿瘤、抗氧化等多种药理活性;甜菊糖苷(steviol glycosides)则是一类新型天然甜味剂,具有甜度高、热量低、安全无毒等特点[3],逐渐成为食品和医药领域研究开发的热点[4-5]。2017年笔者在江苏省东台市富安镇甜叶菊生产基地发现甜叶菊叶片上呈现不同程度的褐斑,发病严重的植株叶片全部枯萎,严重影响了甜叶菊的产量。因此,确定甜叶菊褐斑病的致病病原菌,对该病害的防治具有重要意义。【前人研究进展】链格孢菌是自然界中广泛存在、危害严重的一种死体营养型植物病原真菌,多生于植物的枯死部分和衰弱濒死的组织,或腐生于多种有机物质上或土壤中[6]。链格孢菌可引起多种植物特别是农作物病害,能够引起包括小麦、马铃薯、玉米、烟草、番茄、苹果、梨等几十种农作物的真菌性病害,严重影响作物的产量和品质,造成巨大的经济损失[7-8]。美国伊利诺斯州的大豆曾因细极链格孢()引起的大豆猝倒病,造成产量损失15%[8]。由长柄链格孢()和链格孢()引起的烟草赤星病在世界各主要烟区广泛发生,主要危害成熟期烟叶,对成熟度、采收率、外观等级和内在质量都有很大影响,是烟草的主要病害之一[9-10]。我国各地广泛发生的番茄、马铃薯等茄科蔬菜的早疫病,则是由为主的病原真菌引起的[11-12]。1982年,日本首次发现一种链格孢属真菌能引起甜叶菊黑斑病[13],病斑呈黑色不规则形状扩展,并被褪绿区域包围;2007年,印度也首次报道了导致甜叶菊叶斑病的病原菌,鉴定结果为链格孢[14];伊朗于2015年首次分离鉴定到链格孢菌属为引起甜叶菊叶斑病的致病病原菌[15]。【本研究切入点】目前,国内关于甜叶菊病害病原物鉴定方面的报道还很少,对链格孢菌的防控并没有非常有效的方法,因此了解其侵染机理可为该真菌导致的病害防控提供指导。对2017年7月采自江苏省东台市富安镇甜叶菊生产基地的带病斑甜叶菊叶片进行病原菌分离鉴定和致病性检测,并进一步分析MeJA对甜叶菊响应链格孢菌的影响。【拟解决的关键问题】利用形态学与分子生物学手段鉴定甜叶菊褐斑病的致病病原菌,明确甜叶菊褐斑病的病原菌种类;分析MeJA对甜叶菊响应链格孢菌的影响以及JA通路是否参与该响应过程,为该病害的田间诊断、综合防控及甜叶菊的抗病育种提供理论依据。
1 材料与方法
试验于2017年7月至2018年4月在江苏省农业科学院经济作物研究所完成。
1.1 褐斑病标样采集及病原菌分离
2017年7月从江苏省东台市富安镇甜叶菊生产基地采集叶片带有褐斑的植株。选取叶片病健交界的组织,切成0.5 cm×0.5 cm的小块,首先用无菌水冲洗数次,用70%酒精表面消毒30 s,再用0.1%升汞处理2 min,用无菌水漂洗3次,最后用灭菌镊子夹取材料平铺于添加有链霉素(40 μg·mL-1)的PDA平板培养基上,25℃黑暗条件下培养3—5 d,从新长出的菌落边缘挑取少量菌丝接种到新的PDA平板上进一步分离纯化,记录菌落的形态学特征。
1.2 病原菌的致病性测定
选择健康无病、无伤痕的甜叶菊叶片,室内进行离体叶片接种试验。每个菌株均为3次重复。用70%酒精进行表面消毒后置于铺有保湿滤纸的培养皿内。
菌丝块接种法:分离纯化的菌株在PDA平板上培养7 d,用灭菌刀沿菌落边缘切取3 mm×3 mm大小的菌饼,菌丝面朝下、避开主叶脉贴于叶片背面两侧,接种部位用刺针进行人工创伤。同时接种空白的PDA培养基块作为对照。接种后封好培养皿,置于25℃条件下诱导发病,每天观察并记录发病情况。
分生孢子悬浮液接种法:将菌株在PDA平板上于黑暗条件下培养10 d,加入10 mL无菌水刮洗菌丝,所得到的悬浮液经3层纱布过滤,在显微镜下使用血球计数板来计算孢子悬浮液的浓度,最终将孢子悬浮液浓度调至1×105个/mL。将表面消毒处理后的甜叶菊叶片浸到孢子悬浮液中10 min,然后将其转移到铺有保湿滤纸的培养皿内,于25℃条件下培养,在光学显微镜下观察分生孢子的萌发以及侵染情况。
待接种后的甜叶菊叶片发病后,根据柯赫式法则,将病原菌重新进行分离纯化,观察新分离物与接种菌是否相同。
1.3 病原菌形态学观察
将分离得到的致病菌株接种到PDA培养基上,置于25℃培养箱中黑暗培养8 d后,从菌落边缘表面切取小块薄的、带菌丝的培养基,将其放置到载玻片上,覆上中心凿有1 cm2方孔的纸片,盖上盖玻片,在光学显微镜(Olympus CX41,Japan)下观察分生孢子、分生孢子梗及分生孢子链的形态并拍照,用目镜测微尺测量分生孢子的大小。结合病原菌菌落在PDA培养基上的形态及色泽特征,参考《真菌鉴定手册》[16]确定病原菌的种类。
1.4 病原菌的分子生物学鉴定
1.4.1 总DNA的提取 将分离得到的菌株接种到PDA培养基上,置于25℃培养箱中培养10 d,从培养基表面刮取菌丝,加入液氮迅速研磨成粉末,参照真菌基因组DNA提取试剂盒(Solarbio,China)操作说明提取菌株DNA,并将DNA样品放于-20℃保存备用。
1.4.2 ITS区扩增 采用真菌核糖体基因转录间隔区的通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG -3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对病原菌的基因组DNA进行PCR扩增。PCR反应体系50 μL:DNA模板2 μL、上下游引物ITS1和ITS4各1 μL、10×PCR buffer(Mg2+plus)5 μL、dNTP Mixs(10 mmol·L-1)1 μL、Taq DNA聚合酶1 μL、无菌ddH2O补齐至50 μL。PCR扩增程序:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸40 s,共33个循环,最后72℃延伸10 min,4℃保存。
1.4.3 PCR产物纯化与克隆 取5 μL 1.4.2中的PCR扩增产物加入1 μL 6×DNA loading buffer混匀,于1%琼脂糖凝胶上检测样品条带大小是否正确并特异。检测正确的PCR产物使用PCR清洁试剂盒(Axygen,USA)回收纯化,将其与pEASY-T1克隆载体(TransGen,China)连接,连接产物转入大肠杆菌Trans1-T1感受态细胞(TransGen,China)中,经PCR鉴定后,选取阳性克隆送上海英骏生物技术有限公司进行测序。
1.4.4 病原菌的ITS序列分析 将测得的ITS区序列在GenBank中进行同源性搜索,与已报道真菌菌株的ITS区序列进行同源性比较。利用MEGA 7软件的邻接法(neighbor-joining,NJ)构建系统发育树。将比较结果与病菌的形态特征、培养性状和致病性结合,对病原菌进行鉴定。
1.5 细胞学染色
等体积的乳酸、苯酚、甘油和无菌ddH2O混合,制成乳酸酚溶液;向其中加入Trypan Blue染料溶解,使其终浓度为2.5 mg·mL-1,配成Trypan Blue染液。
Trypan Blue染液中加入2倍体积的无水乙醇,将样品置于染色液中100℃煮1 min,室温放置5—10 min;转移至无水乙醇﹕乳酸酚=2﹕1溶液中过夜脱色,重复直至叶片绿色完全褪去;样品于70%甘油中保存,制片并观察。
1.6 MeJA对链格孢菌生长的影响
1.6.1 MeJA培养基的配制 取223.6 μL的MeJA溶于10 mL无水乙醇中,配成100 mmol·L-1的浓缩液,分别加入到PDA培养基中配成0、40、100、200、500 μmol·L-1含不同浓度MeJA的混合培养基。
1.6.2 菌丝生长检测 链格孢菌株ST3在PDA培养基上培养5 d后,用打孔器在菌落边缘均匀打下菌丝块,将菌丝块分别放在上述含不同浓度MeJA的PDA平板中央,每个处理重复6次。将其置于25℃培养箱中黑暗培养,每2 d观察并测量菌落直径。
1.7 离体叶片饲喂及培养
选择生长状态良好、长势一致的甜叶菊植株,剪取离体叶片放入铺有一层滤纸的培养皿中,滤纸加灭菌水浸湿,用浸泡100 μmol·L-1MeJA溶液的无菌棉包裹叶柄切口,进行离体饲喂,对照用浸泡无菌水的棉球处理。室温下静置10 h后取下棉球,重新用无菌水浸湿的棉球包裹叶柄处(方法参照Sun等[17])。接种方法参照1.2的菌丝块接种法。接种后的叶片置于培养皿中于温度28/23℃、光周期16/8 h的光照培养箱中培养,分别于接种后3、4、5 d测量病斑并拍照记录。
1.8 RNA提取及qRT-PCR
样品RNA的提取采用E.Z.N.A.®Plant RNA Kit(OMEGA,美国)试剂盒,按照说明书进行RNA的提取操作。基因组DNA去除及RNA反转录采用PrimeScriptTMRT reagent Kit(TaKaRa,Japan)试剂盒并按说明书操作。
qRT-PCR采用SYBR®Premix Ex TaqTM(Tli RNaseH Plus)(TaKaRa,Japan)试剂盒,PCR反应在QuantStudio 5 Real-Time PCR System(Applied Biosystems,American)仪器上进行。PCR反应结束后扩增Ct值经QuantStudioTMDesign & Analysis Software 1.3.1软件初步处理后导出至Excel中,利用2-ΔΔCt方法计算目的基因的相对表达量。数据采用Dunnett’ s test进行显著性分析。所用甜叶菊内参基因及JA通路各目的基因引物序列如表1所示。
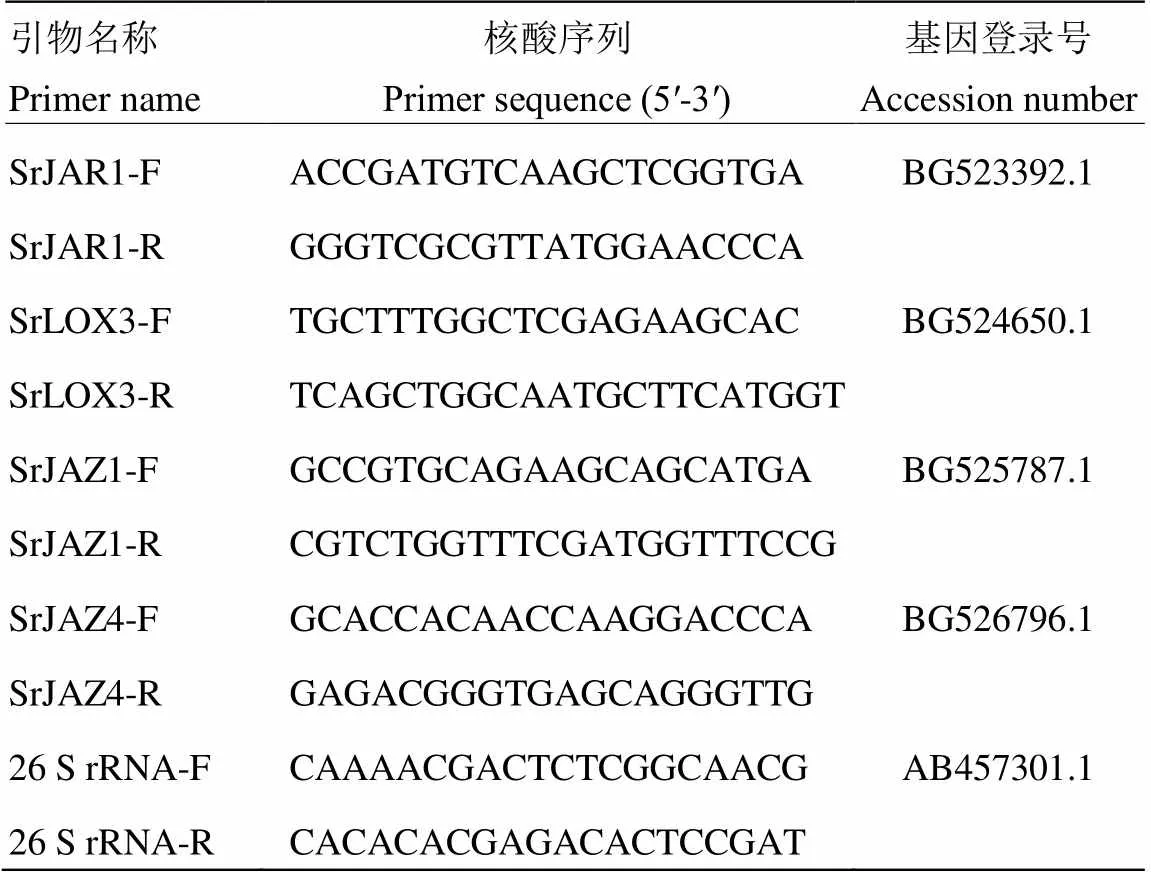
表1 本研究中所用引物核酸序列
2 结果
2.1 病原菌的分离纯化及形态学特征
从甜叶菊守田3号发病叶片中分离出7种疑似致病真菌,依次编号为ST1—ST7。所有菌株在PDA培养基上呈近圆形等径辐射生长,边缘光滑略呈波浪状;气生菌丝较为发达,初期为白色,后期逐渐变为不同程度的灰黑色,基质呈现不同类型的同心轮纹(图1);在PDA平板上培养8 d的菌落产生大量的分生孢子,显微镜下观察,分生孢子梗直立或略弯,分隔,偶分枝,淡褐色,大小为(24.0—77.5)×(2.3—5.0)μm;分生孢子单生或成链,形态多样,多为近球形、倒棒状或倒梨形,大小为(20.5—45.5)×(6.5—16.0)μm(图2)。其中ST2、ST3、ST5、ST6具有短分枝的孢子链,作合轴式延伸,分生孢子表面光滑或具微刺,具3—8个横膈膜和1—4个纵、斜隔膜;ST1、ST4、ST7则形成超过10个孢子的分生孢子长链,少分支,处于链基部的孢子,表面偶生明显的疣突,分生孢子具4—7个横膈膜,1—4个纵或斜隔膜,常有1—4个主横膈膜,主隔膜处有明显的隘缩。根据这些特征,参照魏景超的《真菌鉴定手册》[16]及张天宇的《中国真菌志》[6]初步判定此类菌为链格孢属霉菌,其中ST2、ST3、ST5、ST6可能是,ST1、ST4、ST7则推测是。

ST1—ST7在PDA平板上25℃条件下培养10 d后的正面和反面菌落形态

图2 分离病原真菌分生孢子形态的显微观察
2.2 病原菌的致病性检测
采用离体叶片接种的方法,对叶片发病情况进行观察统计,结果发现7个菌株对甜叶菊叶片致病程度存在一定的差异,ST2、ST3和ST7 3个菌株侵染叶片后病斑扩展速度快,在接种后72 h病斑直径达到3—5 mm,发病位置呈黑褐色(图3-B、3-C、3-G),而ST1、ST4、ST5和ST6在接种后的第7天病斑仍局限于叶片的创伤位点(图3-A、3-D、3-E、3-F)。因此,引起甜叶菊叶片褐斑病的ST2、ST3和ST7菌株的致病力较强,而ST1、ST4、ST5和ST6对甜叶菊的致病力则相对较弱。从接种发病的叶片病斑上刮取少量的病组织镜检,可观察到与接种菌株一致的菌丝和分生孢子。对发病组织进行病原菌的再分离,同样获得与接种病原真菌菌落形态一致的培养物,完成柯赫氏法则(Koch postulates)致病性检测。因此,接种所用的菌株是引起甜叶菊褐斑病的病原菌。

A—G:甜叶菊叶片分别接种ST1-ST7菌株的表型The phenotype of S. rebaudiana leaves inoculated with ST1-ST7 strains, respectively;H:接种无菌空白PDA培养基的对照The control leaf inoculated with PDA medium
2.3 病原菌的rDNA-ITS序列分析
以菌株ST1—ST7的基因组DNA为模板,利用真菌rDNA-ITS区通用引物ITS1和ITS4,扩增得到571、569、570、570、570、571和570 bp大小的ITS序列(图4),并进行测序分析,将测序结果提交至NCBI网站进行BLAST比对(图5)。结果表明,ST2、ST3、ST5、ST6与KY075667.1、KY814634.1等8个菌株(、sp.)的相似性达到99%—100%,ST1、ST4、ST7与HQ402558.1()的相似性达到99%,结合病原菌的形态学观察结果,进一步确认引起甜叶菊褐斑病的病原菌为链格孢和细极链格孢。
2.4 细极链格孢分生孢子在叶片上的萌发及侵入
甜叶菊品种守田3号叶片接种细极链格孢ST7(以下试验将该菌株作为研究对象)分生孢子悬浮液(1×105个/mL),利用光学显微镜观察发现,接种6 h后,分生孢子已经开始萌发,分生孢子可以从孢子的头部、侧面、尾部多个位置萌发(图6-A、6-B、6-C),菌丝沿叶片表面蔓延生长。接种24 h后,对菌丝侵入表皮细胞的方式进行观察,发现一部分菌丝通过叶片的气孔侵入表皮细胞(图6-D、6-E、6-F),一部分则从表皮细胞间隙直接侵入叶片表皮细胞内(图6-G、6-H)。

图4 7株链格孢菌的rDNA-ITS PCR产物电泳图
2.5 JA通路参与甜叶菊对链格孢菌的响应
2.5.1 MeJA对链格孢菌菌丝生长的影响 选择细极链格孢菌株ST7在含有不同浓度MeJA的PDA培养基上培养,菌丝生长面积统计结果如图7所示。MeJA浓度低于200 μmol·L-1时,菌落生长面积与对照相比无明显差异;当MeJA浓度增至200 μmol·L-1时,链格孢菌菌丝的生长受到明显抑制,且随着MeJA浓度增至500 μmol·L-1,对其生长的抑制效果更显著。MeJA在较低浓度范围内对细极链格孢菌ST7没有直接的抑制作用,因此,选择浓度为100 μmol·L-1的MeJA用于后续的试验处理。
2.5.2 外源施加MeJA增强甜叶菊对细极链格孢的抗性 对外源施加100 μmol·L-1MeJA的甜叶菊离体叶片接种细极链格孢ST7菌丝块,同时对叶片接种无菌PDA培养基作为空白对照。接种后的病斑表型如图8-A所示,相比于对照H2O处理的叶片,MeJA处理后甜叶菊叶片的病斑明显减小。病斑统计结果(图8-B)显示,接种后3、4、5 d,对照叶片的病斑面积分别是MeJA处理后叶片病斑面积的1.41、1.50和1.58倍,结果表明外源施加MeJA后,甜叶菊叶片对细极链格孢ST7的抗性明显增强。
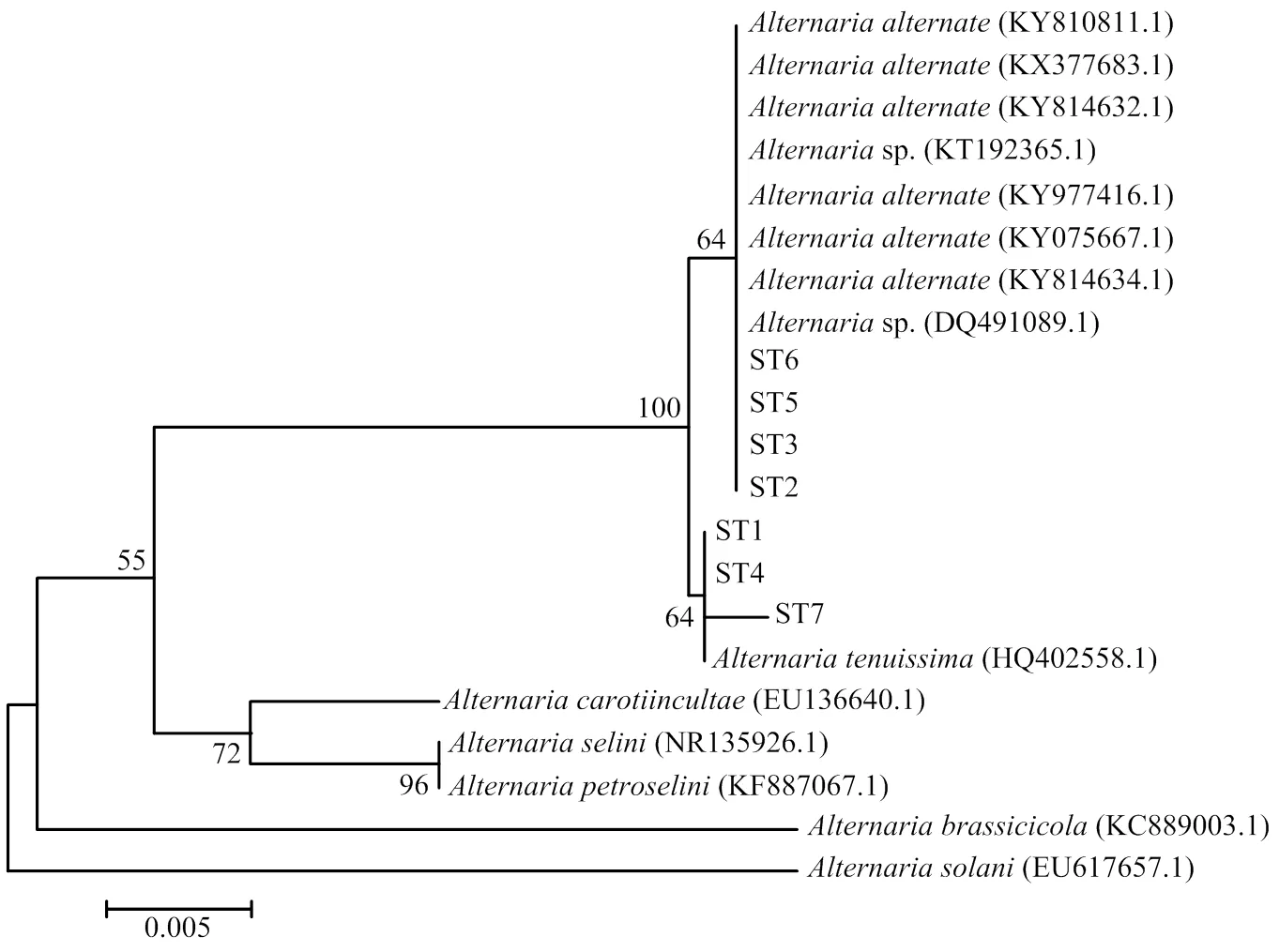
图5 甜叶菊褐斑病7个致病菌与链格孢菌属相关种rDNA-ITS序列系统发育树
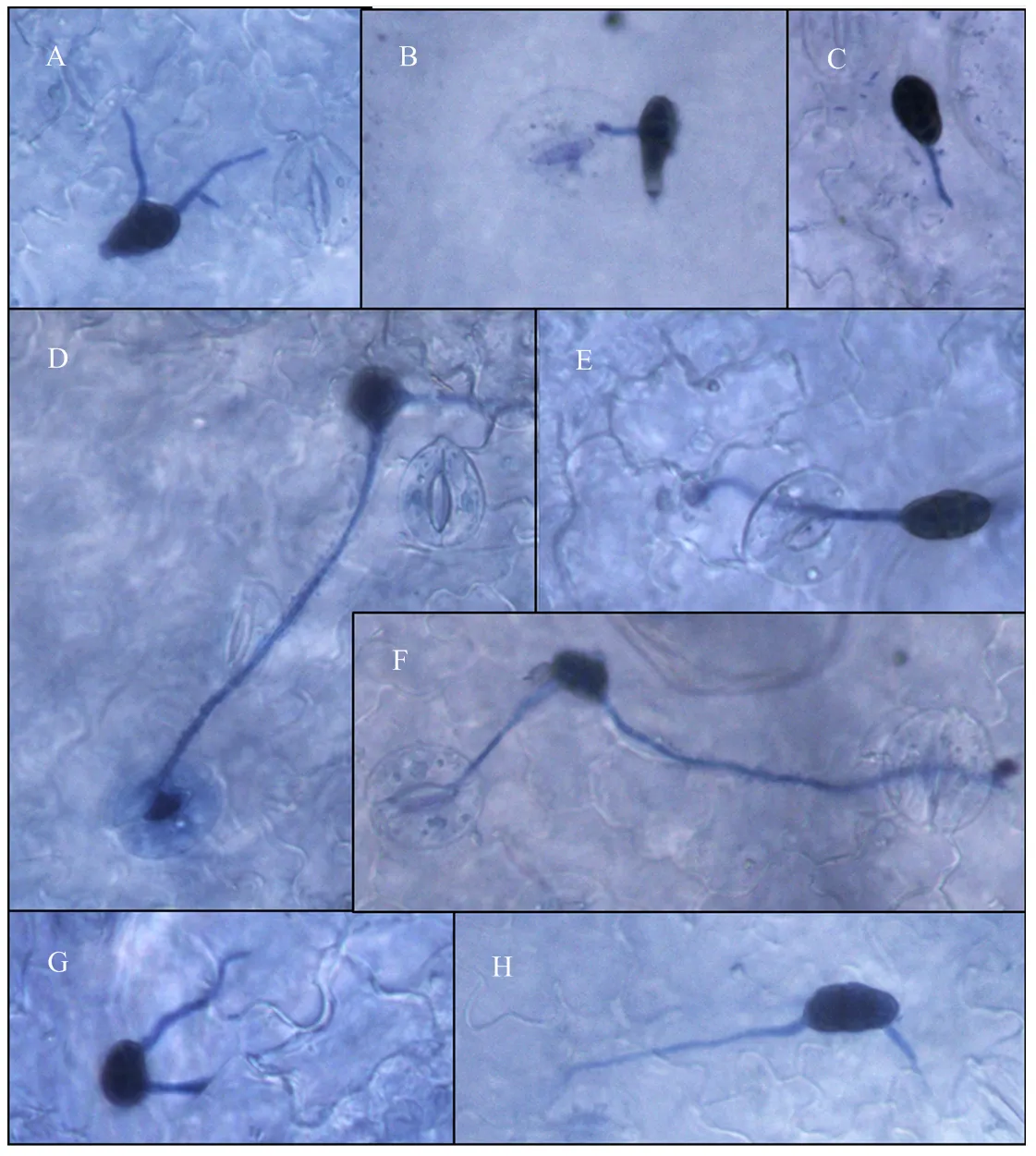
甜叶菊品种守田3号接种细极链格孢ST7 6 h后,分生孢子从孢子的头部(A)、侧面(A、B)、尾部萌发(C);接种24 h后,菌丝从叶片气孔(D、E、F)、表皮细胞间隙(G、H)侵入叶片表皮细胞内
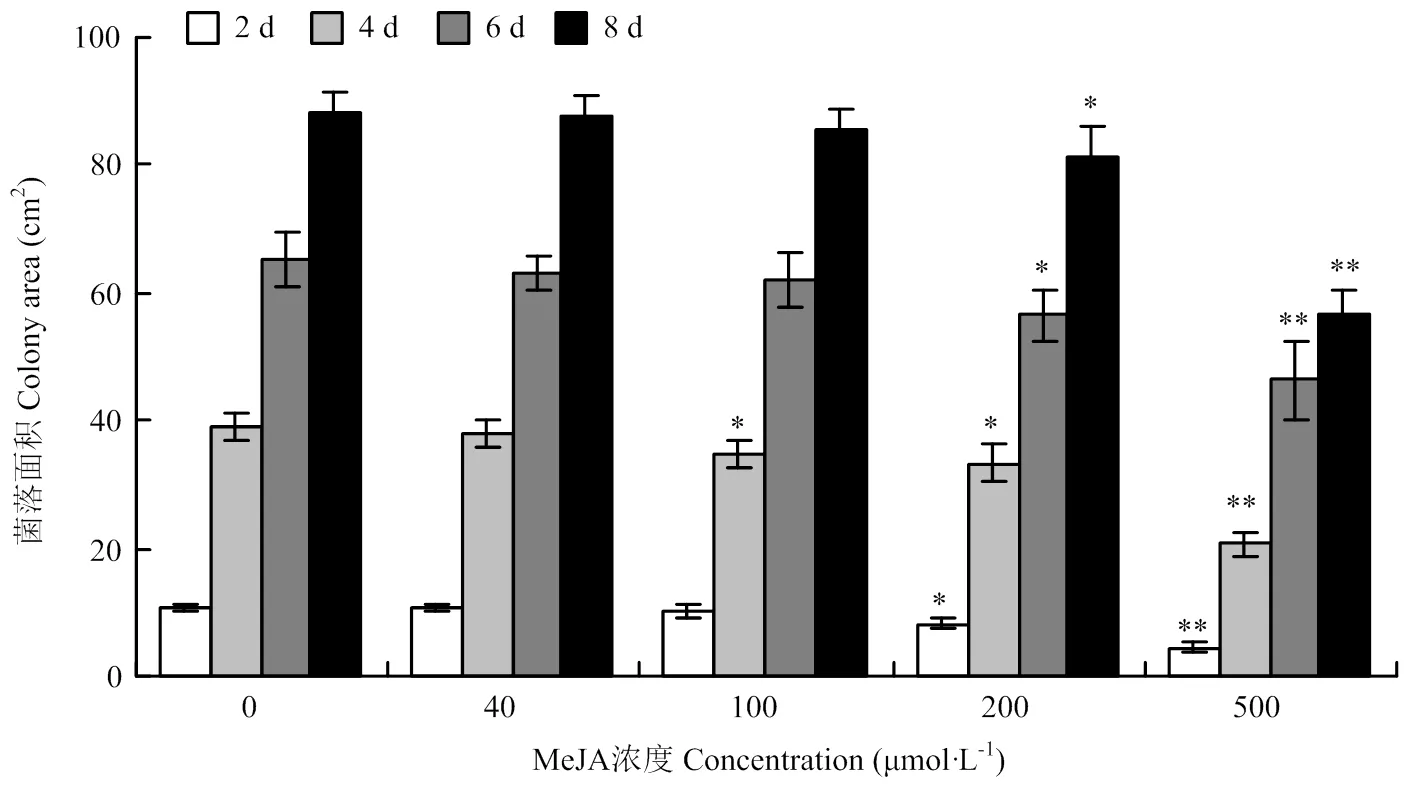
图7 MeJA对细极链格孢ST7菌丝生长的影响
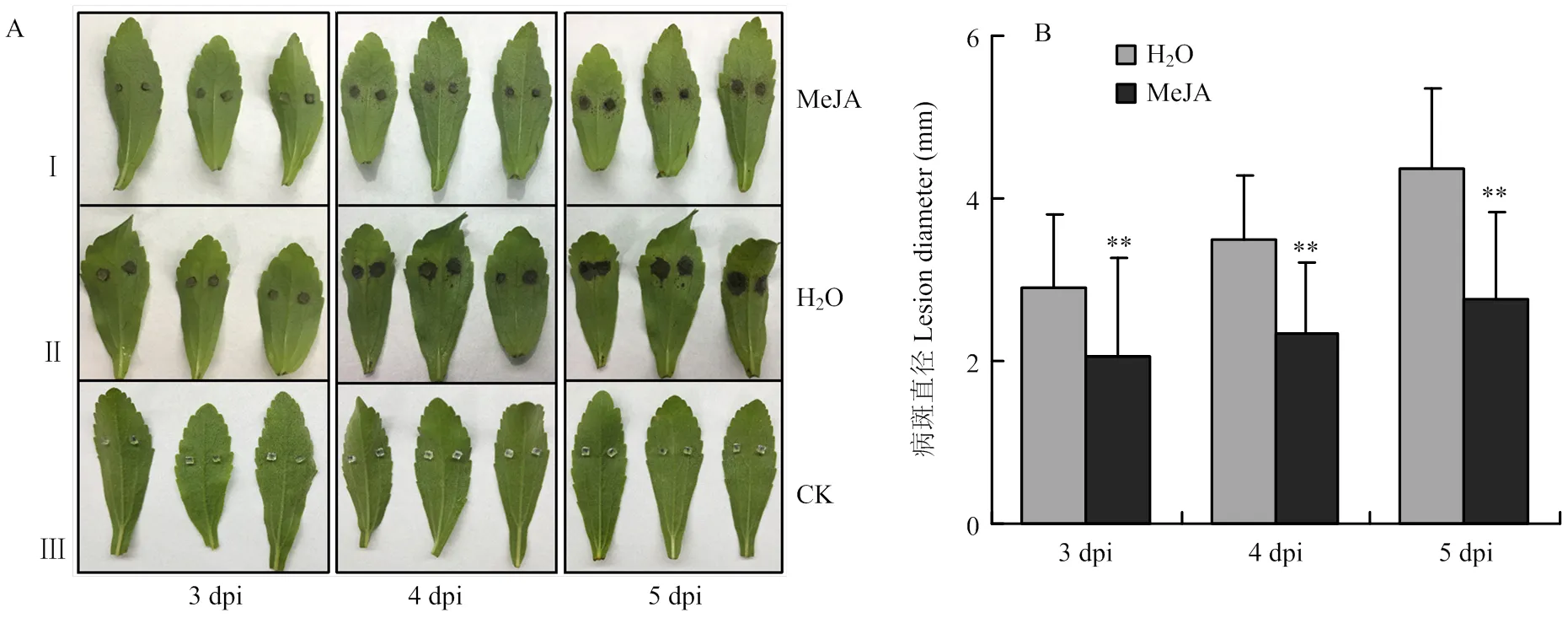
I:甜叶菊叶片饲喂100 μmol·L-1 MeJA 10 h后接种细极链格孢ST7的表型The phenotype of S. rebaudiana leaves which inoculated with ST7 after feeding 100 μmol·L-1 MeJA for 10 h;II:叶柄处饲喂ddH2O后接种细极链格孢ST7的表型The phenotype of S. rebaudiana leaves which inoculated with A. tenuissima ST7 after petiole feeding ddH2O;III:叶片饲喂ddH2O并接种无菌PDA培养基的空白对照 The control which leaves inoculated with PDA medium。拍照及测量病斑时间点均为接种后3、4、5 d The time points for taking pictures and measuring the disease spots are 3, 4, 5 days after inoculation
2.5.3 JA通路相关基因的表达分析是JA合成通路基因,在甜叶菊叶片接种细极链格孢菌株ST7分生孢子悬浮液12 h后,明显上调表达;JAR则是JA通路中的信号传导因子,在接种后48 h后,的表达量显著增加;JAZ是茉莉酸途径的抑制因子,接种链格孢菌后,和呈现不同程度的下调表达(图9)。表明JA通路相关基因参与甜叶菊对细极链格孢ST7的响应。
3 讨论
甜叶菊提取物甜菊糖苷作为甜味食品添加剂在南美已使用了数个世纪[18],最近在欧盟和美国也被批准使用[19]。甜菊糖苷同时具有一定的药用价值,例如降低血压、增强胰岛细胞功能治疗2型糖尿病、预防动脉粥样硬化、预防某些癌症以及清除人体自由基等功能[19-22]。我国的甜叶菊自1976年南京中山植物园从日本引种试验成功后,80年代初全国各地开始种植[23]。自2006年起,中国成为世界甜菊糖产品最大的出口国[4]。目前关于甜叶菊病害已有相关报道。2002年,朱东顺等[24]在山东省高密地区发现甜叶菊生产中发生的主要病害有立枯病、花叶病毒病和叶斑病等,对甜叶菊的干叶质量和产量均造成不同程度的影响。近年来甘肃河西走廊地区甜叶菊育苗期的病害呈逐年加重的趋势,猝倒病、立枯病和叶斑病成为育苗期最容易发生的3大病害,给农业生产带来较大损失[25]。2017年,笔者在江苏省东台市富安镇甜叶菊生产基地调查发现甜叶菊叶片上呈现不同程度的褐斑,发病严重的植株叶片全部枯萎。经病原菌的分离、培养、纯化,共分离得到7株病原真菌,均为链格孢属真菌,致病性鉴定结果发现有3株致病力较强,为细极链格孢和链格孢。
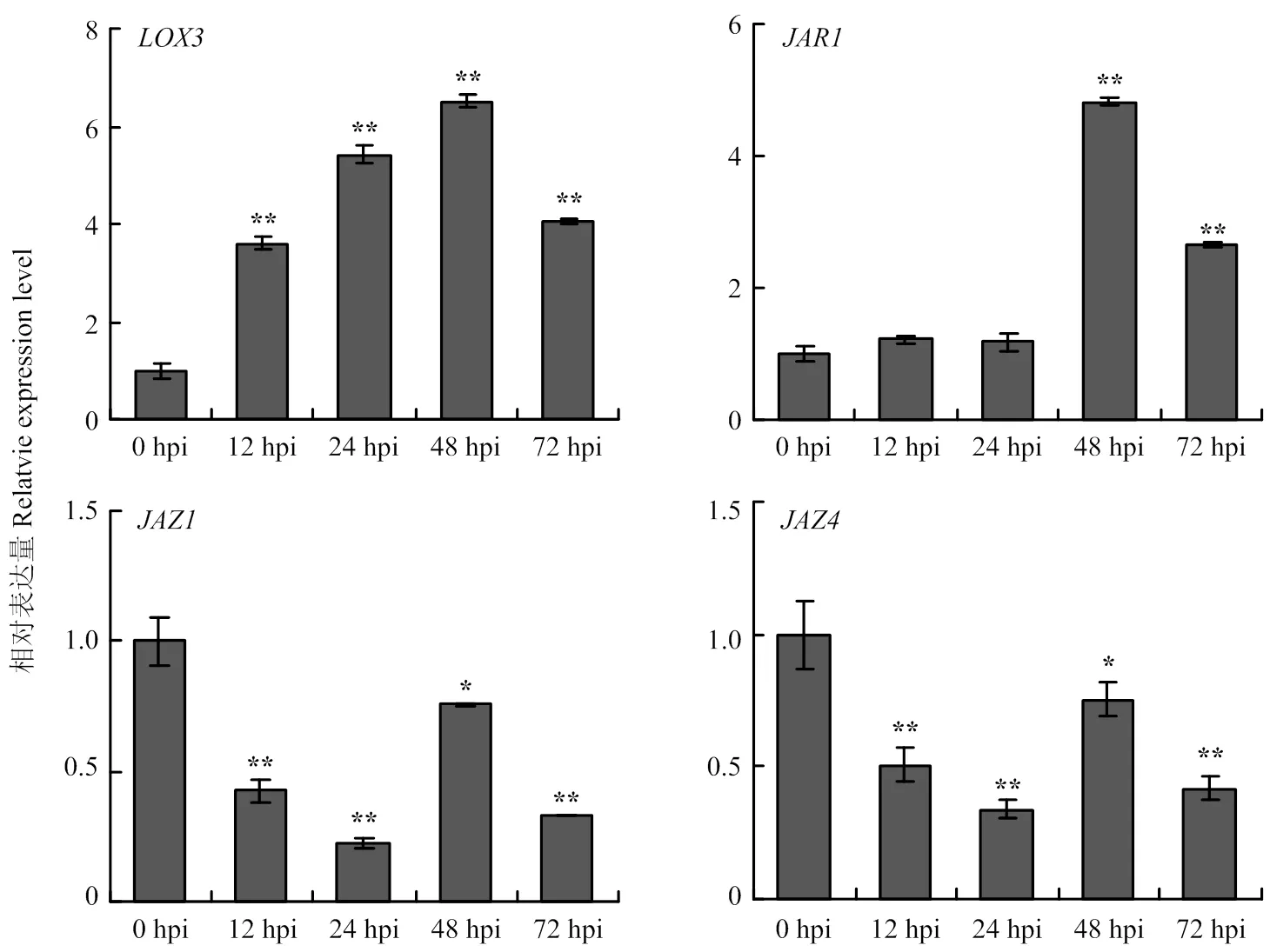
图9 JA通路相关基因响应细极链格孢侵染的表达分析
JA是植物细胞间和细胞内的重要信号分子,通过与转录因子间的相互作用来调控防御蛋白的表达以及次生物质的合成,参与植物对病原菌的应答反应和信号传递[26-27]。本试验表明,100 μmol·L-1的MeJA对链格孢菌无直接抑制作用,而用该浓度MeJA处理后的甜叶菊叶片对链格孢菌的抗性明显增强,具有显著的诱抗作用,说明MeJA在增强甜叶菊抗链格孢菌方面起着重要作用。脂氧合酶(lipoxygenase)基因是JA合成通路中的关键基因,当植物受到伤诱导时,被激活,诱导JA及MeJA的合成与积累,而生成的JA又可进一步激活,促进JA的积累[28],在甜叶菊叶片受链格孢菌侵染后,的表达水平明显上调。JAZ蛋白作为E3泛素连接蛋白降解复合体SCF的靶蛋白,是JA信号转导途径的关键组分,其能与茉莉酸信号途径的转录因子(如MYC2、MYC3)相结合从而抑制这些因子的转录活性,JAZ蛋白是茉莉酸信号途径重要的负调控因子[29],本研究用链格孢菌侵染甜叶菊后,叶片中、的表达受到抑制,与接种前相比,整体呈下调表达的趋势。JAR1是一种茉莉酸-异亮氨酸(JA-Ile)合成酶,被认为是拟南芥JA通路中必需的信号转导因子[30],本研究中甜叶菊响应链格孢菌的侵染,接种48 h后表达量显著上调,表明在甜叶菊受链格孢菌侵染时,JA信号通路基因的表达发生相应的改变,提高植物体内JA水平,对病原菌的侵染作出响应。
4 结论
根据真菌形态鉴定、致病性鉴定以及病原菌rDNA-ITS序列同源性分析结果,确定甜叶菊褐斑病的致病菌为链格孢及细极链格孢。显微观察发现细极链格孢菌丝可以从叶片的气孔以及表皮细胞间隙侵入表皮细胞。外源施加MeJA能够有效抑制细极链格孢菌丝的生长,MeJA处理后的甜叶菊叶片对细极链格孢的抗性明显增强,具有显著的诱抗作用,在甜叶菊褐斑病的防治中具有很好的应用前景。
[1] 刘琼, 潘芸芸, 吴卫. 甜叶菊化学成分及药理活性研究进展. 天然产物研究与开发, 2018, 30(6): 1085-1091.
LIU Q, PAN Y Y, WU W. Review on chemical compositions and pharmacological activities of(Bertoni) Hemsl., 2018, 30(6): 1085-1091. (in Chinese)
[2] Chaturvedula V S, Clos J F, Rhea J, Milanowski D, Mocek U, DuBois G E, Prakash I. Minor diterpene glycosides from the leaves of., 2011, 4(3): 209-212.
[3] Yadav A K, Singh S, Dhyani D, Ahuja P S. A review on the improvement of stevia [(Bertoni)]., 2011, 91(1): 1-27.
[4] 吴则东, 张文彬, 吴玉梅, 刘乃新. 世界甜叶菊发展概况. 中国糖料, 2016, 38(4): 62-65.
Wu Z D, Zhang W B, Wu Y M, Liu N X. Review ofdevelopment in the world., 2016, 38(4): 62-65. (in Chinese)
[5] 徐鸿. 甜菊糖的特点及功能. 现代农业科技, 2013(2): 286-287.
Xu H. Characteristic and functions of stevioside., 2013(2): 286-287. (in Chinese)
[6] 张天宇. 中国真菌志. 第16卷. 链格孢属. 北京: 科学出版社, 2003.
Zhang T Y.. Beijing: Science Press, 2003. (in Chinese)
[7] Farr D F, Bills G F, Chamuris G P, Rossman A Y.. St. Paul (Minnesota): The American Phytopathological Society (APS) Press, 1989.
[8] 陈伟群. 链格孢及相似属代表种的分子系统学研究[D]. 杨凌: 西北农林科技大学, 1997.
Chen W Q. Molecular phylogenetic study ofand similar genera[D]. Yangling: Northwest A&FUniversity, 1997. (in Chinese)
[9] Tisdale W B, Wadkins R F. Brown spot of tobacco caused by(E. & E.), n. comb., 1931, 21(6): 641-660.
[10] Yu Q. Loss rate estimation of yield and output value of tobacco leaf infected by tobacco blown spot ()., 2010, 1(6): 23-27, 63.
[11] 李金花, 柴兆祥, 王蒂, 李敏权. 甘肃马铃薯贮藏期真菌性病害病原菌的分离鉴定. 兰州大学学报 (自然科学版), 2007, 43(2): 39-42.
Li J H, Chai Z X, Wang D, Li M Q. Isolation and identification of the pathogens of potato fungus diseases during storage in Gansu Province., 2007, 43(2): 39-42. (in Chinese)
[12] 邵玉琴, 吕佩珂. 番茄早疫病发生、流行与生态因子关系的研究. 内蒙古大学学报 (自然科学版), 1993, 24(2): 208-211.
Shao Y Q, LÜ P K. A study about the relationship betweenon the happening prevalence and ecological factors of tomatoes., 1993, 24(2): 208-211. (in Chinese)
[13] Ishiba C, Yokoyama T, Tani T. Black spot disease of stevia caused by., 1982, 48(1): 44-51.
[14] Maiti C K, Sen S, Acharya R, Acharya K. First report ofcausing leaf spot on., 2007, 56(4): 723.
[15] Atghia O, Javan-Nikkhah M, Poursafar A, Khojasteh M, Eslamzadeh B. First report ofspecies as the causal agent of leaf spot onandplants in Iran//. University of Tehran, Karaj, Iran, 2015: 130.
[16] 魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979.
Wei J C.. Shanghai: Shanghai Scientific and Technical Publishers, 1979. (in Chinese)
[17] Sun H H, Wang L, Zhang B Q, Ma J H, Hettenhausen C, Cao G Y, Sun J L, Wu J Q, Wu J S. Scopoletin is a phytoalexin againstin wild tobacco dependent on jasmonate signalling., 2014, 65(15): 4305-4315.
[18] Geuns J M C. Stevioside., 2003, 64(5): 913-921.
[19] Philippaert K, Pironet A, Mesuere M, Sones W, Vermeiren L, Kerselaers S, Pinto S, Segal A, Antoine N, Gysemans C, Laureys J, Lemaire K, Gilon P, Cuypers E, Tytgat J, Mathieu C, Schuit F, Rorsman P, Talavera K, Voets T, Vennekens R. Steviol glycosides enhance pancreatic beta-cell function and taste sensation by potentiation of TRPM5 channel activity., 2017, 8: 14733.
[20] Geuns J.. Euprint, 2010.
[21] Geuns J, Struyf T. Radical scavenging activity of steviol glycosides and steviol glucuronide., 2010, 6(8): 2025-2028.
[22] Hajihashemi S, Geuns J M C. Free radical scavenging activity of steviol glycosides, steviol glucuronide, hydroxytyrosol, metformin, aspirin and leaf extract of., 2013, 3(44): S34-S41.
[23] 唐志发. 甜菊糖的崛起与发展战略. 中国食品工业, 1999, 6(2): 52.
Tang Z F. The rise and development strategy of stevioside., 1999, 6(2): 52. (in Chinese)
[24] 朱东顺, 宋晴晴, 傅在秋, 臧义战. 山东省甜叶菊的主要病害及防治措施. 中国糖料, 2002(3): 27-29.
Zhu D S, Song Q Q, Fu Z Q, Zang Y Z. The diseases and control measures ofin Shandong Province., 2002(3): 27-29. (in Chinese)
[25] 柴再生, 蒋宏, 王亮. 河西走廊甜叶菊拱棚育苗三大病害发生原因及防治策略. 中国糖料, 2017, 39(4): 79-80.
Chai Z S, Jiang H, Wang L. Causes and prevention strategies of three major diseases in stevia nursery seedlings of Hexi Corridor., 2017, 39(4): 79-80. (in Chinese)
[26] Blée E. Impact of phyto-oxylipins in plant defense., 2002, 7(7): 315-321.
[27] Guo Q, Major I T, Howe G A. Resolution of growth-defense conflict: mechanistic insights from jasmonate signaling., 2018, 44: 72-81.
[28] Grimes H D, Koetje D S, Franceschi V R. Expression, activity, and cellular accumulation of methyl jasmonate-responsive lipoxygenase in soybean seedlings., 1992, 100(1): 433-443.
[29] Chini A, Boter M, Solano R. Plant oxylipins: COI1/JAZs/ MYC2 as the core jasmonic acid-signalling module., 2009, 276(17): 4682-4692.
[30] Mosblech A, Thurow C, Gatz C, Feussner I, Heilmann I. Jasmonic acid perception by COI1 involves inositol polyphosphates in., 2011, 65(6): 949-957.
(责任编辑 岳梅)
Identification of Pathogens Causing Brown Spot and the Role of MeJA in Disease Resistance in
Cui Xiaoxia, Shu Hongmei, Jiang Lu, He Xiaolan, Gong Yuanyong, Ni Wanchao, Guo Shuqiao
(Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014)
【Objective】The objective of this study is to identify the pathogenic fungus causing brown spot disease on, and analyze the role of MeJA in response toto provide a basis for disease prevention and resistance breeding. 【Method】The samples of diseasedleaves were collected from the stevia production base of Fuan Town, Dongtai City, Jiangsu Province. After isolation and purification, the isolates were identified by using the methods of morphological characteristics analysis. Morphology parameters mainly included the colony and conidial morphology, conidial size. The isolates pathogenicity was tested on detachedleaves. The internal transcribed spacer (ITS) rDNA region of the 7 pathogenic strains was amplified by using the fungal universal primers ITS1 and ITS4, and then the amplified product was recovered and sequenced. MEGA 7 was used to construct phylogenetic tree to confirm the pathogen species based on the rDNA-ITS sequence and the relatedsequences in GenBank. The germination status ofconidial spores and the way they invaded the leaves after stained with trypan blue were analyzed by microscopy. The effect on the growth ofmycelium was analyzed by exogenous application of MeJA to potato dextrose agar (PDA) medium. To test the role of MeJA in theresistance to, detached leaves were fed with MeJA and then used for infection. The qPCR method was performed to analyze the expression of JA pathway-related genes before or after inoculation within leaves of. 【Result】Sevenstrains were collected from the diseasedleaves. All the strains grew on the PDA medium in a nearly circular and equal diameter radiation. The aerial hyphae were relatively developed, with white at the beginning and gradually changed to different degrees of grayish black at the later stage. The conidia are solitary or in a chain, mostly nearly spherical, inverted bar-shaped, or inverted pear-shaped, with a size of (20.5-45.5) × (6.5-16.0) μm. The isolated 7 strains were inoculated on the detached leaves of, and the pathogenicity was different. ST2, ST3 and ST7 strains led to the lesions spread rapidly with stronger pathogenicity. The rDNA-ITS sequence length of the ST2, ST3, and ST7 strains was 569, 570, and 570 bp, respectively. Phylogenetic tree analysis indicated that the similarity of ST2 and ST3 with strains KY814634.1 and DQ491089.1 (,sp.) is between 99%-100%, and similarity between ST7 and strain HQ402558.1 () is 99%. The results of trypan blue staining ofleaves inoculated withshowed that conidia of ST7 could germinate from the head, lateral and caudal of the spores, and themycelia could invade into epidermal cells from the stomata or the epidermis intercellular. Exogenous application of MeJA could effectively inhibit the growth ofmycelia when the concentration of MeJA was higher than 200 μmol·L-1. After inoculated with, the lesion area of detached leaves that fed with 100 μmol·L-1MeJA was significantly smaller than that of the control, indicating that MeJA could enhance theresistance to. JA pathway related genes were involved in the response ofto, the expression ofandwas up-regulated while the expression ofandwas down-regulated afterinoculated with.【Conclusion】The pathogenic fungus that causedleaf brown spot in the stevia production base of Fuan Town, Dongtai City, Jiangsu Province was identified as.mycelia can invade epidermal cells from the stomata or the epidermis intercellular space of the leaves. The resistance ofleaves towas enhanced after exogenous application of MeJA, which will become the potential candidates for the control ofbrown spot disease in the field.
; brown spot disease;; identification of pathogens; methyl jasmonate; signaling pathway
10.3864/j.issn.0578-1752.2018.18.008
2018-04-18;
2018-05-18
江苏省科技计划(SZ-SQ2017019)
崔晓霞,E-mail:cuixiaoxia7@163.com。通信作者郭书巧,Tel:025-84390290;E-mail:gsq925@163.com

