基于Meta分析的参芪扶正注射液辅助常规化疗治疗非小细胞肺癌的系统评价Δ
张胜男,倪梦蔚,王凯欢,吴嘉瑞,段笑娇,刘殊羽
(北京中医药大学中药学院,北京 100102)
原发性支气管肺癌(以下简称“肺癌”)是我国最常见的恶性肿瘤之一。国家癌症中心2015年发布的数据显示, 2006—2011年我国肺癌5年患病率为130.2(1/10万),其中,男性为84.6(1/10万),居恶性肿瘤的第2位;女性为45.6(1/10万),居恶性肿瘤的第4位[1]。如不能有效加以控制,预计到2025年我国将成为肺癌第一大国[2]。其中,占肺癌病理类型85%的NSCLC(non-small cell lung cancer,NSCLC)对化疗不甚敏感,且由于其早期症状咳嗽、痰多与咽炎等常见病类似,发病症状不明显,患者就诊时往往已至中晚期,并且多伴随远处转移。长春瑞滨、吉西他滨、多西他赛及紫杉醇联合铂类药物是临床上最常见的治疗NSCLC的化疗方案[3],但由于毒副作用大,不适用于体力状况较差的患者。参芪扶正注射液系中药党参和黄芪的干燥根经水提醇沉、精制而成的无菌水溶性纯中药制剂。《本经正义》云:“党参力能补脾养肾,润肺生津,健运中气”。黄芪也为补气要药,既可内补脏腑之气,又可益卫固表托毒。参芪扶正注射液自1999年上市以来即被广泛应用于肿瘤辅助治疗和心脏相关疾病治疗,具有抗肿瘤、抗心肌缺血再灌注损伤、抗血栓及抗糖尿病等药理作用。目前,其多与化疗药联合用于恶性肿瘤的辅助治疗。本研究基于文献荟萃分析(Meta分析),对参芪扶正注射液联合常规化疗治疗NSCLC的安全性和有效性进行系统评价,以期为临床合理治疗提供循证依据。
1 资料与方法
1.1 纳入与排除标准
(1)研究类型:参芪扶正注射液联合含顺铂化疗方案治疗中晚期NSCLC的随机对照试验(randomized controlled trial,RCT),无论是否使用盲法。(2)研究对象:均符合由原国家卫生和计划生育委员会医政医管局委托中国抗癌协会肿瘤临床化疗专业委员会制定的《中国原发性肺癌诊疗规范(1997年版)》中的诊断标准,经病理学和(或)细胞学确诊为中晚期NSCLC;年龄、性别、种族及疾病严重程度不限;均有可测量病灶;Karnofsky(KPS)评分≥50分[4];无咯血或其他出血倾向;肝肾功能及血常规正常;预计生存期>3个月。(3)干预措施:观察组患者采用参芪扶正注射液250 ml联合含顺铂化疗方案治疗;对照组患者单用含顺铂化疗方案治疗,用药剂量及疗程不限。(4)结局指标:①疗效标准的客观疗效标准参照世界卫生组织(world health organization,WHO)标准,分为完全缓解、部分缓解、稳定和进展[5],有效率=(完全缓解病例数+部分缓解病例数)/总病例数×100%。②生活质量评定,观察治疗前后患者KPS评分变化。改善,KPS评分增加≥10分,并维持4周以上;稳定,KPS评分无明显变化;恶化,KPS评分减少≤10分。有效率=改善病例数/总病例数×100%。③不良反应程度按WHO分级标准[4]进行评定,分为Ⅰ—Ⅳ级,不良反应发生率=(Ⅰ级病例数+Ⅱ级病例数+Ⅲ级病例数+Ⅳ级病例数)/总病例数×100%。④免疫功能:治疗前后用流式细胞仪测定患者总T淋巴细胞(CD3+)、辅助T淋巴细胞(CD4+)、抑制/细胞毒T淋巴细胞(CD8+)、CD4+/CD8+比值和自然杀伤(NK)细胞水平。(5)排除标准:研究涉及以下任意一条即可排除。①非临床试验(药理实验、综述及个案报道);②干预措施中存在除参芪扶正注射液以外其他的中医药疗法,如针刺穴位、合用其他中药;③全文未提及随机或随机方法为高风险(按入院顺序随机);④未提及疗效标准或非WHO疗效判定标准;⑤未述诊断标准;⑥治疗方案未提及具体干预措施(剂量、疗程等);⑦对照组治疗方案混杂;⑧患者临床分期非中晚期。
1.2 文献检索策略
计算机检索中国期刊全文数据库(CNKI)、中文科技期刊数据库(VIP)、中国生物医学文献数据库(CBM)、万方数据库、PubMed及the Cochrane Library等数据库,检索时限截至2018年3月6日。中文数据库以“非小细胞肺肿瘤”或“非小细胞肺癌”并“参芪扶正”或“参芪扶正注射液”或“参芪扶正注射液”为主题词并“随机”为全文检索词进行检索;英文数据库以“Non-Small-Cell Lung Carcinomas”“Non-small Cell Lung Cancer”“Non Small Cell Lung Carcinoma”“Non-Small Cell Lung Carcinoma”“Non-Small Cell Lung Cancer”及“Shenqifuzheng”等检索词进行检索。
1.3 文献筛选与资料提取
由2名研究者独立筛选及纳入文献,并提取资料,如有分歧,可以进行讨论或咨询第三方。提取内容包括:纳入研究的基本信息,包括第一作者、发表年份等;研究对象的基本特征,包括观察组和对照组的患者数、性别组成、平均年龄及干预措施的具体细节;研究所关注的结局指标和结果测量数据;研究设计类型和偏倚风险评价的关键因素。
1.4 纳入研究的方法学质量评价
由2名研究者运用Cochrane系统评价员手册5.1.0版RCT偏倚风险评估工具[6]对纳入研究进行偏倚分析评价,评价条目包括随机序列生成(选择偏倚)、分配隐藏(选择偏倚)、所有研究参与者和人员采用盲法(执行偏倚)、结果评估的盲法(观察偏倚)、不完整的结果数据(失访偏倚)、选择性报告(报告偏倚)和其他偏倚,每方面内容均有“低风险”“未知风险”和“高风险”3个等级。如遇分歧交由第三方裁定。
1.5 统计学方法
采用Revman 5.3软件统计相关数据,二分类变量指标选用相对危险度(RR)、连续变量计量采用均数差(MD)表示,均计算95%置信区间(CI),P<0.05认为组间差异有统计学意义。采用卡方分析考察研究间的异质性,并用I2来评价异质性大小,P>0.1,I2<50%时,采用固定效应模型合并分析,否则采用随机效应模型合并分析;如果存在疗程、剂量及治疗方案等临床或方法学异质性,则采用亚组分析。继续应用Stata 15.0软件对相关数据进行统计分析,对潜在的发表偏倚采用漏斗图进行分析,利用Begg’s检验判断是否存在偏倚;对结果的稳定性用敏感性分析图评价;研究的异质性用Galbraith图进行分析;最后按时间顺序用累积Meta分析对常规化疗对参芪扶正注射液的临床疗效进行评价。
2 结果
2.1 文献检索流程
初检出文献1 620篇,去重、阅读题目及摘要后排除明显不相关文献,共收集参芪扶正注射液用于NSCLC的临床研究138篇;进一步阅读全文,排除个案研究及不符合纳入标准的文献;最终纳入文献41篇[7-47],均为已发表的中文文献,发表时间为2004—2017年。文献筛选流程见图1。
2.2 纳入文献的基本特征
41篇文献[7-47]共涉及患者3 189例,其中观察组患者1 599例,对照组患者1 590例,年龄43.2~74.3岁,平均59.6岁;参芪扶正注射液(丽珠制药集团生产,规格为250 ml/瓶,每瓶相当于原党参10 g、原黄芪10 g)的用量为250 ml/d,多在化疗前3 d使用,21 d为1个周期,每日使用或1个周期使用7~14 d,疗程多在46.5 d内。纳入文献的基本特征见表1。
2.3 纳入研究的方法学评价质量
41篇文献中,10篇[16,18-19,21,26,30,32,37-38,41]描述了其产生随机数列的方法,9篇[16,18-19,26,30,32,37-38,41]采用随机数字表法,1篇[21]采用信封法,其余31篇[7-15,17,20,22-25,27-29,31,33-36,39-40,42-47]未描述产生随机数列的方法,故评价为“未知风险”;1篇[43]使用双盲法,其余文献均未描述盲法,故评价为“未知风险”;
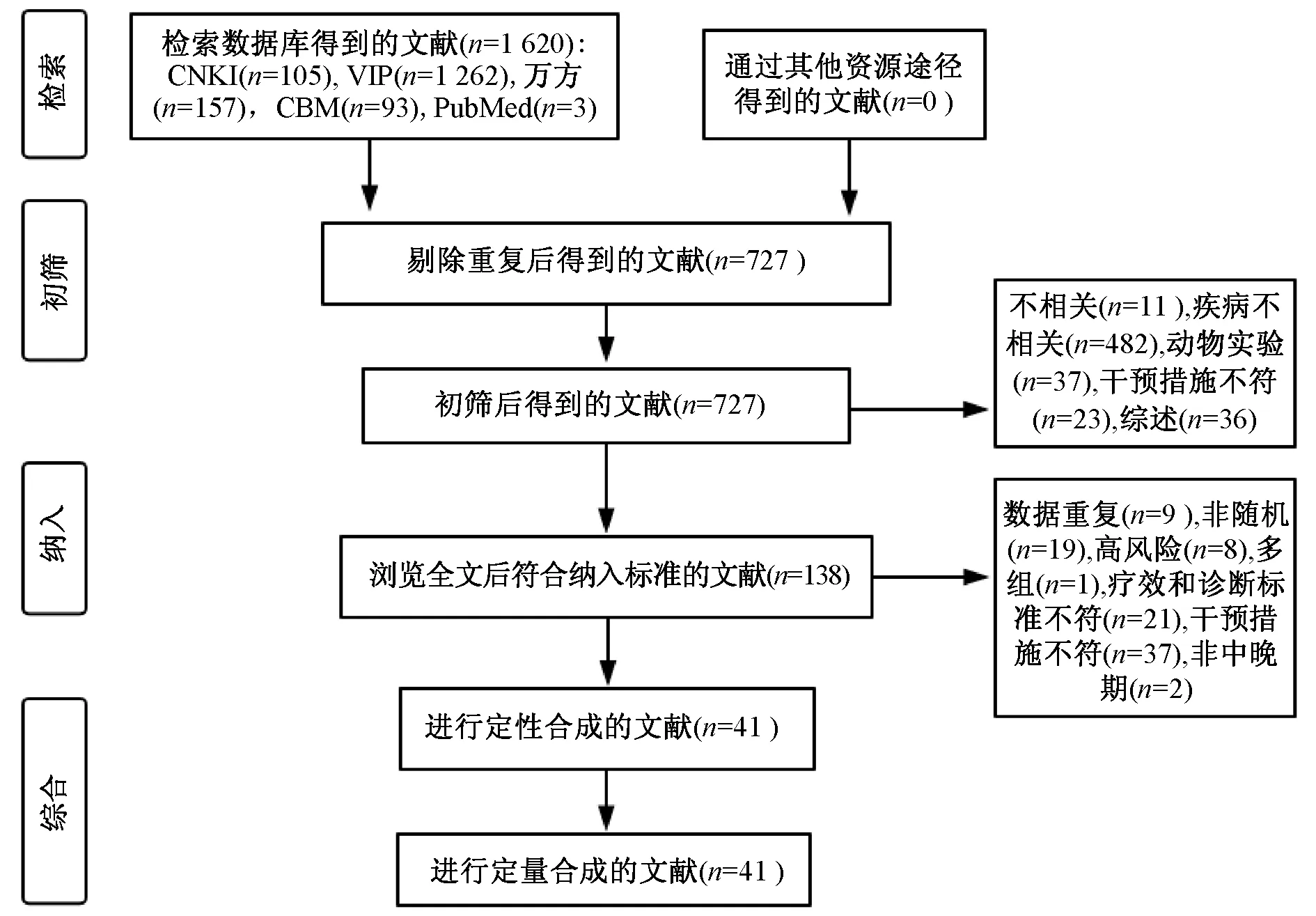
图1 文献筛选流程图Fig 1 Literature screening process
均未描述分配隐藏,其中1篇[47]对生活质量进行了选择性报告,其余文献均没有病例脱落及选择性报告的情况,其磨损偏倚及报告偏倚均评价为“低风险”;其他偏倚方面,因原始研究中未提及是否存在其他能导致研究具有高偏倚风险的问题,故评价为“未知风险”。纳入研究的质量相对一般,见图2。
2.4 Meta分析结果
所有纳入的RCT根据化疗方案的不同分为NP(长春瑞滨+顺铂)方案、TP(紫杉醇+顺铂)方案、GP(吉西他滨+顺铂)方案、DP(多西他赛+顺铂)方案4个亚组。
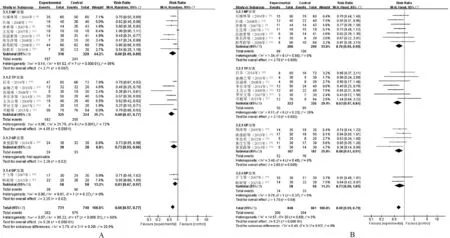
2.4.1 临床疗效: 29篇文献[7-13,16-17,20-26,28,33-35,37-43,45,47]报告了临床疗效,将纳入的RCT分为4个亚组。(1)参芪扶正注射液+NP(观察组)vs.NP(对照组)。共10篇文献[7-13,16-17,20],涉及716例患者,经异质性检验,P=0.99>0.1,I2=0%<50%,采用固定效应模型进行Meta分析。结果显示,观察组患者的临床疗效明显优于对照组,差异有统计学意义(RR=1.19,95%CI=1.01~1.39,Z=2.10,P=0.04<0.05)。(2)参芪扶正注射液+TP(观察组)vs.TP(对照组)。共7篇文献[21-26,28],涉及458例患者,经异质性检验,P=0.70>0.1,I2=0%<50%,采用固定效应模型进行Meta分析。结果显示,观察组患者的临床疗效明显优于对照组,差异有统计学意义(RR=1.28,95%CI=1.07~1.53,Z=2.67,P=0.008<0.05)。
表1纳入文献的基本特征
Tab1Basiccharacteristicsofinvolvedliterature
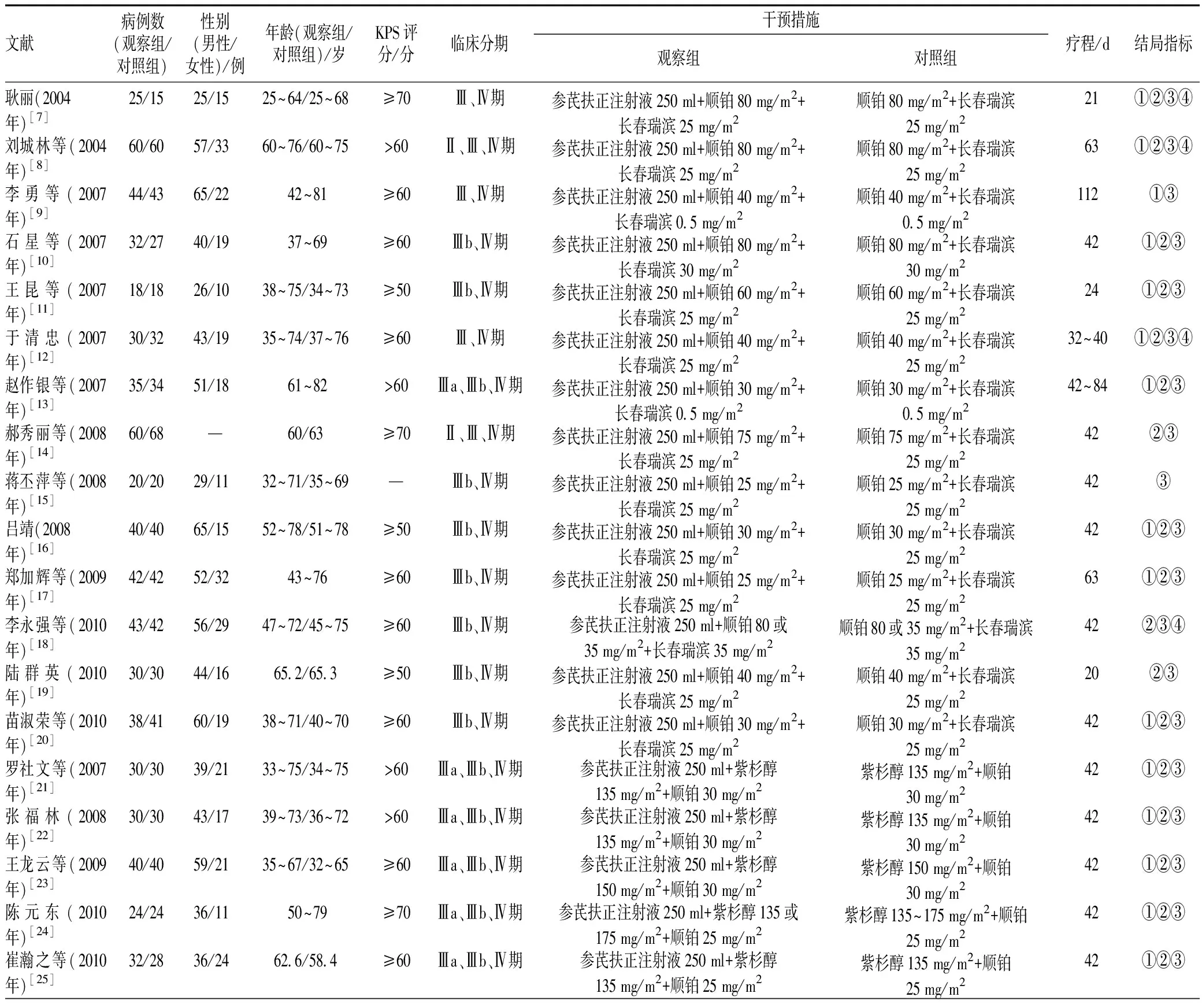
文献病例数(观察组/对照组)性别(男性/女性)/例年龄(观察组/对照组)/岁KPS评分/分临床分期干预措施观察组对照组疗程/d结局指标耿丽(2004年)[7]25/1525/1525~64/25~68≥70Ⅲ、Ⅳ期参芪扶正注射液250 ml+顺铂80 mg/m2+长春瑞滨25 mg/m2顺铂80 mg/m2+长春瑞滨25 mg/m221①②③④刘城林等(2004年)[8]60/6057/3360~76/60~75>60Ⅱ、Ⅲ、Ⅳ期参芪扶正注射液250 ml+顺铂80 mg/m2+长春瑞滨25 mg/m2顺铂80 mg/m2+长春瑞滨25 mg/m263①②③④李勇等(2007年)[9]44/4365/2242~81≥60Ⅲ、Ⅳ期参芪扶正注射液250 ml+顺铂40 mg/m2+长春瑞滨0.5 mg/m2顺铂40 mg/m2+长春瑞滨0.5 mg/m2112①③石星等(2007年)[10]32/2740/1937~69≥60Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂80 mg/m2+长春瑞滨30 mg/m2顺铂80 mg/m2+长春瑞滨30 mg/m242①②③王昆等(2007年)[11]18/1826/1038~75/34~73≥50Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂60 mg/m2+长春瑞滨25 mg/m2顺铂60 mg/m2+长春瑞滨25 mg/m224①②③于清忠(2007年)[12]30/3243/1935~74/37~76≥60Ⅲ、Ⅳ期参芪扶正注射液250 ml+顺铂40 mg/m2+长春瑞滨25 mg/m2顺铂40 mg/m2+长春瑞滨25 mg/m232~40①②③④赵作银等(2007年)[13]35/3451/1861~82>60Ⅲa、Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂30 mg/m2+长春瑞滨0.5 mg/m2顺铂30 mg/m2+长春瑞滨0.5 mg/m242~84①②③郝秀丽等(2008年)[14]60/68—60/63≥70Ⅱ、Ⅲ、Ⅳ期参芪扶正注射液250 ml+顺铂75 mg/m2+长春瑞滨25 mg/m2顺铂75 mg/m2+长春瑞滨25 mg/m242②③蒋丕萍等(2008年)[15]20/2029/1132~71/35~69—Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂25 mg/m2+长春瑞滨25 mg/m2顺铂25 mg/m2+长春瑞滨25 mg/m242③吕靖(2008年)[16]40/4065/1552~78/51~78≥50Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂30 mg/m2+长春瑞滨25 mg/m2顺铂30 mg/m2+长春瑞滨25 mg/m242①②③郑加辉等(2009年)[17]42/4252/3243~76≥60Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂25 mg/m2+长春瑞滨25 mg/m2顺铂25 mg/m2+长春瑞滨25 mg/m263①②③李永强等(2010年)[18]43/4256/2947~72/45~75≥60Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂80或35 mg/m2+长春瑞滨35 mg/m2顺铂80或35 mg/m2+长春瑞滨35 mg/m242②③④陆群英(2010年)[19]30/3044/1665.2/65.3≥50Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂40 mg/m2+长春瑞滨25 mg/m2顺铂40 mg/m2+长春瑞滨25 mg/m220②③苗淑荣等(2010年)[20]38/4160/1938~71/40~70≥60Ⅲb、Ⅳ期参芪扶正注射液250 ml+顺铂30 mg/m2+长春瑞滨25 mg/m2顺铂30 mg/m2+长春瑞滨25 mg/m242①②③罗社文等(2007年)[21]30/3039/2133~75/34~75>60Ⅲa、Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇135 mg/m2+顺铂30 mg/m2紫杉醇135 mg/m2+顺铂30 mg/m242①②③张福林(2008年)[22]30/3043/1739~73/36~72>60Ⅲa、Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇135 mg/m2+顺铂30 mg/m2紫杉醇135 mg/m2+顺铂30 mg/m242①②③王龙云等(2009年)[23]40/4059/2135~67/32~65≥60Ⅲa、Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇150 mg/m2+顺铂30 mg/m2紫杉醇150 mg/m2+顺铂30 mg/m242①②③陈元东(2010年)[24]24/2436/1150~79≥70Ⅲa、Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇135或175 mg/m2+顺铂25 mg/m2紫杉醇135~175 mg/m2+顺铂25 mg/m242①②③崔瀚之等(2010年)[25]32/2836/2462.6/58.4≥60Ⅲa、Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇135 mg/m2+顺铂25 mg/m2紫杉醇135 mg/m2+顺铂25 mg/m242①②③
续表1

文献病例数(观察组/对照组)性别(男性/女性)/例年龄(观察组/对照组)/岁KPS评分/分临床分期干预措施观察组对照组疗程/d结局指标李海涛等(2012年)[26]30/3044/1649~82/50~82>60Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇135 mg/m2+顺铂25 mg/m2紫杉醇135 mg/m2+顺铂25 mg/m242①②③麦海燕等(2013年)[27]40/4062/1857~70/58~68>50Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇135 mg/m2+顺铂25 mg/m2紫杉醇135 mg/m2+顺铂25 mg/m242①②③李东华等(2014年)[28]50/4057/3339~74/38~72>60Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇210 mg/m2+顺铂30 mg/m2紫杉醇210 mg/m2+顺铂30 mg/m242①②③任乐(2014年)[29]65/7289/4866.5/65.9—Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇135 mg/m2+顺铂25 mg/m2紫杉醇135 mg/m2+顺铂25 mg/m242③④袁坦(2014年)[30]35/3441/2843~73≥70Ⅲ、Ⅳ期参芪扶正注射液250 ml+紫杉醇135 mg/m2+顺铂25 mg/m2紫杉醇135 mg/m2+顺铂25 mg/m221②③邓艳等(2015年)[31]78/84102/6067.2/66.7—Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇80 mg/m2+顺铂75 mg/m2紫杉醇80 mg/m2+顺铂75 mg/m242③④苏雪丽(2016年)[32]38/3843/3356.2/56.4—Ⅲb、Ⅳ期参芪扶正注射液250 ml+紫杉醇135 mg/m2+顺铂30 mg/m2紫杉醇135 mg/m2+顺铂30 mg/m284④周涛等(2009年)[33]35/3543/2734~70>60Ⅲb、Ⅳ期参芪扶正注射液250 ml+吉西他滨1 250 mg/m2+顺铂25 mg/m2吉西他滨1 250 mg/m2+顺铂25 mg/m284①②③④黄汉生等(2011年)[34]39/3959/1962~79/63~78—Ⅲb、Ⅳ期参芪扶正注射液250 ml+吉西他滨1 000 mg/m2+顺铂25 mg/m2吉西他滨1 000 mg/m2+顺铂25 mg/m242①③李忠英(2012年)[35]25/2538/1242~68≥60Ⅱb、Ⅲa、Ⅲb期参芪扶正注射液250 ml+吉西他滨1 000 mg/m2+顺铂25 mg/m2吉西他滨1 000 mg/m2+顺铂25 mg/m214~20①②③齐锦宏等(2012年)[36]43/41——≥60Ⅱ、Ⅲ、Ⅳ期参芪扶正注射液250 ml+吉西他滨1 000 mg/m2+顺铂30 mg/m2吉西他滨 1 000 mg/m2+顺铂30 mg/m221③姚德蛟等(2013年)[37]50/5084/1631~70/30~70>70Ⅲ、Ⅳ期参芪扶正注射液250 ml+吉西他滨1 000 mg/m2+顺铂50 mg/m2吉西他滨1 000 mg/m2+顺铂50 mg/m242①②③安爱军等(2014年)[38]52/4549/4839~73/40~76≥60Ⅲb、Ⅳ期参芪扶正注射液250 ml+吉西他滨1 000 mg/m2+顺铂30 mg/m2吉西他滨1 000 mg/m2+顺铂30 mg/m256①③黄爱霞等(2014年)[39]38/38—56.84/57.28>70Ⅲb、Ⅳ期参芪扶正注射250 ml+吉西他滨1 000 mg/m2+顺铂100 mg/m2吉西他滨1 000 mg/m2+顺铂100 mg/m221①②③赵晓勤(2014年)[40]51/5162/4046~77/48~76≥60Ⅲb、Ⅳ期参芪扶正注射液250 ml+吉西他滨1 000 mg/m2+顺铂25 mg/m2吉西他滨1 000 mg/m2+顺铂25 mg/m242①④贵永贤等(2016年)[41]45/4864/2936~74/39~75—Ⅲ、Ⅳ期参芪扶正注射液250 ml+吉西他滨1 500 mg/m2+顺铂70 mg/m2吉西他滨1 500 mg/m2+顺铂70 mg/m284①③张乐蒙等(2017年)[42]52/5259/4541~82/42~81—Ⅲb、Ⅳ期参芪扶正注射液250 ml+吉西他滨1 000 mg/m2+顺铂25 mg/m2吉西他滨1 000 mg/m2+顺铂25 mg/m242①④于飞等(2007年)[43]30/3044/1651~77/50~78≥50Ⅲb、Ⅳ期参芪扶正注射液250 ml+多西他赛75 mg/m2+顺铂25 mg/m2多西他赛75 mg/m2+顺铂25 mg/m242~63①②③刘扬帆等(2011年)[44]50/5051/4956.5/57.1—Ⅱb、Ⅲ、Ⅳ期参芪扶正注射液250 ml+多西他赛75 mg/m2+顺铂75 mg/m2多西他赛75 mg/m2+顺铂75 mg/m242②③王为民等(2011年)[45]24/2837/1556.6/57.13>60Ⅳ期参芪扶正注射液250 ml+多西他赛75 mg/m2+顺铂75 mg/m2多西他赛75 mg/m2+顺铂75 mg/m242①②③马晨光(2013年)[46]28/2835/2172/71>50Ⅲa、Ⅲb、Ⅳ期参芪扶正注射液250 ml+多西他赛75 mg/m2+顺铂60 mg/m2多西他赛75 mg/m2+顺铂60 mg/m284④韩莉等(2015年)[47]28/2831/2555.17/58.24≥60Ⅲb、Ⅳ期参芪扶正注射液250 ml+多西他赛75 mg/m2+顺铂75 mg/m2多西他赛75 mg/m2+顺铂75 mg/m284①②③④
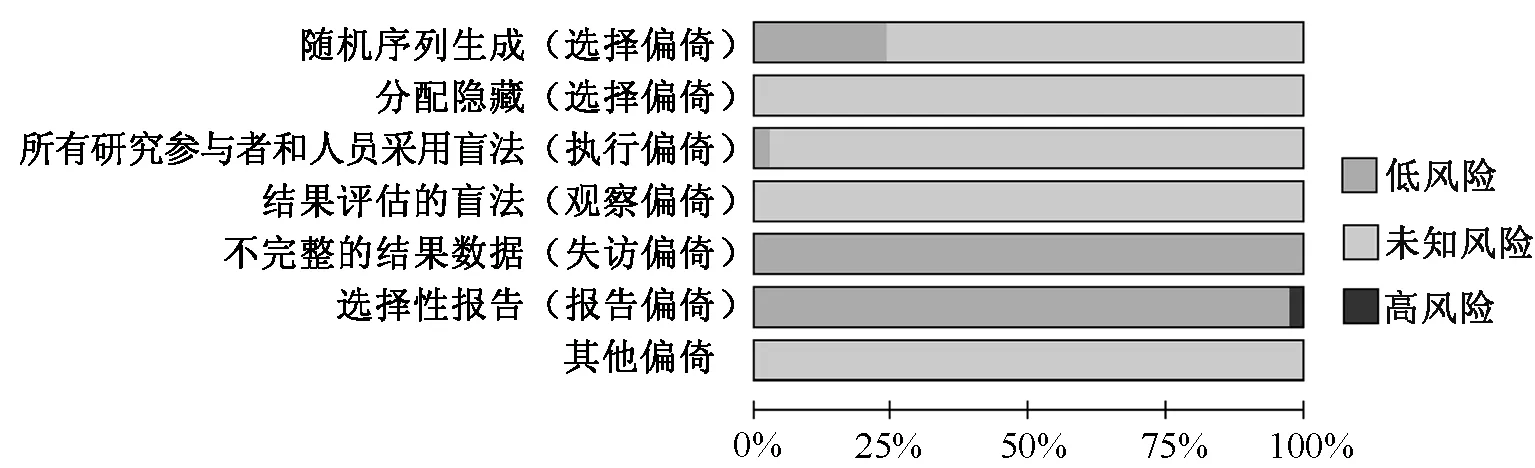
图2 纳入研究的风险偏倚评价结果Fig 2 Risk bias evaluation results
(3)参芪扶正注射液+GP(观察组)vs.GP(对照组)。共9篇文献[33-35,37-42],涉及755例患者,经异质性检验,P=0.87>0.1,I2=0%<50%,采用固定效应模型进行Meta分析。结果显示,观察组患者的临床疗效明显优于对照组,差异有统计学意义(RR=1.27,95%CI=1.08~1.51,Z=2.81,P=0.005<0.05)。(4)参芪扶正注射液+DP(观察组)vs.DP(对照组)。共3篇文献[43,45,47],涉及患者168例,经异质性检验,P=0.91>0.1,I2=0%<50%,采用固定效应模型进行Meta分析。结果显示,两组患者临床疗效的差异无统计学意义(RR=1.11,95%CI=0.81~1.52,Z=0.63,P=0.53>0.05)。由于4个亚组间无明显异质性(P=0.82>0.1,I2=0%<50%),因此可将亚组结果合并,结果显示,观察组患者的临床总有效率明显优于对照组,差异有统计学意义(RR=1.23,95%CI=1.12~1.35,Z=4.35,P<0.000 1),见图3(A)。
2.4.2 生活质量:25篇文献[8,10-12,14,16,18-20,21-23,25-28,30,33,35,37-39,41,44-45]报告了生活质量,将纳入的RCT分为4个亚组。(1)参芪扶正注射液+NP(观察组)vs.NP(对照组)。共9篇文献[8,10-12,14,16,18-20],涉及709例患者,经异质性检验,P=0.14>0.1,I2=35%<50%,采用固定效应模型进行Meta分析。结果显示,观察组患者的生活质量改善情况明显优于对照组,差异有统计学意义(RR=1.78,95%CI=1.43~2.21,Z=5.22,P<0.000 01)。(2)参芪扶正注射液+TP(观察组)vs.TP(对照组)。共8篇文献[21-23,25-28,30],涉及559例患者,经异质性检验,P=0.38>0.1,I2=7%<50%,采用固定效应模型进行Meta分析。结果显示,观察组患者的生活质量改善情况明显优于对照组,差异有统计学意义(RR=1.60,95%CI=1.35~1.90,Z=5.38,P<0.000 01)。(3)参芪扶正注射液+GP(观察组)vs.GP(对照组)。共6篇文献[33,35,37-39,41],涉及471例患者,经异质性检验,P=0.94>0.1,I2=0%<50%,采用固定效应模型进行Meta分析。结果显示,观察组患者的生活质量改善情况明显优于对照组,差异有统计学意义(RR=1.82,95%CI=1.48~2.24,Z=5.67,P<0.000 01)。(4)参芪扶正注射液+DP(观察组)vs.DP(对照组)。共2篇文献[44-45],涉及152例患者,经异质性检验,P=0.20>0.1,I2=0%<50%,采用固定效应模型进行Meta分析。结果显示,观察组患者的生活质量改善情况明显优于对照组,差异有统计学意义(RR=1.90,95%CI=1.29~2.81,Z=3.23,P=0.001<0.05)。由于4个亚组间无明显异质性(P=0.72>0.1,I2=0%<50%),因此可将亚组结果合并,结果显示,观察组患者的生活质量改善情况明显优于对照组,差异有统计学意义(RR=1.73,95%CI=1.55~1.93,Z=9.89,P<0.000 01),见图3(B)。

A.临床疗效;B.生活质量A.clinical efficacy;B.quality of life图3 两组患者临床疗效、生活质量比较的Meta分析森林图Fig 3 Meta-analysis forest plot of comparison of clinical efficacy, quality of life between two groups
2.4.3 化疗引起的不良反应:(1)白细胞计数降低。共18篇文献[8-9,11,14-16,19-23,25,28-29,31,39,43,47]报告了白细胞计数降低发生情况,将纳入的RCT分为4个亚组,由于4个亚组间无明显异质性(P=0.29>0.1,I2=20.8%<50%),因此可将亚组结果合并。Meta分析结果显示,观察组患者白细胞计数降低发生率明显低于对照组,差异有统计学意义(MD=0.66,95%CI=0.57~0.77,Z=5.26,P<0.000 01),见图4(A)。(2)血小板计数降低。共21篇文献[8-9,11,14-16,20-23,25,28-29,31,33-35,37,39,43,47]报告了血小板计数降低发生情况,将纳入的RCT分为4个亚组,由于4个亚组间无明显异质性(P=0.92>0.1,I2=0%<50%),因此可将亚组结果合并。Meta分析结果显示,观察组患者血小板计数降低发生率明显低于对照组,差异有统计学意义(MD=0.68,95%CI=0.59~0.79,Z=5.22,P<0.000 01),见图4(B)。(3)血红蛋白水平降低。共14篇文献[8,14,16,21-23,25,28-29,31,34,37,43,47]报告了血红蛋白水平降低发生情况,将纳入的RCT分为4个亚组,由于4个亚组间无明显异质性(P=0.19>0.1,I2=36.8%<50%),因此可将亚组结果合并。Meta分析结果显示,观察组患者血红蛋白水平降低发生率明显低于对照组,差异有统计学意义(MD=0.68,95%CI=0.59~0.79,Z=5.23,P<0.000 01),见图5(A)。(4)恶心呕吐。共19篇文献[9,14-16,19-23,25,28-29,31,33-36,39,45]报告了恶心呕吐发生情况,将纳入的RCT分为4个亚组,4个亚组间具有显著异质性(P<0.000 1,I2=86.4%>50%)。Meta分析结果显示,NP、TP方案亚组中,观察组患者恶心呕吐发生率明显低于对照组,差异有统计学意义;而GP、DP方案中,两组患者恶心呕吐发生率的差异无统计学意义。整体而言,观察组患者恶心呕吐发生率明显低于对照组,差异有统计学意义(MD=0.57,95%CI=0.47~0.70,Z=5.49,P<0.000 01),见图5(B)。
2.4.4 免疫功能:共12篇文献[7-8,18,29-33,40,42,46-47]报告了免疫功能,将纳入的RCT分为4个亚组,4个亚组间无明显异质性,因此可将亚组结果合并。Meta分析结果显示,治疗后,观察组患者CD3+、CD4+、CD4+/CD8+及NK 细胞水平明显高于对照组,差异均有统计学意义(P<0.000 01);但两组患者CD8+水平的差异无统计学意义(P=0.12>0.05),见表2。
2.5 敏感性分析
针对临床疗效的总体合并效应量运用逐一排除法进行敏感性分析,即每次排除1个研究,对剩余研究重新进行Meta分析以判断结果的稳定性,结果显示,效应量未发生质的变化,证明其结果较为稳定,见图6。
A.白细胞计数降低;B血小板计数降低.A.decrease of white blood cell count;B.decrease of platelet count图4 两组患者白细胞计数降低、血小板计数降低发生率比较的Meta分析森林图Fig 4 Meta-analysis forest plot of comparison of incidence of decrease of white blood cell count and platelet count between two groups

A.血红蛋白水平降低;B恶心呕吐.A.decrease of hemoglobin;B.nausea and vomiting图5 两组患者血红蛋白水平降低、恶心呕吐发生率比较的Meta分析森林图Fig 5 Meta-analysis forest plot of comparison of incidence of decrease of hemoglobin and nausea and vomiting between two groups
表2两组患者免疫功能比较的Meta分析
Tab2Meta-analysisofcomparisonofimmunologicfunctionbetweentwogroups
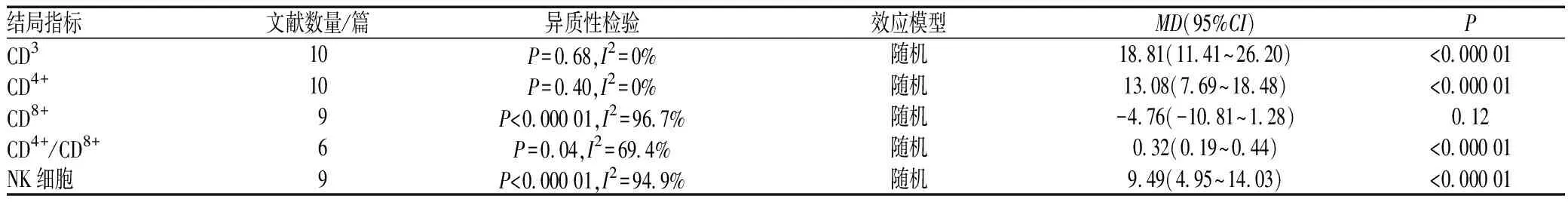
结局指标文献数量/篇异质性检验效应模型MD(95%CI)PCD310P=0.68,I2=0%随机18.81(11.41~26.20)<0.000 01CD4+10P=0.40,I2=0%随机13.08(7.69~18.48)<0.000 01CD8+9P<0.000 01,I2=96.7%随机-4.76(-10.81~1.28)0.12CD4+/CD8+6P=0.04,I2=69.4%随机0.32(0.19~0.44)<0.000 01NK细胞9P<0.000 01,I2=94.9%随机9.49(4.95~14.03)<0.000 01
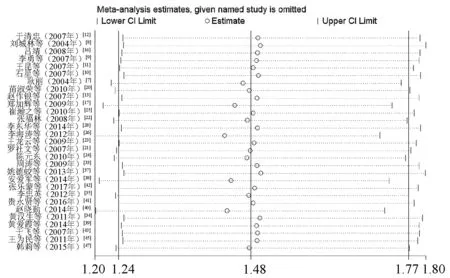
图6 临床疗效的敏感性分析Fig 6 Sensitivity analysis of clinical efficacy
2.6 异质性来源分析
针对临床疗效运用Galbraith图法直观得到敏感性分析最具异质性的常点,结果显示,各研究大多数点都落在95%CI回归直线的内部,见图7。
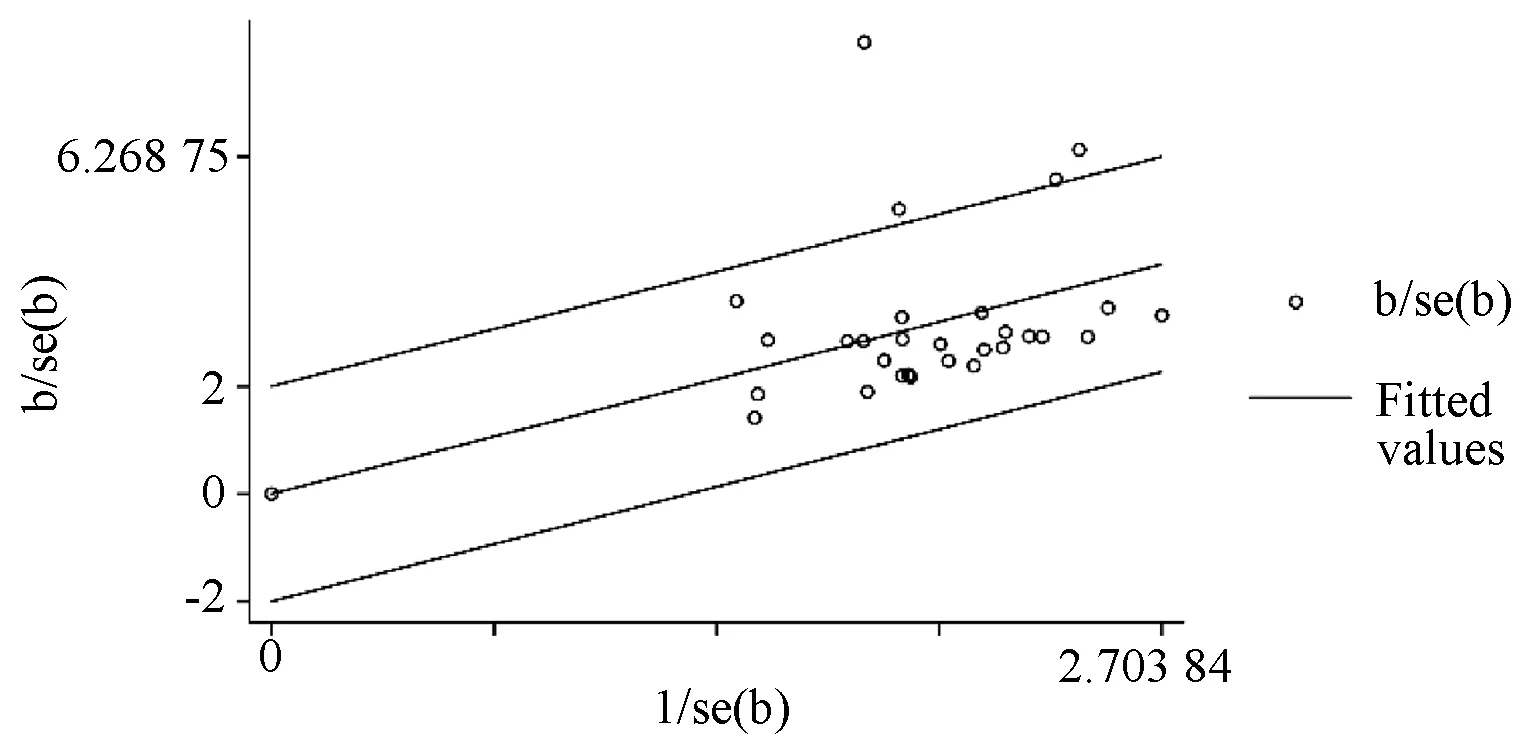
图7 临床疗效的异质性来源分析Fig 7 Heterogeneity analysis of clinical efficacy
2.7 文献发表偏倚评价
针对临床疗效绘制漏斗图衡量文献的发表偏倚,经Begg’s检验,Pr>|z|=0.119(连续性校正),说明本研究不存在明显的发表偏倚,见图8。
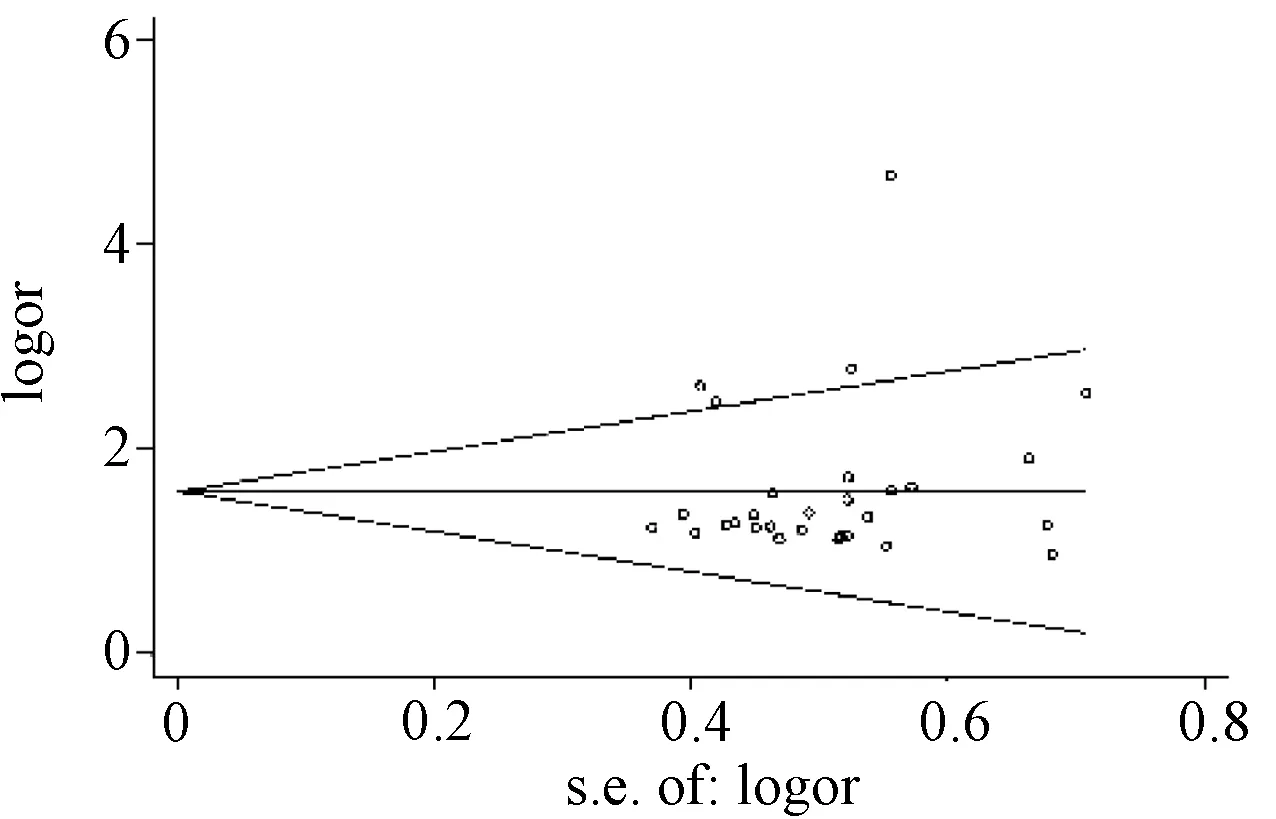
图8 临床疗效的Begg’s检验倒置漏斗图Fig 8 Begg’s test inverted funnel plot of clinical efficacy
2.8 累积Meta分析
不分亚组按年代先后顺序对临床疗效进行累积Meta分析,结果显示,OR及95%CI趋于稳定且有较好的变化趋势,见图9。
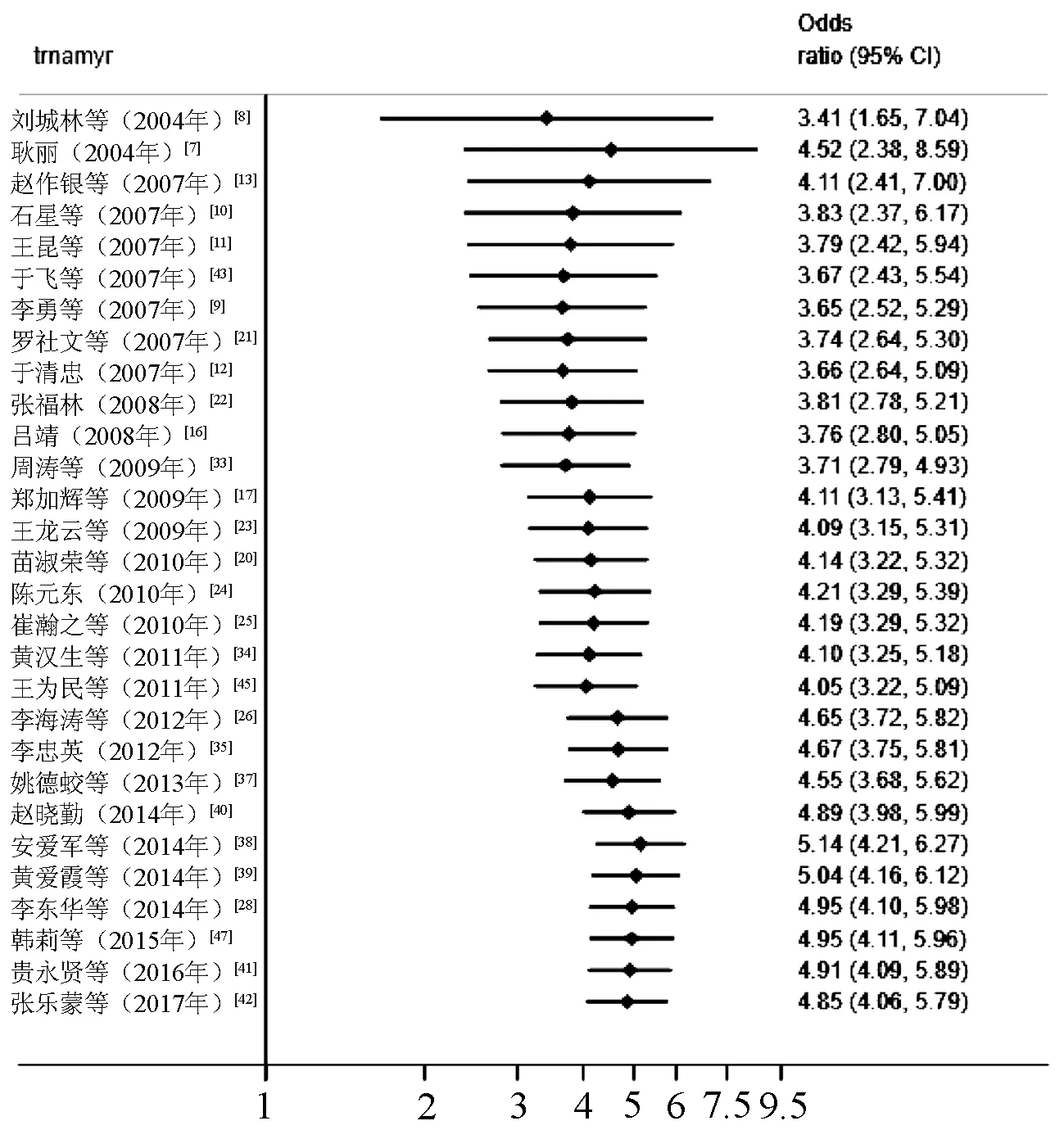
图9 临床疗效的累积Meta分析图Fig 9 Cumulative meta-analysis of clinical efficacy
3 讨论
本次Meta分析结果显示,参芪扶正注射液辅助NP、TP及GP方案可增强后者治疗中晚期NSCLC的疗效,排除任一研究后进行敏感性分析,结果的稳定性好;参芪扶正注射液可明显改善或稳定中晚期NSCLC化疗患者的生活质量,能显著减少化疗引起Ⅰ—Ⅳ度骨髓抑制和胃肠道反应,显著提高患者的CD3+、CD4+、CD4+/CD8+和NK细胞水平,增强患者的免疫功能。仅2篇文献[12,18]报告了参芪扶正注射液的不良反应,其临床应用的安全性有待进一步验证。
NSCLC对化疗不太敏感,主要通过手术切除治疗。但对于无法手术的患者,化疗几乎是唯一控制病灶的手段,放疗、免疫治疗及姑息治疗等均不如化疗应用广泛。NSCLC最常见的病理类型是鳞状细胞癌、大细胞癌和腺癌。2015年,WHO发表了肺肿瘤组织学的新分类,推荐使用分子诊断学技术结合基础的组织学病理学诊断方法对肿瘤进行精准分型[48]。本研究纳入的文献质量相对一般,对NSCLC的病理分型多采用基础的组织学病理学诊断方法,且大多并未针对NSCLC不同的病理类型考虑给予不同的药物。数据库中仅1篇文献[49]是根据病理分型的不同确定不同的基础化疗方案,但考虑到本研究按给药方案的不同对亚组分型进行讨论,病理分型基础上的不同给药方案会导致结局指标混杂,故未纳入。
本研究尚存在一些局限性:(1)纳入文献质量偏低,有1篇的质量为C级,其余文献多未具体描述随机方法;所有文献均未说明是否实施分配隐藏,不排除存在选择偏倚的可能性;仅1篇文献提及盲法的实施,故判定其为B级。(2)纳入研究的随访时间均较短,仅评价了一段时间内的临床疗效,无长期生存率、中位生存期等长期随访观察指标。建议今后的临床研究:(1)试验前进行严谨的试验设计,如采用正确随机、分配隐藏及双盲设计,扩大样本量;(2)关注参芪扶正注射液辅助抗肿瘤药治疗NSCLC的远期疗效及参芪扶正注射液临床应用的安全性,为临床合理用药提供全面的循证医学证据;(3)可根据NSCLC患者的临床分期和病理类型科学地给予相应的治疗方案。
综上所述,基于当前研究结果表明,参芪扶正注射液联合常规化疗治疗NSCLC的临床疗效明显优于单用常规化疗,可有效提高患者的生活质量,减少化疗所致不良反应,促进免疫功能的提高,扶正固本,抵御恶性肿瘤细胞。但由于尚缺乏高质量的证据支持且样本量较小,尚需更多设计严谨的多中心、大样本的随机、双盲对照试验对研究结果予以进一步证实。

