中温和高温发酵沼液营养源对半连续培养小球藻生长的影响
王忠江,司爱龙,刘 卓,李 泽,王丽丽,王贵祥
中温和高温发酵沼液营养源对半连续培养小球藻生长的影响
王忠江1,2,司爱龙1,刘 卓1,李 泽1,王丽丽1,王贵祥1
(1. 东北农业大学工程学院,哈尔滨 150030;2. 寒地农业可再生资源利用技术与装备黑龙江省重点实验室,哈尔滨 150030)
为了解中温发酵沼液和高温发酵沼液培养微藻的系统性性能,选用FACHB-5和FACHB-8 2种小球藻,采用总氮2 417.63至2 554.37 mg/L,总磷13.44至16.91 mg/L的中温35℃和高温55℃鸡粪厌氧发酵后沼液为营养源,在微藻培养液每天更新率10%的半连续培养条件下,研究更新的培养液中沼液添加比例为10% 、20% 和30%时2种沼液对微藻培养的影响。研究结果表明,添加比例为10%和20%时,2种小球藻均能很好地适应各自的培养环境,试验结束时,各试验组的OD680均维持在2.40至2.69;但当沼液添加比例为较高的30%时,2种小球藻的生长均受到明显抑制,且FACHB-5与FACHB-8相比对高浓度沼液培养环境的适应能力更强,试验结束时, FACHB-5试验组的OD680维持在1.98至2.15,FACHB-8试验组的OD680维持在1.79至1.92。高温沼液各试验组的OD680均高于各自对应的中温沼液试验组0.13以上,高温55 ℃厌氧发酵后沼液更利于微藻培养。
发酵;生长;沼液;小球藻;半连续培养;添加比例
0 引 言
微藻作为一种生物质能源,与其他能源植物相比,具有生长速度快、生物质能含量高、产品附加值高、适应性强等优点[1-3],随着全球能源紧张的加剧,生物质能源受到了各国学者的关注,尤其是微藻生物质能源[4-5]。但在微藻的培养过程中需要添加大量的N、P等营养成分[6-7],这在一定程度上增加了微藻的生产成本,限制了微藻产业的发展。近些年,随着养殖的集约化和规模化发展[8],大中型沼气工程也得到迅速推广,通过厌氧发酵将畜禽粪便转化为清洁能源沼气,但这些沼气工程在产生新能源沼气的同时也产生了大量的沼液得不到及时有效的利用和处理,沼液中含有丰富的营养成分,如N、P等以及大量的有机物质[9],如果不加处理直接排放,将会对环境造成严重破坏,因此如何妥善处理沼液已成为国内外学者的研究热点。而沼液中富含的N、P等营养成分可以较好地满足微藻生长的需要,微藻可吸收沼液中的这些营养成分,以满足自身的生长发育[10-12],利用沼液培养微藻不仅节约微藻的生产成本,而且还可净化沼液中的污染物,具有良好的社会效益和经济效益[13-15]。然而沼气发酵原料的种类繁多,采用不同原料发酵得到的沼液成分也存在较大差异,以鸡粪沼液为例,由于鸡的消化道较短,对饲料的利用率较低,与畜类相比,鸡粪中含有的营养成分更加丰富,特别是粗蛋白,与此同时鸡粪中也含有一定量的添加剂等成分,这些特性对鸡粪厌氧发酵后的沼液成分产生很大影响[16-17],因此利用鸡粪沼液培养微藻存在较大的不确定性,所以在前期研究中很多学者[18-19]均是将沼液灭菌后再进行微藻的养殖试验,进而增加了微藻养殖成本,影响微藻养殖产业的后续应用和推广。此外目前很多利用沼液培养微藻的研究还停留在批量培养阶段,利用沼液半连续培养微藻的系统性研究较少。
此外目前的大中型沼气工程普遍使用的是55 ℃的高温厌氧发酵和35 ℃的中温厌氧发酵工艺,55 ℃的高温厌氧发酵工艺与35 ℃的中温厌氧发酵工艺相比,不仅对厌氧发酵过程影响显著,而且由于高温厌氧发酵灭菌效果更为明显,所以对经过厌氧发酵后的沼液特性也有显著影响,据相关文献[20-21]报道经55 ℃高温厌氧发酵后获得的沼液中的各种病原菌的数量均明显低于35 ℃中温厌氧发酵。所以中温厌氧发酵和高温厌氧发酵后沼液作为微藻培养的营养液,势必会对后续的微藻生长形成一定的影响。而目前关于利用沼液培养微藻的相关研究所使用的沼液不是采用中温发酵沼液就是没有交代沼液的发酵条件,对于利用高温发酵沼液用于微藻培养的报道更为少见,关于利用中温和高温发酵沼液培养微藻的系统性研究鲜见报道。
因此本试验针对以上问题,以鸡粪中温35 ℃和高温55 ℃厌氧发酵后的沼液为原料,在半连续培养条件下,通过对培养过程微藻培养液中OD680、氨氮、总氮和总磷指标的检测,系统研究未灭菌的中温和高温厌氧发酵鸡粪沼液用于微藻半连续培养的可行性及较优的沼液添加比例。
1 材料与方法
1.1 试验材料
1.1.1 沼液及预处理
试验所使用的沼液来自东北农业大学生物质能源实验室,以鸡粪为沼气发酵的原料,沼气厌氧发酵的温度分别为中温35 ℃和高温55℃,发酵时间均为45 d,用孔径为0.075 mm尼龙标准筛去除沼气发酵后剩余物中的大颗粒物,然后利用高速离心机(Sigma 3-30K)在10 000 r/min下离心10 min去除小颗粒物获得本试验所用沼液,之后将沼液储存于4 ℃冰箱内备用。经过固液分离及离心处理后,35 ℃中温厌氧发酵沼液总氮质量浓度为2 417.625 mg/L,氨氮质量浓度为2 218.273 mg/L,总磷质量浓度为16.914 mg/L,化学需氧量(COD)为10 021.82 mg/L,pH值为8.25,浊度为698 NTU,黏度为2.68 mPa·s。55℃高温发酵沼液总氮质量浓度为2 554.372 mg/L,氨氮质量浓度为2 376.24 mg/L,化学需氧量(COD)为10 104.13 mg/L,总磷质量浓度为13.448 mg/L,pH值为8.18,浊度为653 NTU,黏度为2.52 mPa·s。
1.1.2 藻种
本试验以微藻能源化利用过程中研究较多的小球藻为研究对象[22-23],选取蛋白核小球藻()与普通小球藻()作为试验藻种,2种藻种均来自中国科学院水生生物研究所,藻种编号分别为FACHB-5(5号藻种,No.5)和FACHB-8(8号藻种,No.8)。
1.2 试验方法及条件
先将体积分数10%的沼液加入到BG11培养基中进行藻种驯化,待小球藻达到生长对数期后,加入BG11培养基补充到试验初始时的体积(即700 mL),间隔1 d后正式开始半连续培养,每天的更新率均为微藻培养液总体积的10%,由于本研究是中温35 ℃和高温55 ℃厌氧发酵后沼液进行微藻培养对比的初步研究,并且在对比不同沼液对微藻培养影响的同时,也分析了不同藻种在不同沼液中的生长状况,所以作者在前期预试验的基础上选择了10%、20%和30% 3个比较有代表性的试验梯度,试验时将体积分数10%、20%和30%的沼液与蒸馏水混合作为每天更新的培养液使用。使用人工气候培养箱(OBY-Q600-SEI,常州欧邦电子有限公司)培养微藻,在温度为(26±1)℃,光照强度为4 000 lx,光照时间采用目前应用较多的24 h连续光照[24-25],同时使用旋涡式气泵(HG-180,台湾亚士霸电机集团有限公司)向培养液持续通入空气,通气量设定为1.5 L/min,在空气进入培养液前使用0.2m 滤膜进行过滤。
该试验使用1 000 mL的三角瓶作为小球藻培养的容器,培养液的体积设置为700 mL,分别由70 mL沼液、560 mL BG11培养基和在不调节pH值条件下达到生长对数期的70 mL藻种组成,每组有2个重复,先进行藻种驯化,之后开始半连续培养,驯化和半连续培养周期均为10 d,每天进行更新取样,直接测OD680,样品在10 000 r/min 条件下离心取上清液,经0.45m 滤膜过滤后测定其中的总氮、氨氮和总磷质量浓度。
1.3 成分指标测定
采用光密度法测定生物量[26],光密度法:取出小球藻藻液,在680 nm吸收波长下用紫外可见分光光度计(T6 新世纪北京普析通用仪器有限责任公司)测定其光密度OD680[27],以此确定小球藻在半连续培养过程中的相对生长量。总磷和氨氮使用荷兰SKALAR连续流动分析仪测定[28-29]。总氮测定采用凯氏定氮法(Kjeldahl method)测定,参照GB11891-89《水中凯氏氮的测定法》[30]。采用Origin 8.5进行数据处理;采用SPSS V20进行差异显著性分析。
2 结果与分析
2.1 小球藻生长变化
图1为中温和高温厌氧发酵沼液用于小球藻培养时小球藻的生长曲线。
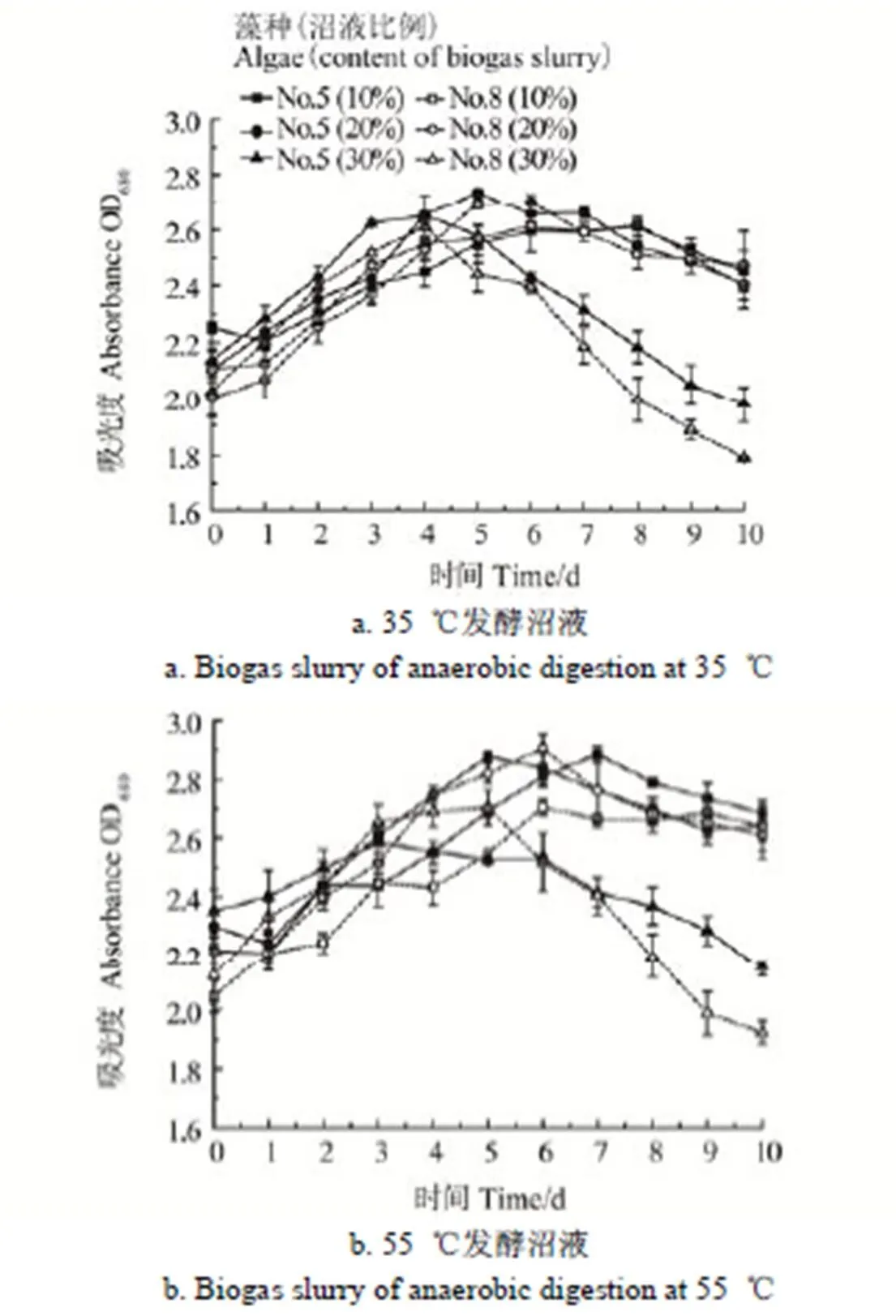
图1 小球藻的生长曲线
图1a为2种藻种在半连续培养环境下添加不同比例中温厌氧发酵沼液的生长曲线。从图1a中可以看出,在半连续培养环境下,当沼液添加比例在10%~30%范围内5号藻种和8号藻种在前4 d均未受到明显的抑制,而且除了添加比例为10%的2个试验组在第1天没有明显变化外,6个试验组在前4 d的整体变化趋势相一致,OD值均呈现明显上升的趋势,这与之前的批式试验[22]的结果存在较大的差异,前期的批式试验过程发现在试验的前2 d各试验组的OD值均没有明显的升高趋势,小球藻的生长均出现了明显的抑制作用,而在本试验的半连续试验过程未出现这一现象,这主要是由于批式培养时沼液是一次性加入,沼液添加量为总培养液体积的10%,20%和30%,对小球藻培养体系的冲击负荷较大,会在一定程度上对小球藻产生抑制作用。而本试验采用的是半连续培养的方式,每天培养液的更新率仅为10%,且这些10%培养液中仅有10%至30%为沼液,所以半连续培养时各试验组培养液中的沼液是从1%至3%逐渐增加,也就是沼液是逐渐加入,培养液中的沼液浓度是逐渐增加的,对小球藻生长的冲击相对较小,所以才会出现上述现象。从图1中还可以看出沼液添加比例为30%的2个试验组的OD值在第4天达到各自的最大值,之后开始迅速降低,这说明沼液添加比例为30%组随着试验的进行培养液中的沼液得不到及时有效地利用而发生积累并超出了小球藻的承受能力,进而对小球藻的生长产生明显的抑制作用。小球藻的生长之所以出现抑制,一方面是由于COD等有机物质的积累所导致,另一方面随着试验的进行,培养液浊度也逐渐增加,高浊度会影响光合有效辐射,从而抑制小球藻的生长,导致小球藻的生物量积累量下降[31]。而沼液添加比例为10%和20%各试验组的OD值分别在第6天和第5天达到各自的最大值,之后开始逐渐趋于稳定并略有下降,且试验后期10%和20%各试验组的OD值差别较小,这说明沼液添加比例为10%和20%时比较适宜小球藻的生长。从图1中还可以看出当沼液添加比例较低时2种藻种的生长未表现出明显的差别,但当沼液添加比例升高到30%时,在整个试验周期内5号藻种试验组的OD值始终高于8号藻种试验组,这说明2种藻种在低浓度的沼液培养基中均能较好地进行生长,但随着培养液中沼液浓度的增加,5号藻种的生长状况明显优于8号藻种,在对沼液的适应能力方面5号藻种略优。
图1b为2种藻种在半连续培养环境下添加不同比例高温厌氧发酵沼液的生长曲线。从图1b中可以看出,在半连续培养环境下,高温沼液各试验组的整体变化规律与图1a中温厌氧发酵沼液各试验组的趋势基本一致,即在试验前期各试验组的小球藻生长均未受到明显的抑制,试验的中后期添加比例较少的10%和20%各试验组的OD值逐渐趋于稳定,而添加比例较多的30%试验组的OD值出现明显的下降趋势,说明30%的添加比例不论对中温发酵沼液还是高温发酵沼液试验组均是一个小球藻很难适应的比例。从图1中还可以看出虽然中温沼液和高温沼液各试验组的OD值整体变化规律基本一致,但高温沼液各试验组的OD值的最高值略高于中温沼液各试验组,经显著性分析后差异达到极显著水平(<0.01),且添加比例较少的10%和20%各试验组的OD值稳定后也呈现出高温沼液组略高于中温沼液组,经显著性分析添加比例为10%的试验组差异达到显著水平(<0.05),添加比例为20%的试验组达到极显著水平(<0.01)。
2.2 小球藻培养液氨氮的变化
图2为中温和高温厌氧发酵沼液用于小球藻培养时培养液中氨氮质量浓度的变化情况。

图2 小球藻培养液氨氮质量浓度的变化
图2a为2种藻种在半连续培养环境下添加不同比例中温厌氧发酵沼液条件下培养液中氨氮的变化情况。从图2a中可以看出,沼液添加比例为10%和20%的4个试验组的氨氮变化规律基本一致,即在试验前期(前4 d)一直处于上升趋势,之后开始逐渐趋于稳定,最终其氨氮质量浓度分别维持在22和45 mg/L左右。当沼液添加比例为较高浓度的30%时,由于小球藻生长后期受到明显的抑制,因此在试验结束时氨氮的质量浓度较高,由试验开始时的0.38 mg/L上升到试验结束时的110.66 mg/L。在试验后5 d,8号藻种的氨氮质量浓度始终高于5号藻种,这与图1中小球藻的生长趋势相对应,在图1中当沼液添加比例为30%时,在试验的中后期小球藻的生长速率降低,且呈现出5号藻种试验组的小球藻生长状况略优于8号藻种的现象,这就导致对沼液中氨氮的利用量减少,使培养液中的氨氮浓度迅速升高,且在试验中后期呈现出5号藻种试验组的氨氮质量浓度低于8号藻种试验组的现象。
图2b为2种藻种在半连续培养环境下添加不同比例高温厌氧发酵沼液时培养液中氨氮的变化情况。从图2b中可以看出,高温厌氧发酵沼液各试验组的氨氮质量浓度的整体变化规律与中温厌氧发酵沼液各试验组基本一致,即当沼液添加比例为10%和20%较低水平时,随着试验的进行培养液的氨氮质量浓度先缓慢升高后便基本维持在各自较稳定的水平,而当沼液添加比例为30%的较高水平时,培养液的氨氮质量浓度随试验的进行始终处于上升趋势。此外对比图2a和2b还可以看出,当沼液的添加比例为20%时,中温发酵沼液试验组和高温发酵沼液组培养液中的氨氮质量浓度的变化规律略有差异,中温发酵沼液试验组和高温发酵沼液试验组相比,培养液中的氨氮质量浓度上升速度更快,且稳定后培养液中的氨氮质量浓度高于高温发酵沼液试验组,经显著性分析后差异达到显著水平(<0.05),这与图1中的小球藻生长曲线相对应。
2.3 小球藻培养液总氮的变化
图3为中温和高温厌氧发酵沼液用于小球藻培养时培养液中总氮浓度的变化情况。

图3 小球藻培养液总氮浓度的变化
图3a为2种藻种在半连续培养环境下添加不同比例中温厌氧发酵沼液条件下溶液中总氮的变化情况。从图3a可以看出,沼液添加比例为10%和20%的4个试验组的总氮变化规律基本相一致,即在试验前期(前4 d)一直处于上升趋势,之后逐渐趋向于稳定,最终其总氮质量浓度分别维持在30和60 mg/L左右。当沼液添加比例为30%时由于小球藻生长后期受到明显的抑制,因此在试验结束时总氮浓度较高,而且还有上升的趋势,其总氮质量浓度由试验开始时的3.22 mg/L上升到试验结束时的130.79 mg/L,在试验的后期,8号藻种的总氮浓度始终高于5号藻种,这与图1中小球藻的生长趋势相一致。
图3b为2种藻种在半连续培养环境下添加不同比例高温厌氧发酵沼液条件下溶液中总氮的变化情况,从图3b中可以看出,高温厌氧发酵沼液各试验组的总氮变化规律与中温厌氧发酵沼液各试验组基本一致。结合图2和图3 还可以看出总氮的变化规律和氨氮的变化规律基本一致,且培养液中总氮和氨氮质量浓度的差别也较小,这主要是由于厌氧发酵后的沼液中的氮素主要以氨氮的形式存在[32],并且在有氨氮存在的情况下小球藻将优先利用氨氮[27],所以才会出现上述现象。
2.4 小球藻培养液总磷的变化
图4为中温和高温厌氧发酵沼液用于小球藻培养时培养液中总磷浓度的变化情况。

图4 小球藻培养液总磷浓度的变化
图4a为2种藻种在半连续培养环境下添加不同比例中温厌氧发酵沼液时溶液中总磷的变化情况。从图4a中可以看出,当更新添加比例为10%和20%沼液时,4个试验组培养液中总磷均是先下降,然后最终趋向稳定,当试验结束时分别维持在0.25和0.55 mg/L,在试验未开始时培养液中总磷浓度较高,这是由于在前期驯化藻种结束后,加入BG11培养基补充驯化过程中损失的体积,从而增加了培养液总磷浓度。当更新添加比例为30%沼液时,培养液中总磷浓度先下降后上升,然后趋于稳定,总磷之所以出现这种趋势,一方面是沼液的添加比例较高,另一方面是小球藻的生长受到抑制,不能很好地吸收培养液中的磷。
图4b为2种藻种在半连续培养环境下添加不同比例高温厌氧发酵沼液条件下培养液中总磷的变化情况。从图4b中可以看出,高温厌氧发酵沼液试验组和中温厌氧发酵沼液试验组培养液中的总磷变化规律差别较大,当更新添加比例为10%和20%沼液时,4个试验组培养液中总磷的变化趋势相一致,均是先下降,然后最终趋向稳定,当试验结束时,4个试验组的总磷质量浓度均维持在0.25 mg/L的较低水平,这与图1中的小球藻生长情况相对应,当沼液添加比例为20%时,高温厌氧发酵沼液试验组的小球藻整体生长状况优于中温厌氧发酵沼液试验组,对培养液中磷的消耗量更大,所以才出现高温厌氧发酵沼液试验组沼液添加比例为20%时培养液中的磷质量浓度低于中温厌氧发酵沼液试验组的现象。当更新添加比例为30%沼液时,培养液中总磷的浓度先下降后趋于稳定,由试验开始的2.01 mg/L下降到试验结束时的1.13 mg/L,这低于中温厌氧发酵沼液试验组,这与图1中沼液添加比例30%时高温厌氧发酵沼液试验组的小球藻生长状况优于中温厌氧发酵沼液试验组的现象相对应。
3 讨 论
在半连续培养条件下,当更新的培养液中鸡粪沼液添加比例为较低的10%和20%时,5号和8号小球藻均能很好地适应各自的沼液培养环境并迅速生长,且呈现高温55 ℃厌氧发酵后的沼液用于小球藻半连续培养的整体表现优于中温35 ℃厌氧发酵后沼液,小球藻的生长速率更高。5号小球藻在中温10%试验组中,OD680由开始时的2.25上升到结束时的2.45,最高值达到2.61;中温20%试验组中,OD680由开始时的2.10上升到结束时的2.40,最高值达到2.74;在高温10%试验组中,OD680由开始时的2.21上升到结束时的2.69,最高值达到2.88;高温20%试验组中,OD680由开始时的2.30上升到结束时的2.64,最高值达到2.88。8号小球藻在中温10%试验组中,OD680由开始时的2.10上升到结束时的2.40,最高值达到2.61;中温20%试验组中,OD680由开始时的2.00上升到结束时的2.47,最高值达到2.70;在高温10%试验组中,OD680由开始时的2.05上升到结束时的2.64,最高值达到2.71;高温20%试验组中,OD680由开始时的2.21上升到结束时的2.61,最高值达到2.90。但当鸡粪沼液添加比例为30%时,在试验后期5号和8号小球藻的生长均受到抑制,5号小球藻比8号小球藻生长的更好,5号小球藻与8号小球藻相比对高浓度沼液培养环境的适应能力更强。5号小球藻在中温30%试验组中,OD680由开始时的2.14下降到结束时的1.98,在第4天最高值达到2.65,5号小球藻在高温30%试验组中,OD680由开始时的2.35下降到结束时的2.15,在第4天最高值达到2.55;8号小球藻在中温30%试验组中,OD680由开始时的2.02下降到结束时的1.79,在第4天最高值达到2.61,8号小球藻在高温30%试验组中,OD680由开始时的2.12下降到结束时的1.92,在第5天最高值达到2.71。
在本试验中,各个试验组均不同程度出现了小球藻的生长抑制点,先前有研究[33]发现对于藻类当培养液中氮磷比大于20时,具有磷限制性。通过分析本试验数据后发现,在试验过程中各试验组的氮磷比均呈现逐渐升高的趋势,其中沼液添加比例为10%和20%试验组的氮磷比由试验开始时的10以下逐渐升高到试验中后期的200和83,而2个试验组的微藻生长规律则均呈现试验前期生长速率较快,试验中后期基本维持稳定的趋势。而沼液添加比例为30%试验组的氮磷比由试验开始时的10以下逐渐升高到试验中后期的65,微藻生长规律则呈现试验前期生长速率较快,试验中后期微藻的生长速率逐渐下降的趋势。即沼液添加比例为10%和20%试验组的氮磷比虽然始终处于逐渐升高的趋势,且试验结束时氮磷比处于较高水平(氮磷比为200和83),但微藻的整体生长水平却始终维持在较高水平,而沼液添加比例为30%试验组的氮磷比虽然也始终处于逐渐升高的趋势,且试验中后期氮磷比不是很高(氮磷比为65),但却对试验中后期微藻的生长产生较大的抑制作用,所以作者认为在本研究中氮磷比不是影响微藻生长的主要原因,作者认为30%试验组试验中后期微藻生长受到抑制主要是由于培养液中的氮素浓度相对较高,以及培养液的浊度较大影响光照等原因所致。
4 结 论
1)半连续培养条件下,当更新的培养液中厌氧发酵鸡粪沼液添加比例为10%和20%时,5号和8号小球藻均能很好地适应各自的沼液培养环境并迅速生长;试验结束时,各试验组的吸光度(OD680)值均维持在2.40至2.69,各试验组的OD680最大值均维持在2.61至2.90。但当鸡粪沼液添加比例为30%时,在试验后期5和8号小球藻的生长均受到抑制,5号小球藻比8号小球藻生长的更好,试验结束时, 5号小球藻试验组的OD680值维持在1.98至2.15,8号小球藻试验组的OD680值维持在1.79至1.92,5号小球藻与8号小球藻相比对高浓度沼液培养环境的适应能力更强。
2)高温55 ℃厌氧发酵后的沼液用于小球藻半连续培养的整体表现优于中温35 ℃厌氧发酵后沼液,高温沼液各试验组的OD680值均高于各自对应的中温沼液各试验组0.13以上,在高温沼液的培养液中小球藻生长速率更高。
[1] Pienkos P T, Darzins A. The promise and challenges of microalgal-derived biofuels[J]. Biofuels Bioprod Bioref, 2009, 3(4): 431-440.
[2] Gustavo B Leite, Ahmed E M Abdelaziz, Patrick C Hallenbeck. Algal biofuels: Challenges and opportunities[J]. Bioresource Technology, 2013, 145: 134-141.
[3] Chiu Shengyi, Kao Chienya, Chen Tsaiyu, et al. Cultivation of microalgal Chlorella for biomass and lipid production using wastewater as nutrient resource[J]. Bioresource Technology, 2015, 184: 179-189.
[4] Li Y, Horsman M, Wu N, et al. Biofuels from microalgae[J]. Biotechnology progress, 2008, 24(4): 815-820.
[5] Trivedi J, Aila M, Bangwal D P, et al. Algae based biorefinery-How to make sense[J]. Renewable and Sustainable Energy Reviews, 2015, 47: 295-307.
[6] Racharaks Ratanachat, Ge Xumeng, Li Yebo. Cultivation of marine microalgae using shale gas flowback water and anaerobic digestion effluent as the cultivation medium[J]. Bioresource Technology, 2015, 191: 146-156.
[7] Logan Christenson, Ronald Sims. Production and harvesting of microalgae for wastewater treatment, biofuels and bioproducts[J]. Biotechnology Advances, 2011, 29: 686-702.
[8] Sakar S, Yetilmezsoy K, Kocak E.Anaerobic digestion technology in poultry and livestock waste treatment:A literature review[J].Waste Management and Research, 2009, 27(1):3-18.
[9] 沈其林,单胜道,周健驹,等.猪粪发酵沼液成分测定与分析[J].中国沼气,2014,32(3):83-86. Shen Qilin, Shan Shengdao, Zhou Jianju, et al. Determination and analysis of compositions in biogas slurry produced by swine manure digestion[J]. China Biogas, 2014, 32(3): 83-86. (in Chinese with English abstract)
[10] Ashish K Sahu, Jon Siljudalen, Tina Trydal, et al. Utilisation of wastewater nutrients for microalgae growth for anaerobic co-digestion[J]. Journal of Environment Management, 2013, 122: 113-120.
[11] Cai Ting, Park Stephen Y, Racharaks Ratanachat, et al. Cultivation ofusing anaerobic digestion effluent as a nutrient source for biofuel production[J]. Applied Energy, 2013, 108: 486-492.
[12] Lam M K, Lee K T. Potential of using organic fertilizer to cultivate Chlorella vulgaris for biodiesel production[J]. Applied Energy, 2012, 94: 303-308.
[13] Xin M, Yang J M, Xu X, et al. Biodiesel production from oleaginous micro organizations[J]. Renewable Energy, 2008, 34(1): 1-5.
[14] Codes I, Baul M, Benoit G. Tetracycline removal during wastewater treatment in high-rate algal ponds[J]. Journal of Hazardous Materials, 2012, 229: 446-449.
[15] Ji Fang, Zhou Yuguang, Pang Aiping, et al. Fed-batch cultivation of. in anaerobic digestion wastewater for improved nutrient removal and biodiesel production[J]. Bioresource Technology, 2015, 184: 116-122.
[16] 王峰,严潇南,杨海真.鸡粪厌氧发酵沼液达标处理工艺研究[J].农业机械学报,2012,43(5):84-90. Wang Feng, Yan Xiaonan, Yang Haizhen. Treatment process of anaerobically digested effluent of chicken manure for meeting the discharging standard[J]. Transactions of the Chinese Society for Agricultural Machinery, 2012, 43(5): 84-90. (in Chinese with English abstract)
[17] Singh M, Reynolds D L, Das K C. Microalgal system for treatment of effluent from poultry litter anaerobic digestion[J]. Bioresource Technology, 2011, 102(23): 10841-10848.
[18] 王钦琪,李环,王翠,等.沼液培养的普通小球藻对CO2的去除[J].应用与环境生物学报,2011,17(5):700-705. Wang Qinqi, Li Huan, Wang Cui, et al. Reduction of CO2by Chlorella vulgaris cultured in biogas slurry[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17 (5): 700-705. (in Chinese with English abstract)
[19] 王翠,李环,韦萍.沼液培养小球藻生产油脂的研究[J].环境工程学报,2010,4(8):1753-1758. Wang Cui, Li Huan, Wei Ping. Study on microbial oil production with chlorella cultured in biogas slurry[J]. Chinese Journal of Environmental Engineering, 2010, 4(8): 1753-1758. (in Chinese with English abstract)
[20] 李明,魏晓明,耿如林,等.沼气发酵温度对沼液粪大肠杆菌群去除效果的研究[J].农机化研究,2015(5):246-249. Li Ming, Wei Xiaoming, Geng Rulin, et al. Effects of anaerobic fermentation temperature on extermination of fecal coliform in biogas effluent[J]. Journal of Agricultural Mechanization Research, 2015(5): 246-249. (in Chinese with English abstract)
[21] 许智,叶小梅,常志州,等.温度对厨余垃圾和人粪尿污水混合液的水解酸化影响[J].中国沼气,2011,29(3):9-12. Xu Zhi, Ye Xiaomei, Chang Zhizhou, et al. Temperature influence on hydrolysis and acidogenesis of kitchen and toilet waste mixture[J]. China Biogas, 2011, 29(3): 9-12. (in Chinese with English abstract)
[22] 王忠江,隋超,王泽宇,等.小球藻对不同沼液添加量培养液的适应性及净化效果[J].农业工程学报,2017,33(3):221-226. Wang Zhongjiang, Sui Chao, Wang Zeyu, et al. Adaptation of chlorella to culture liquid with different biogas slurry adding proportion and its purified effect[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE), 2017, 33(3): 221-226.(in Chinese with English abstract)
[23] 周连宁,王波,吴锋,等.培养条件对小球藻生长及油脂积累的影响研究[J].生物学杂志,2015,32(3):46-60. Zhou Lianning, Wang Bo, Wu Feng, et al. The impact of different culture conditions on the chlorella’s growth and fat accumulation[J]. Biology Journal, 2015, 32(3): 46-60.(in Chinese with English abstract)
[24] 李岩,周文广,张晓东,等.微藻培养技术处理猪粪厌氧发酵废水效果[J].农业工程学报,2011,27(增刊1):101-104. Li Yan, Zhou Wenguang, Zhang Xiaodong, et al. Effect of microalgae culture on treatment of wastewater from anaerobic digested swine manure [J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(Supp.1): 101-104. (in Chinese with English abstract)
[25] Fen Tan, Zhi Wang, Siyu Zhouyang, et al. Nitrogen and phosphorus removal coupled with carbohydrate production by five microalgae cultures cultivated in biogas slurry[J]. Bioresource Technology, 2016, 221: 385-393.
[26] II-Seung Yang, EI-Sayed Salama, Jong-Oh Kimet, et al. Cultivation and harvesting of microalgae in photobioreactor for biodiesel production and simultaneous nutrient removal[J]. Energy Conversion and Management, 2016, 117: 54-62.
[27] 霍书豪,陈玉碧,刘宇鹏,等.添加沼液的BG11营养液微藻培养试验[J].农业工程学报,2012,28(8):241-246. Huo Shuhao, Chen Yubi, Liu Yupeng, et al. Experiment on microalgae cultivation in BG11 nutrient solution adding biogas slurry[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(8): 241-246. (in Chinese with English abstract)
[28] 刘倩.连续流动分析仪法同时测定污水中总氮、氨氮、亚硝酸盐氮、硝酸盐氮[J].工业水处理,2009,29(8):72-74. Liu Qian. Simultaneous determination of the total nitrogen, ammonium-nitrogen, nitrite-nitrogen, and nitrate-nitrogen in wastewater by continuous fluxion analysis[J]. Industrial Water Treatment, 2009, 29(8): 72-74.(in Chinese with English abstract)
[29] 夏倩,刘凌,王流通,等.连续流动分析仪在水质分析中的应用[J].分析仪器,2012(2):64-68. Xia Qian, Liu Ling, Wang Liutong, et al. Application of continuous flow analyzer in water analysis[J]. Analytical Instruments, 2012(2): 64-68.(in Chinese with English abstract)
[30] 杨珺,张效苏,吴忠祥,等.水质凯氏氮标准样品的研究[J].环境监测管理与技术,2002,14(1):14-19. Yang Jun, Zhang Xiaosu, Wu Zhongxiang, et al. Research about standard samples of water quality-determination of Kjeldahl nitrogen[J]. Environmental Monitoring Management and Technology, 2002, 14(1): 14-19.(in Chinese with English abstract)
[31] Wang L, Li Y, Chen P, et al. Anaerobic digested dairy manure as a nutrient supplement for cultivation of oil-rich green microalgae Chlorella sp[J]. Bioresource Technology, 2010, 101(8): 2623-2628.
[32] Yang Anqi, Zhang Guangming, Yang Guang, et al. Denitrification of aging biogas slurry from livestock farm by photosynthetic bacteria[J]. Bioresource Technology, 2017, 232: 408-411.
[33] Facundo J M, Nishio N, Nagai S, et al. Enhancement of biomass and pigment production during growth of Spirulina platensis in mixotrophic culture[J]. Journal of Chemical Technology and Biotechnology, 1995, 62(2): 159-164.
Effect of biogas slurry of medium and high temperature digestion on growth of chlorella with semi-continuous culture
Wang Zhongjiang1,2, Si Ailong1, Liu Zhuo1, Li Ze1, Wang Lili1, Wang Guixiang1
(1.,,150030,; 2.,150030,)
The experimental Chlorella ofFACHB-5 andFACHB-8 was cultured in a 1 000 mL Erlenmeyer flask with 700 mL nutrient solution in an artificial climate incubator. The culture temperature, illuminance, airflow rate and continuous illumination time were (26±1) ℃, 4 000 lx, 1.5 L/min and 24 h, respectively. The biogas slurry of chicken manure achieved after anaerobic digestion at medium temperature (35 ℃) and high temperature (55 ℃) for 45 d was used as nutrient source for Chlorella culture. The main compositions and characteristics of biogas slurry digested at 35 and 55 ℃ were 2 417.63 and 2 554.37 mg/L for total nitrogen, 2 218.27 and 2 376.24 mg/L for ammonium nitrogen, 16.91 and 13.44 mg/L for total phosphorus, 10 021.82 and 10 104.13 mg/L for chemical oxygen demand (COD), 8.25 and 8.18 for pH value, 698 and 653 NTU for turbidity, and 2.68 and 2.52 mPa·s for viscosity, respectively. The semi-continuous culture ofwas realized by discharging nutrient solution of 10% and adding new nutrient solution of 10% at the same time daily. Furthermore, the addition ratios of unsterilized biogas slurry in daily new nutrient solution were 10%, 20% and 30%, respectively. Effects of 3 different addition ratios of unsterilized biogas slurry digested at 35 and 55 ℃ on the semi-continuous culture of Chlorella were studied systematically based on the analysis of nutrient solution during Chlorella culture including OD680, total nitrogen, ammonium nitrogen, total phosphorus, and so on. The results showed that theFACHB-5 andFACHB-8 could adapt the culture environment well and grow rapidly when the addition ratios of unsterilized biogas slurry in daily new nutrient solution were 10% and 20%. Furthermore, the OD680values of 2 types ofwere maintained at 2.40-2.69 at the end ofculture for 10 d. However, the growth of FACHB-5 and FACHB-8 in the later period of culture experiment was restrained significantly when the addition ratio of unsterilized biogas slurry in daily new nutrient solution was 30%. Furthermore, the growth rates and adaptive capacity of FACHB-5 in the nutrient solution containing more biogas slurry were better than that of FACHB-8. A similar fluctuation trend was achieved in OD680of different comparative samples with biogas slurry addition. However, the OD680values of comparative samples with 55 ℃ digestive biogas slurry were over 0.13 higher than that of comparative samples with 35 ℃ digestive biogas slurry, especially for the comparative samples with biogas slurry of 10% and 20% addition ratios. Moreover, the OD680values of FACHB-5 and FACHB-8 were maintained at 1.98-2.15 and 1.79-1.92 at the end of Chlorella culture for 10 d, respectively. Therefore, the effects of biogas slurry digested at 55 ℃ on semi-continuous culture of Chlorella were superior than that of biogas slurry digested at 35 ℃. The results supply references for the theoretical research and subsequent large-scale application of Chlorella culture using biogas slurry digested at different temperatures.
fermentation; growth; biogas slurry; chlorella; semi-continuous culture; appending proportion
10.11975/j.issn.1002-6819.2018.18.029
Q938
A
1002-6819(2018)-18-0235-07
2018-04-22
2018-08-07
国家高技术研究发展计划(2014AA022001);国家自然科学基金(51406032);教育部留学回国人员科研启动基金(20131792);中央引导地方科技发展专项项目(ZY17C05)联合资助
王忠江,教授,博士,主要从事农业生物环境与能源工程领域研究。E-mail:neauwzj@126.com
王忠江,司爱龙,刘 卓,李 泽,王丽丽,王贵祥. 中温和高温发酵沼液营养源对半连续培养小球藻生长的影响[J]. 农业工程学报,2018,34(18):235-241. doi:10.11975/j.issn.1002-6819.2018.18.029 http://www.tcsae.org
Wang Zhongjiang, Si Ailong, Liu Zhuo, Li Ze, Wang Lili, Wang Guixiang. Effect of biogas slurry of medium and high temperature digestion on growth of chlorella with semi-continuous culture[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(18): 235-241. (in Chinese with English abstract) doi: 10.11975/j.issn.1002-6819.2018.18.029 http://www.tcsae.org

