上海青浦地区2016—2017年高龄人群血清胃蛋白酶原Ⅰ、Ⅱ的筛选试验
陆林其,计雪萍,任丽萍,浦海峰
(上海复旦大学中山医院青浦分院 体检中心,上海,201700)
胃癌的病因复杂,受多种遗传因素、环境因素和诱发因素的影响[1-2]。在这些诱发因素中,慢性萎缩性胃炎、肠上皮化生和肠发育不良已经被确认为胃癌的癌前病变,是所有胃癌类型中最常见的一种。血清胃蛋白酶原Ⅰ (PG-Ⅰ)和胃蛋白酶原Ⅰ/Ⅱ比值(PGR)是筛选萎缩性胃炎的生物标志物。研究[3-4]表明,先采用胃蛋白酶原测试筛查健康人,再采用胃镜检查和活检对早期胃癌的发现是非常有效的。早期胃癌患者通常无症状,并且手术切除后的5年生存率可达80%以上[5-9]。本研究探讨PG-Ⅰ和PGR的2年连续测试的适用性,以及其在减少不必要的胃镜检查中的作用,现报告如下。
1 资料与方法
1.1 一般资料
选取上海青浦地区的7 274名普通参与者,年龄50~92岁,平均(63.5±18.1)岁;男3 470名,女3 804名。本研究方案经上海市青浦区卫计委审查委员会批准。
1.2 血清胃蛋白酶原测定
血清PG-Ⅰ和血清胃蛋白酶原Ⅱ(PG-Ⅱ)采用酶联免疫吸附试验(ELISA)测定。PG-Ⅰ和PG-Ⅱ的ELISA测试使用2个特定的与PG-Ⅰ或PG-Ⅱ成对单克隆抗体。PG-Ⅰ ELISA与PG-Ⅱ和胃蛋白酶没有交叉反应,且PG-Ⅱ ELISA与PG-Ⅰ没有交叉反应。测定校准器,控制和稀释血清样本,直接用于链霉亲和素涂微量滴定板。生物素化的抗体和辣根过氧化物酶共轭添加示踪抗体免疫测定反应。在整个测定过程中只有1个板清洗步骤,PG-Ⅰ总培养时间是1 h 20 min,PG-Ⅱ为2 h 20 min。为分析性能,分析敏感性定为0.1、0.5 ng/mL,测量动态范围为65~295 ng/mL。
血清PG-Ⅰ水平低于25 ng/mL提示可能出现萎缩性慢性胃炎,并认为是阳性结果。PG-Ⅰ水平>120 ng/mL及(或)PG-Ⅱ≥23 ng/mL提示可能的浅表胃炎对胃黏膜的损害。PGR低于3.1,PG-Ⅰ水平<41 ng/mL或PG-Ⅱ<25 ng/mL,被认为是胃蛋白酶原检测结果阳性,并作为胃镜检查的另一个指标。
1.3 其他测试
1.3.1 血清幽门螺杆菌抗体测试: 采用ELISA法测定。采用化学发光免疫测定法测定肿瘤糖类抗原242(CA242)、糖类抗原72-4(CA72-4)、糖类抗原CA19-9(CA19-9)、癌胚抗原(CEA)等与癌症相关的生物标志物。进行13C呼吸试验。
1.3.2 活检标本的胃镜检查和组织病理学检查: 对于PG-Ⅰ和PGR测定结果为阳性的患者,建议采用胃镜检查和活检。采用Olympus GIF-HQ 290进行胃镜检查和活检,每份活检标本要在内镜下从不同颜色、不同性质的区域选取5块以上的样本,或是在未观察到病变的情况下随机从胃窦、胃切迹、胃底选取样本。标本应由2名有执照的病理学医师独立评估。
1.4 统计学分析
采用SPSS 9.0 Package Facility进行数据分析。非参数检验用于评估基于胃蛋白酶原水平的不同组间的差异。
2 结 果
2.1 2016年的血清PG-Ⅰ、PG-Ⅱ和PGR水平
2016年,共有464名受试者符合胃镜检查的标准,其中男217名,女247名。需要胃镜随访的受试者占受试者总数的6.8%。有338名受试者(69.0%)PG-Ⅰ<25 ng/mL,154名受试者(31.0%)PG-Ⅰ水平在25~41 ng/mL,而PGR<3.1。有207名受试者(42%)PG-Ⅰ<25 ng/mL,PGR<3.1。其余131名受试者(27.0%)的PG-Ⅰ<25 ng/mL,但PGR≥3.1。见图1。
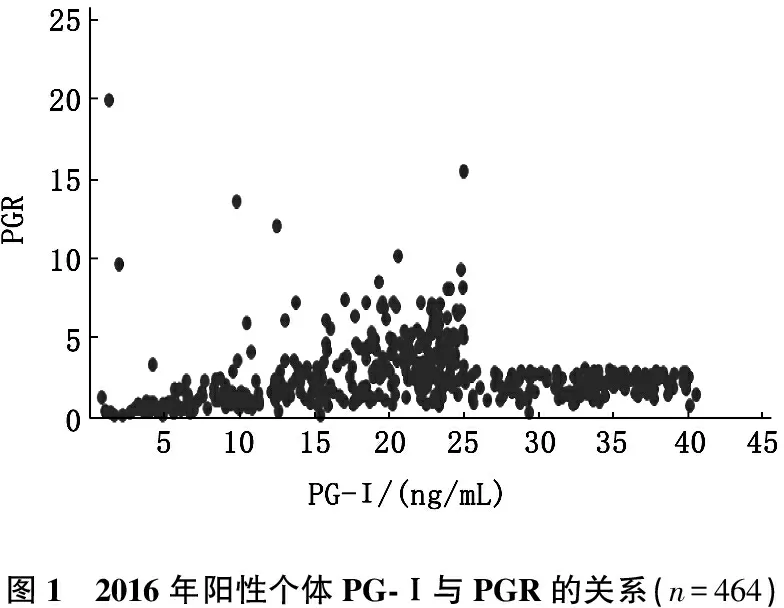
图1 2016年阳性个体PG-Ⅰ与PGR的关系(n=464)
2.2 2017年血清PG-Ⅰ、PG-Ⅱ和PGR水平
2017年,共有636名受试者符合胃镜检查的标准,其中男317名,女319名。需要胃镜检查的受试者占总参与者的8.7%。586名(92.1%)受试者PG-Ⅰ<25 ng/mL。50名(7.9%)受试者PG-Ⅰ在25~41 ng/mL,PGR<3.1。此外,221名(34.8%)受试者的PG-Ⅰ<25 ng/mL,PGR<3.1。见图2。进一步分析表明,257名个体在2年内胃蛋白酶原测试结果都为阳性,总共有464个阳性的受试者,占总体的58.0%。
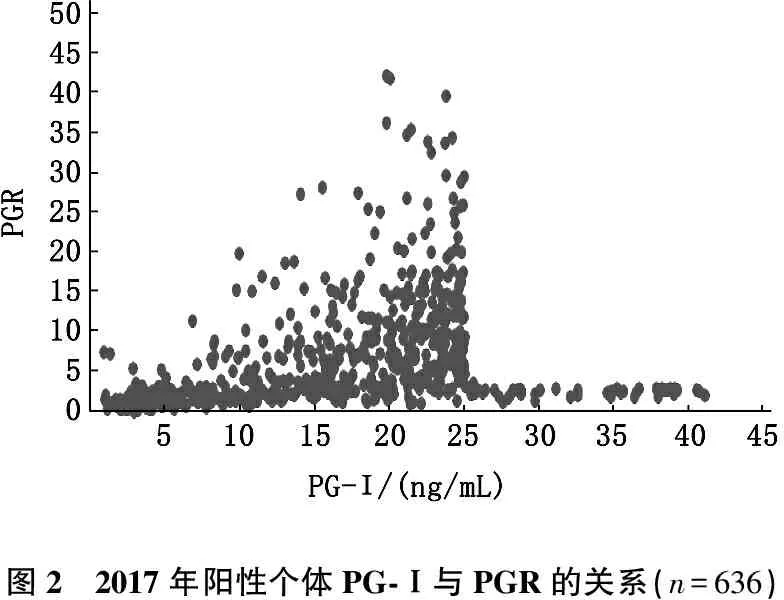
图2 2017年阳性个体PG-Ⅰ与PGR的关系(n=636)
2.3 2016、2017年胃蛋白酶原试验结果分析
共有780名阳性个体需要胃镜检查,在7 274名参与者中,综合阳性率为10.7%。为了比较2016、2017年的胃蛋白酶原测试阳性结果,所有阳性的受试者在基于2016年的PG-Ⅰ测试结果上被分为4组。A组的PG-Ⅰ水平<12 ng/mL,被认为是强阳性;B组为阳性结果,PG-Ⅰ水平12~18 ng/mL;C组以PG-Ⅰ水平>18~25 ng/mL为轻度阳性;D组为受试者PG-Ⅰ测试结果模糊,该测试结果>25~<41 ng/mL,PGR<3.1。4组资料见表1。在2016年中,A组95.6%受试者PGR<3.1,而B、C组的PGR阳性率分别为72.1%、28.9%,均显著低于A组(P<0.01)。

表1 4组2016、2017年胃蛋白酶原检测结果比较
与2016年比较,**P<0.01。
2.4 4组血清PG-Ⅰ、PG-Ⅱ与PGR水平的关系
2017年,A组PG-Ⅰ阳性受试者的PG-Ⅰ水平依旧保持阳性,其中93.3%(84/90)的受试者PG-Ⅰ水平低于12 ng/mL。对于PG-Ⅰ水平超过12 ng/mL的6个受试者,其水平仍低于20 ng/mL。A组2017年PGR阳性率为76.7%,显著低于2016年95.6%(P<0.05)。B组69.1%的受试者PG-Ⅰ水平低于25 ng/mL,48.5%(33/68)的水平低于18 ng/mL。15名(22.1%)受试者的PG-Ⅰ水平下降到12 ng/mL以下。与2016年相比,PGR阳性率显著降低至25.0% (P<0.01)。C组34.3%(57/166)患者的PG-Ⅰ水平始终低于25 ng/mL。此外,7.2%(12/166)的受试者PG-Ⅰ水平低于18 ng/mL,5名受试者下降到12 ng/mL以下。PGR阳性率显著下降至4.8%(8/166)(P<0.01)。D组70.0%的受试者(98/140)保持PG-Ⅰ水平低于41 ng/mL,而25名(17.9%)受试者PG-Ⅰ水平下降到25 ng/mL以下。27名受试者(19.3%)的PGR低于3.1。见图3。
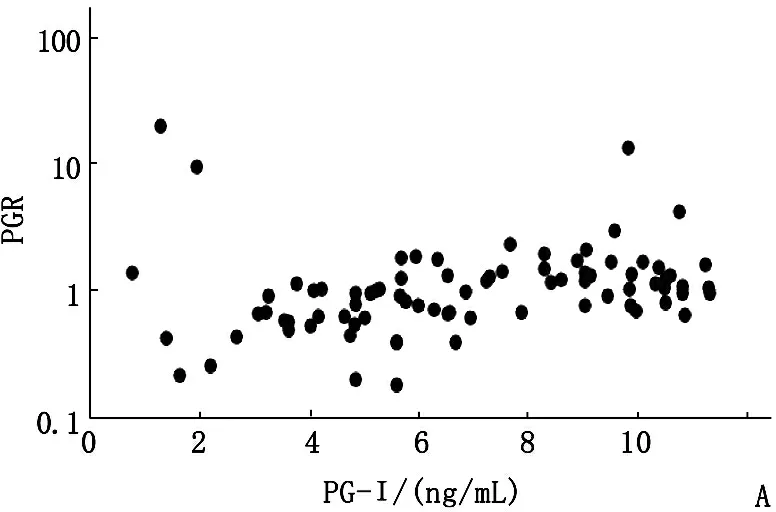
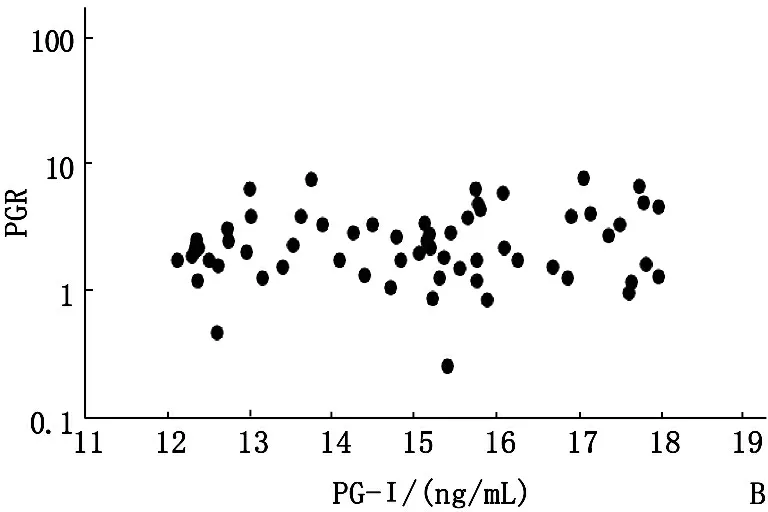
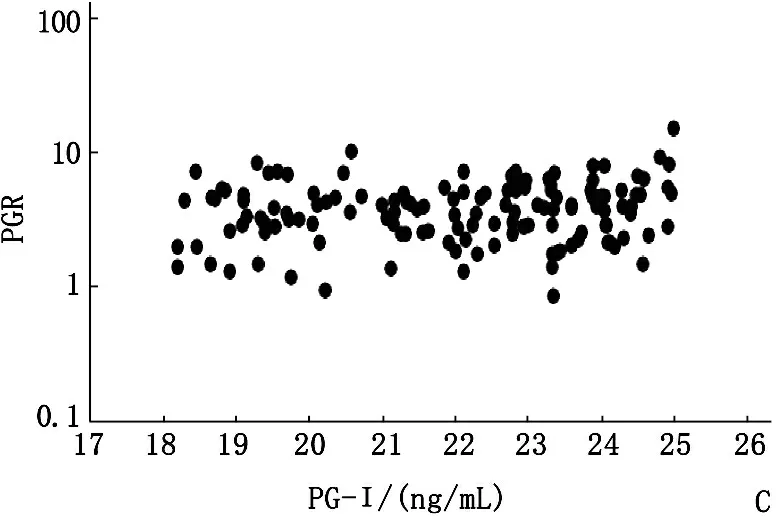
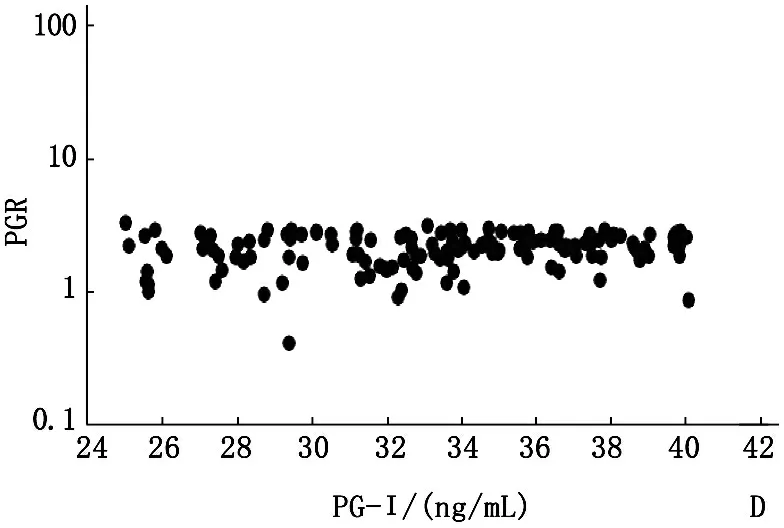
A: PG-Ⅰ<12 ng/mL,n=90;B: PG-Ⅰ12~18 ng/mL,n=68;C: PG-Ⅰ>18~25 ng/mL,n=166;D: PG-Ⅰ>25~<41 ng/mL,n=140
图34组PG-Ⅰ与PGR水平的关系
与胃蛋白酶原相比,其他生物标志物测试的阳性率有限。CA125阳性1例,CA242阳性7例,CA72-4阳性9例,CA19-9阳性2例,CEA阳性10例。13C呼气测试显示180名受试者(28%)为阳性。本研究中,16个胃蛋白酶原试验阳性的受试者接受胃镜检查。除6例慢性萎缩性胃炎和3例肠化生外,还发现1例良性胃腺瘤和6例胃腺癌。在6例胃腺癌患者中,5例为早期阶段(Ia期),1例为Ⅱ期。这6例癌症患者中,4例PG-Ⅰ水平低于18 ng/mL,另2例为19.2 ng/mL,只有1例患者表现为PGR<3.1,同时CA 242和CEA呈弱阳性,但CA 19-9、CA 72-4阴性。
3 讨 论
胃蛋白酶原是一组由胃蛋白酶原Ⅰ(PG-Ⅰ)和胃蛋白酶原Ⅱ (PG-Ⅱ)组成的蛋白质,它们都是由位于胃体和胃底的基底细胞以及颈黏液细胞产生的[10-14]。此外,在近端十二指肠的小肠腺和肛门的幽门腺中也产生PG-Ⅱ。胃蛋白酶原是一种酶,是胃蛋白酶的前体,是胃液中与食物消化有关的一种蛋白酶[15-16]。循环中胃蛋白酶原水平反映胃腺的分泌功能,特别是颈黏液细胞和主细胞;同时循环中胃蛋白酶原水平还依赖于胃底黏膜上皮细胞的完整性[17]。
本研究表明,具有强阳性PG-Ⅰ水平(A组,PG-Ⅰ<25 ng/mL)的个体,在2016、2017年测试中均有一致的胃蛋白酶原测试结果。这类人群可能患有严重的萎缩性慢性胃炎或肠上皮化生,并有很高的罹患胃癌的风险。Samloff等[18]研究发现胃蛋白酶原Ⅰ、Ⅱ与胃黏膜相关,并将胃蛋白酶酶原的测试命名为血清胃黏膜活检。Urita等[19]报道,低PG-Ⅰ水平和低PGR水平在肠上皮化生的患者中很常见。Kawai等[20]报道成功根除幽门螺杆菌后,血清胃蛋白酶原Ⅰ水平与组织学胃黏膜萎缩程度具有相关性。

