不同强度运动预处理对全脑缺血再灌注大鼠生长相关蛋白-43、轴突生长抑制因子Nogo-A表达的影响❋
孙竹梅 赵雅宁△ 李建民 王国立 陈长香 张美航 王 静
(1 华北理工大学临床医学院, 2 唐山市开滦总医院, 唐山 063000)
缺血性脑血管病作为我国常见病和高发病严重威胁人类健康[1-4]。脑缺血所导致的神经元损伤是诱发神经功能缺失的关键所在。寻找减少神经元损伤的有效干预方法,对脑缺血类疾病的预防及功能恢复有深远意义。有研究表明[5-6],脑缺血发生前进行运动训练能够使脑组织对后续发生的严重损伤产生耐受能力,对大脑的神经功能有保护作用。然而,其具体机制以及运动的强度等问题有待进一步阐明。轴突的准确投射与其形成、生长对神经再生有重要作用[7]。内源性再生相关因子生长相关蛋白-43(growth associated protein-43, GAP-43),是调节轴突形成新联系和引导轴突生长的一种快速转运胞膜磷酸蛋白[8-9]。而髓鞘相关蛋白神经突起生长抑制分子中,轴突生长抑制因子-A(neurite outgrowth inhibitor-A, Nogo-A)对神经生长具有强烈的抑制作用[10-11]。本研究通过建立不同强度运动预处理的脑缺血模型,观察实验大鼠海马区GAP-43、Nogo-A的表达变化及神经细胞丢失的变化,初步探讨两者在不同强度的运动预处理全脑缺血大鼠神经元损伤中的作用,旨在为脑缺血的预防及预后提供实验基础。
1 材料和方法
1.1 试剂与仪器
多克隆GAP-43抗体和多克隆Nogo-A抗体(北京博奥森生物技术有限公司);两步法检测试剂盒(北京中杉金桥生物科技有限公司);One Step SYBR®PrimeScriptTM PLUS RT-PCR Kit, RNAiso Plus(大连宝生物工程有限公司);引物(上海生工生物工程股份有限公司);ZH-PT型计算机控制动物实验跑台(安徽正华生物仪器设备有限公司);5417R冷冻离心机(德国Eppendorf公司);旋涡混匀器(江苏海门市麒麟医用仪器厂)。
1.2 实验动物分组和处理
80只3月龄雄性SD大鼠由北京维通利华公司提供(SCXK(京)2003-003),体质量230~310g。随机平均分成假手术组、脑缺血再灌注组(I/R组)、运动强度1预处理组、运动强度2预处理组。分别作如下处理: 假手术组分离暴露血管,但不电凝椎动脉、不夹闭颈总动脉;脑缺血再灌注组应用改良的Pulsinelli四血管阻断(4-VO)法[5]制备全脑缺血模型,动物术前12h禁食,常规水合氯醛麻醉,颈正中切口,分离出双侧颈总动脉,在其下置线备用。随后将大鼠翻正并用立体定位仪固定头颈部,枕后部正中切口,暴露双侧第1颈椎横凸翼孔,直视下电凝其下通过的椎动脉,每次电凝时间约为2~4s,使其永久闭塞。术后大鼠缝皮回笼,待恢复24h后以无创性微动脉夹夹闭双侧颈总动脉,缺血10min后松开动脉夹,以实现再灌注。
参照笔者前期所用方法[12],本研究选取2组健康大鼠作为运动预处理组,于每日9:00点开始跑台运动,跑台坡度设置为0°。首先进行为期7d的适应性跑台训练(以10、15、20m/min的速度分别持续10min),待大鼠熟悉跑台设备并能维持运动(以20m/min的速度持续30min)时开始建模,持续14d,总时程为21d。运动强度1预处理组设置速度为20m/min,时间为30min(相当于30% VO2max);运动强度2预处理组则采用递增强度的方式进行跑台训练,设置开始的速度为10m/min,逐渐提高速度并在3min内达到预定速度(19.3m/min,相当于70% VO2max。运动预处理后立即制备成全脑缺血再灌注模型。
每组又随机平均分为6h,1、3、7d时间亚组,各时间点n=5。分别进行以下检测。
1.3 组织标本制备
按时间点对各组大鼠用10%水合氯醛(300~350mg/kg)腹腔注射麻醉, 4%多聚甲醛固定心灌流,切取约2mm 厚度冠状背侧海马切片, 4℃4%多聚甲醛固定。24h以后对脑组织进行常规梯度乙醇脱水、二甲苯透明、浸蜡包埋、切片与贴片,切片厚度为4μm,45℃恒温箱中烤干待用。同一层面相同切片进行H-E染色和免疫组织化学显色。
1.4 GAP-43、Nogo-A免疫组织化学显色
切片常规脱蜡至去离子水,滴加复合消化液后加入37℃温箱孵育20min,经PBS洗涤,入3% H2O2封闭内源性过氧化物酶15min,经PBS洗涤后滴加兔抗大鼠GAP-43和Nogo-A多克隆抗体(1∶300稀释),4℃过夜;PBS洗涤后滴加生物素化二抗,37℃ 40min,PBS洗涤;DAB显色,苏木精轻度复染,脱水透明,封片。用0.01mol/L PBS代替一抗孵育作为阴性对照。应用Motic-6.0图像采集及图像分析系统,采用阳性细胞计数法,在相同光镜倍数(40×10)下每只大鼠每个指标选取5张脑组织切片,每一张切片在高倍视野镜下随机选取5个不重叠视野,计算每个视野的阳性细胞数,及棕黄色颗粒细胞,取均数作为每组该指标阳性细胞数。
1.5 组织材料的处理及总RNA提取
按时间点处死动物,冰上取出海马组织,加入1ml RNAiso Plus溶液后匀浆,室温静置5min后12000r/min 4℃离心5min,取上清移至新的1.5ml离心管内,加入1/5 RNAiso Plus溶液体积的氯仿,震荡混匀后室温静置5min,12000r/min 4℃离心15min,取上清液,加入0.5~1倍RNAiso Plus溶液体积的异丙醇,室温静置10min,12000r/min 4℃离心10min,弃掉上清液,用与RNAiso Plus溶液等量的75%乙醇清晰沉淀,7500r/min 4℃离心5min,弃上清保留沉淀,干燥(不可加热),溶解于30μl DEPC处理水中,测量OD260/280值,根据OD260计算RNA浓度,-80℃保存。
1.6 引物合成
参照CenBank公布的GAP-43、Nogo-A和GAPDH序列,由上海生工生物技术有限公司合成(表1)。
1.7 RT-PCR
应用ABI PRISM®7000和Applied Biosystems 7500 Fast Real-Time PCR System的操作方法,配置反应体系为20μl的反应液。进行Real Time One Step RT-PCR反应: Stage1、2(反转录反应): Reps,1,42℃ 5min,95℃ 10s;Stage3(PCR反应): Reps,40,95℃ 5s,60℃ 31s;Stage4(融解曲线分析): Dissociation Protocol。
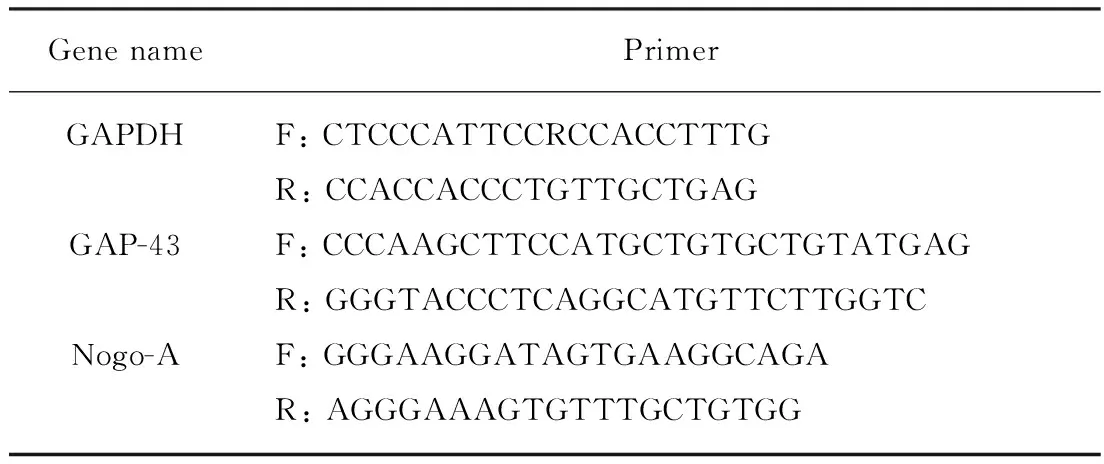
表1 PCR引物设计
1.8 统计学处理
2 结果
2.1 形态学观察
假手术组中神经元结构正常,细胞核规则,核仁清晰。与假手术组比较,I/R组神经元细胞胞体呈三角形,核皱缩深染,胞质嗜伊红,存活神经元数量随缺血时间延长而减少,以3d时神经细胞坏死情况最为显著(P<0.01)。运动强度1预处理组存活神经元细胞数量明显高于I/R组,细胞核固缩深染及水肿情况减轻;而运动强度2组存活神经元数量进一步减少,神经元细胞固缩、深染情况显著,出现较多细胞核丢失、空泡状的非正常形态神经元细胞(图1,表2)。

表2 各组大鼠海马区神经元细胞坏死率的比较±s)
*P<0.05vssham;△P<0.05vsI/R
2.2 GAP-43、Nogo-A阳性细胞数量及表达
免疫组织化学检测GAP-43、Nogo-A阳性表达主要位于细胞核,阳性细胞的胞质可见细小的棕黄色颗粒。假手术组可见GAP-43、Nogo-A在胞质有弱表达。与假手术组比较,脑缺血再灌注各组GAP-43、Nogo-A的表达明显增加,差异有统计学意义(P<0.01)。运动强度1预处理组GAP-43蛋白呈较高水平表达,并随时间延长呈递增趋势,于7d时达高峰,各时间点均显著高于I/R组(P<0.01);而运动强度2预处理组GAP-43蛋白表达显著低于运动强度1预处理组和I/R组(P<0.01)。此外,运动强度1预处理组Nogo-A在6h 时明显减少,并在1d时达低值,3d时有所上升,7d时达高值,但仍低于I/R组(P<0.01);运动强度2预处理组Nogo-A蛋白表达显著高于运动强度1预处理组和I/R组(P<0.01)(图2)。
2.3 各组大鼠脑组织海马区GAP-43、Nogo-A mRNA的表达
应用相对定量方法比较目的基因和内参基因之间的表达差异,采用2-△△Ct计算法显示实时定量PCR实验中基因表达的相对浓度。与假手术组比较,I/R组各时间点GAP-43、Nogo-A mRNA表达水平显著增加(P<0.01)。运动强度1预处理组GAP-43 mRNA呈较高水平表达,并随时间延长呈递增趋势,于7d时达高峰,各时间点均显著高于I/R组(P<0.01);而运动强度2预处理组GAP-43 mRNA表达显著低于运动强度1预处理组和I/R组(P<0.01)。此外,运动强度1预处理组Nogo-A mRNA表达在6h时明显减少,并在1d时达低值,3d时有所上升,7d时达高值,但仍低于I/R组(P<0.01);运动强度2预处理组Nogo-A mRNA表达显著高于运动强度1预处理组和I/R组(P<0.01)(表3、4)。

表3 各组动物海马区GAP-43 mRNA的表达±s)
*P<0.05vssham group;△P<0.05vsI/R group

表4 各组动物海马区Nogo-A mRNA的表达±s)
*P<0.05vssham;△P<0.05vsI/R
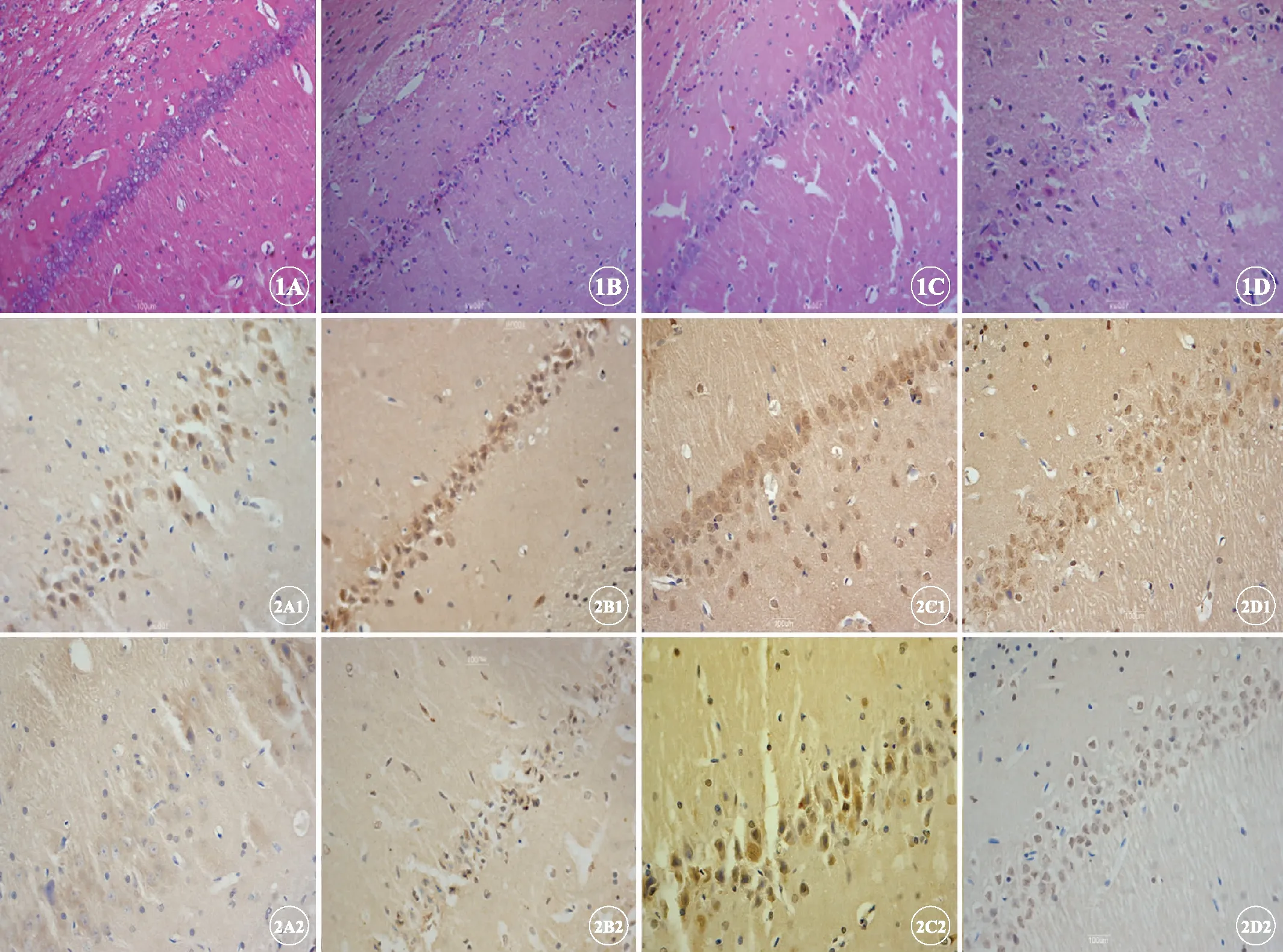
图1 缺血3d各组海马区CA1区神经元的H-E染色,×400。A: 假手术组;B: I/R组;C: 运动强度1预处理组;D: 运动强度2预处理组.
图2 缺血3d各组大鼠CA1区GAP-43(A1~D1)和Nogo-A(A2~D2)免疫组织化学显色,×400。A1/A2: 假手术组;B1/B2: I/R组;C1/C2: 运动强度1预处理组;D1/D2: 运动强度2预处理组.
Fig 1 H-E staining of neurons in the hippocampal CA1 region 3d after I/R in each group, ×400. A: Sham group; B: I/R group; C: Exercise intensity 1 group; D: Exercise intensity 2 group.
Fig 2 Immunohistochemistry staining of GAP-43 (A1-D1) and Nogo-A (A2-D2) in the hippocampal CA1 region 3d after I/R in each group, ×400. A1/A2: Sham group; B1/B2: I/R group; C1/C2: Exercise intensity 1 group; D1/D2: Exercise intensity 2 group.
3 讨论
本研究结果显示,与假手术组比较,运动强度1预处理促使脑缺血大鼠海马区的神经元细胞存活数目增多,而运动强度2预处理则加重了脑组织的缺血缺氧程度,使神经元细胞出现进行性坏死。提示运动训练预处理对脑组织的保护作用因强度差异而产生截然不同的效果。为探究其机制,观察了实验大鼠海马区GAP-43与Nogo-A的表达变化。
GAP-43是神经组织特异性磷酸蛋白质,是神经元发育及神经生长、再生标志蛋白[13]。Nogo-A是一种神经轴突生长相关蛋白,是抑制中枢神经结构重塑与再生的主要物质[14]。近年来,有学者[14-16]报道利用针康法、淫羊藿苷以及低氧疗法等上调了脑缺血区皮层GAP-43的表达,达到促使脑缺血大鼠脑缺血后神经再生和恢复功能的作用;更有学者在大鼠局灶性脑缺血模型中通过电针、康复训练、中药、Nogo-A受体拮抗剂等手段进行干预,表明抑制Nogo-A的表达可增强存活脑区神经元的修复再生,部分重建丧失的神经功能。
研究结果显示,运动强度1预处理训练能够上调脑缺血大鼠脑组织GAP-43的表达,抑制Nogo-A的表达,并提高其下降速度,使其在更短时间内降至较低水平,从而维持神经元的正常发育和存活,促使缺血损伤后突触的形成及出芽。李超等[17]在脑梗死大鼠模型中证实,每天10min的跑笼训练可促使大鼠抓握力的恢复,梗死灶周围神经元数量显著增多,且使Nogo-A蛋白水平表达下调,改善轴突生长的微环境。提示运动强度1预处理通过减慢GAP-43随着时间延长而表达降低的幅度,抑制Nogo-A的表达水平,为轴突再生提供基础,加强了神经细胞轴突的修复和突触间的连接再塑,进而使中枢神经功能的恢复得到进一步改善。
研究还表明,运动强度2预处理使脑缺血大鼠脑组织海马区GAP-43表达进一步降低。Nogo-A表达增加并大量释放,造成神经元的不可逆损害,加重缺血损伤。樊振勇等[18]研究认为,脑缺血再灌注后,GAP-43表达增强可能与损伤神经的功能恢复相关,运动训练的介入激活了神经元,促进了神经元轴突的神经突触的连接重建以及修复、再生[19]。但大强度的极限负荷造成大鼠机体疲劳,过多的跑台运动并不利于大鼠海马神经细胞的再生,这种大强度的剧烈运动使海马神经元发生形态和功能变化,突触传递效能下降,海马的神经元兴奋性降低[20]。以上研究结果提示,运动强度2预处理诱导的氧自由基堆积,打破微环境平衡,促使Nogo-A过表达,打破机体内平衡状态,发挥抑制神经再生的作用,同时下调GAP-43而抑制神经再生,加重大鼠脑缺血再灌注后神经功能损伤,引起中枢神经系统结构机能的紊乱或下降。
综上所述,Nogo-A蛋白的表达会使脑损伤的进程加速,而GAP-43基因的表达促进脑损伤修复和神经再生。两者相互制约和依存,协同调控机体内环境的平衡。运动训练可以促进脑缺血大鼠梗死灶周围轴突出芽,但是由于受到不利微环境的影响,如运动强度和髓鞘形成抑制因子的影响,轴突再生受到很大程度的限制,影响功能的恢复。本研究结果提示,不同强度运动训练对大鼠神经功能恢复及脑组织结构具有截然不同的作用,与调控脑组织海马区GAP-43和Nogo-A的表达有关。