三维载体培养下离心力对骨髓间充质干细胞增殖的影响
蒋 斌 郑明辉# 张 斌 郝朦尘 张 喜△
(第二军医大学, 1 学员旅学员十一队, 2 基础部解剖学教研室, 上海 200433)
骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)是一类具有自我更新能力的多潜能细胞,在特定培养条件下可以诱导分化成多种功能细胞或组织器官[1-2]。目前二维与三维细胞培养技术相对成熟,力学因素干预也被证实能影响BMSCs的增殖与分化[3-4],而离心力对三维载体培养下BMSCs增殖影响的研究甚少,因此本实验通过观察不同大小离心力刺激BMSCs增殖的作用,为组织工程种子细胞的快速扩增培养提供理论基础。
1 材料和方法
1.1 主要试剂与材料
低糖培养基(DMEM, Hyclone公司);Ⅰ型胶原海绵(Worthington公司);含EDTA的0.25%胰酶(Gibico公司);抗青-链霉素(上海生工公司);胎牛血清(FBS,Gibico公司);10%完全培养基(含10%FBS,谷氨酰胺,DEME培养基,1%抗青-链霉素);CM-Dil(碧云天公司);端粒酶活性检测试剂盒(齐一生物科技有限公司)。
1.2 BMSCs的培养
SD大鼠(第二军医大学动物中心提供)用10%水合氯醛0.35ml/100g腹腔注射麻醉。无菌分离和清洁股骨和胫骨,去除肌肉等组织,将其移至含10%完全培养基的培养皿中,剪碎,用5ml注射器反复冲洗至骨髓腔变白;收集所有冲洗的培养液于离心机中1000r/min离心8min,弃上清,加入培养基重悬接种于25cm2培养瓶中,于37℃、5% CO2培养箱中培养。3d后换液,之后每23d换液。倒置相差显微镜观察细胞的形态与生长情况,待瓶底细胞覆盖率达80%以上时,用含EDTA的0.25%胰酶消化,按照1∶2比例进行传代。
1.3 BMSCs的荧光标记
取生长良好的第3代BMSCs,加入CM-Dil(10μg/ml)进行标记,将细胞置于37℃、5% CO2的培养箱中5min,然后置于4℃环境15min,再换成新鲜的10%完全培养基,置于37℃、5% CO2的培养箱继续培养。之后每天都用荧光显微镜进行观察。
1.4 BMSCs三维载体共培养体系的构建
将CM-Dil标记的第3代BMSCs制成单细胞悬液,调整细胞密度为3.0×106/ml,在8孔板中将225μl细胞悬液滴加到1cm×1cm×0.5cm大小的胶原海绵支架上,待海绵吸收后,将其倒置,以使细胞悬液完全充满海绵的内部结构。置于37℃、5% CO2的培养箱中孵育34h,再向培养孔中加入新鲜的10%完全培养基覆盖BMSCs支架复合体,继续置于培养箱中培养,第3天换液,之后每2d换1次液。
1.5 实验分组与处理
实验分为4组: 对照组(0r/min),200r/min组,500r/min组,800r/min组。每组有2块BMSCs支架复合体,于第1次换完液后开始进行实验处理。将实验组的细胞支架复合体放入5ml离心管中,加入10%完全培养基2ml至覆盖住复合体,然后进行相应转速大小的离心处理,每天5次,每次10min(旋转半径为12cm),每次间隔30min,间隔时间与处理完后均放置于培养箱中,共连续处理7d;对照组除离心外,需同步置于相同的无菌环境中。
1.6 端粒酶浓度检测
在第1、3、5、7天离心处理完后12h时,分别留取每块细胞支架复合体的培养液0.5ml进行检测,绘制端粒酶浓度值变化的趋势图。
1.7 H-E染色与计数
经过不同大小离心力处理7d后,对所有BMSCs支架复合体进行固定,做石蜡切片H-E染色。在放大相同倍数的倒置相差显微镜下观察,随机取6个不同视野细胞计数,对不同组的细胞密度进行比较。
1.8 统计学处理
采用SPSS 16.0软件包对数据进行处理,实验结果用表示,对7d后各组细胞密度以及不同时相下端粒酶浓度值的多重比较采用单因素方差分析;各组间的两两比较使用LSD检验。
2 结果
2.1 倒置相差显微镜观察二维培养条件下的BMSCs
原代培养的大鼠BMSCs刚接种时呈圆形,24h后有部分梭形细胞贴壁;34d细胞开始伸展、分裂,出现较多细胞突起,并呈集落生长。7d时细胞进入对数生长期,成簇分布。12d时大部分细胞集落融合,在集落中心处较密,外围细胞呈放射状向外分布,细胞基本长满。传代培养的BMSCs增殖速度快,第3代细胞24h内完全贴壁并伸展,细胞核居中,细胞呈长梭形或多角形融合聚集,紧密排列有一定方向性,56d细胞覆盖率达95%以上(图1)。
2.2 荧光显微镜观察二维和三维培养条件下的BMSCs
二维培养条件下,经过CM-Dil标记的第3代BMSCs细胞膜在波长为553nm的绿光激发下发出明亮的红色光,为空心椭圆状或空心圆形,中间未着色的区域是细胞核(图2)。细胞支架复合体中,荧光显微镜下观察到胶原海绵中有大量发出红色光亮的小点,分布较均匀且致密,具有层次感,表明细胞生长状况良好,BMSCs与胶原海绵具有良好的相容性(图3)。
2.3 三维载体中BMSCs的形态学与细胞计数
7d后,H-E染色切片可见各组胶原海绵内有较多的BMSCs生长,部分细胞黏附于胶原海绵支架上,呈梭形生长;部分细胞填充于海绵间隙中,呈椭圆形或圆形;还有部分细胞相互融合,形成细胞团块(图4)。通过细胞计数与统计学分析显示200r/min与500r/min组的细胞密度>对照组,其中500r/min组最大,而800r/min 组的细胞密度<对照组;各组之间细胞密度的差异具有统计学意义(P<0.05)(图5)。
2.4 不同时相下三维载体中BMSCs的生长活性
在1、3、5、7d离心处理之前分别留取8块细胞支架复合体的培养液做端粒酶浓度检测,绘制Elisa-端粒酶浓度变化趋势图(图6)。结果显示各组细胞支架复合体中第3代BMSCs生长活性在15d均呈升高趋势,于57d均逐渐下降。其中,5d时500r/min组的细胞生长活性最强,200r/min组的生长活力高于对照组,而800r/min组生长活力低于对照组。各组之间端粒酶浓度数值的差异具有统计学意义(P<0.05)。
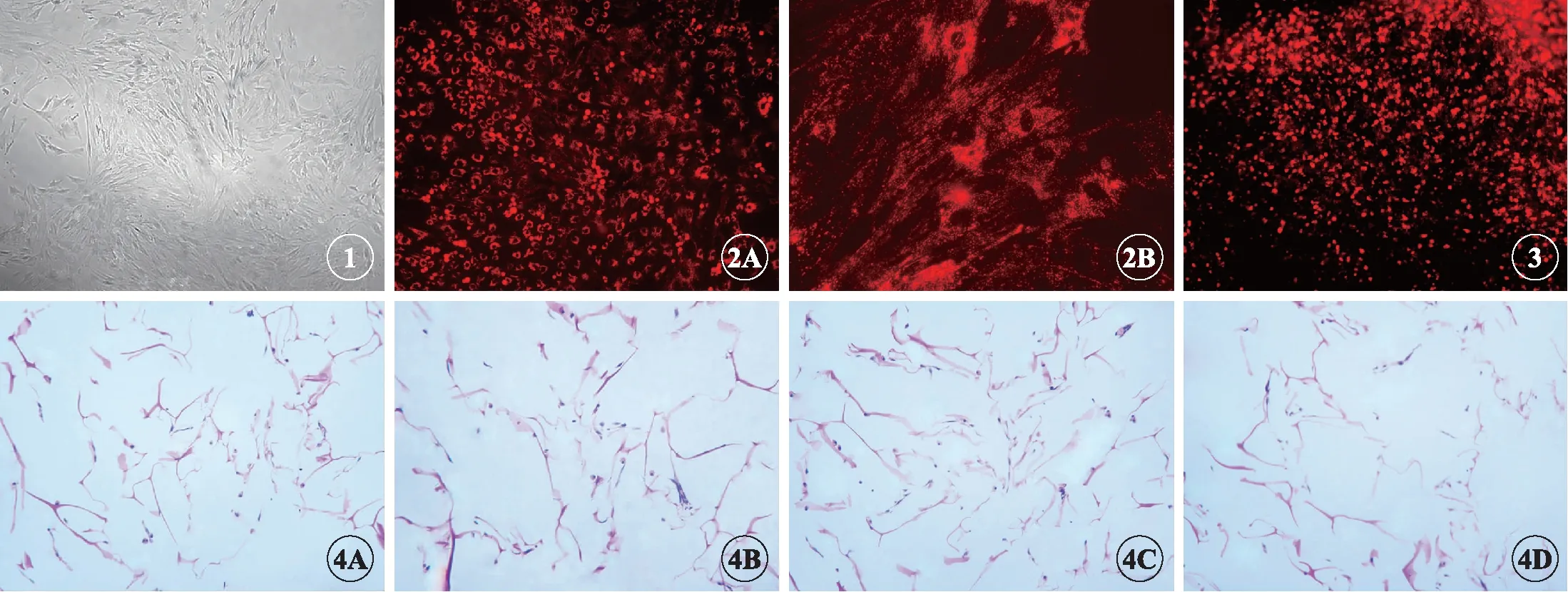
图1 第3代BMSCs倒置相差显微镜图,×40.
图2 第3代BMSCs荧光标记图(CM-Dil活细胞膜染色)。A:×40; B: ×100.
图3 CM-Dil标记的BMSCs在支架复合体内的荧光显微镜图,×40.
图4 BMSCs支架复合体7d后石蜡切片的H-E染色,×40。A: 0r/min; B: 200r/min; C: 500r/min; D: 800r/min.
Fig 1 The third-generation BMSCs under inverted contrast phase microscope, ×40.
Fig 2 The third-generation BMSCs, CM-Dil staining. A:×40; B: ×100.
Fig 3 The CM-Dil labeled BMSCs with the scaffold under the fluorescent microscope, ×40.
Fig 4 H-E staining of paraffin sections of the scaffold complex on day 7. A: 0r/min; B: 200r/min; C: 500r/min; D: 800r/min.
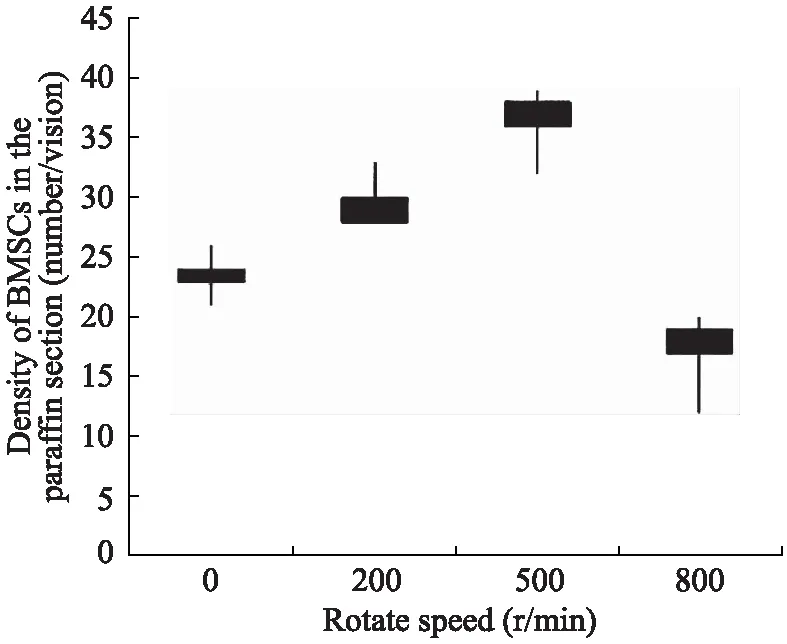
图5 实验组处理7d后不同组BMSCs的密度(个/视野)
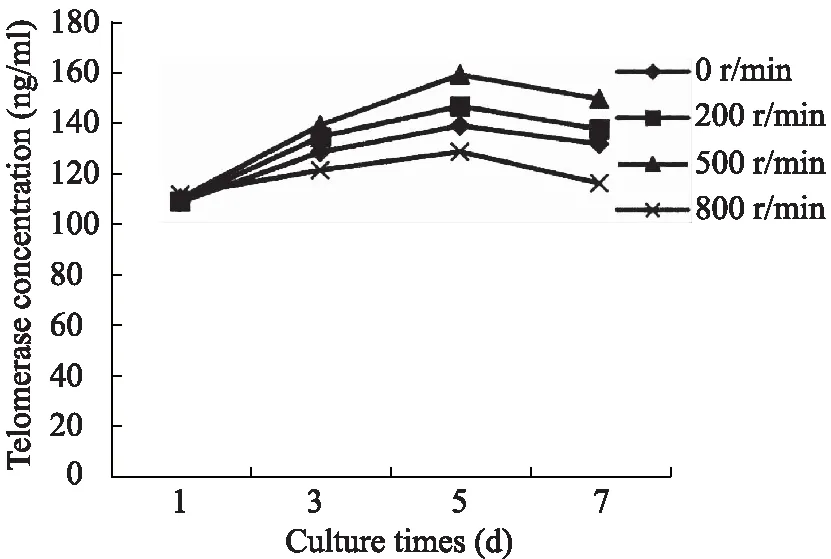
图6 不同时相下各组的端粒酶浓度(ng/ml)
3 讨论
本研究结果显示,体外条件下大鼠BMSCs与三维载体胶原海绵支架材料具有很好的相容性,并且生长状况良好。在离心过程中,一方面离心力可以使黏附于胶原海绵上的细胞发生拉伸形变,另一方面离心可使培养液与BMSCs-支架复合体发生相对移动,产生流体剪切力。同时,BMSCs-支架复合体的动态三维培养相比静态三维培养具有以下优点: (1) 细胞种植更加有效,立体分布更加均匀,允许种植的细胞数量更多;(2) 可促进O2和营养物质送至载体内,同时促进CO2的排出,维持细胞代谢的有利微环境;(3) 力学刺激下可促进细胞分泌更多细胞外基质,有利于调节细胞增殖、分化等功能。
孔清泉等[5]研究显示相比静态培养,施加离心力(1000r/min,每天3次,每次20min,旋转半径12cm,相对离心力约为200g)刺激可促进软骨细胞分泌硫酸化糖胺多糖(GAG)与Ⅱ型胶原,并且影响组织工程软骨结构的排列。段峰等[6]给予成骨细胞不同转速离心力(90r/min,180r/min,250r/min)和相同转速不同持续时间(6h,12h,24h)的刺激,显示离心力刺激可促进成骨细胞骨形态发生蛋白信号通路中Runx-2 mRNA的表达,且都随时间延长差异明显,其中180r/min组(旋转半径19cm,相对离心力大小约为6.8g)作用最强。Furutsu等[7]报道在较低水平离心力(1.5~2.0g)刺激下能促进成骨细胞的增殖,而当细胞在高水平离心力(40~80g)作用下时,细胞的生长和分化将受到抑制。此外,徐南伟等[8]研究表明离心力(1000r/min,相对离心力大小约132g,每次30min,每天2次)培养BMSCs组的骨钙素质量浓度明显高于对照组,说明离心力能促进BMSCs的成骨分化。
本研究结果显示,离心力对BMSCs的增殖有影响。较低转速(200r/min与500r/min)的离心力可促进BMSCs增殖,其中500r/min(相对离心力大小约为30.9g)的促进作用最强。而过高转速(800r/min,相对离心力大小约为79.2g)的离心力表现为抑制作用。端粒酶的吸光度与浓度成正比,浓度越大则活性越强,并且端粒酶活性可以间接反映细胞增殖能力的强弱[9]。根据本实验端粒酶活性检测的结果表明三维载体中细胞生长增殖能力呈先升高后下降的趋势,500r/min干预5d时BMCSs的生长增殖活性最强。至于离心力是否会导致细胞成瘤改变[10]以及能否影响BMSCs的分化能力与方向,还有待于进一步的实验研究证明。

