利用CRISPR/Cas9技术敲除斑马鱼核受体PXR基因初探*
成凯,冯永永,周莉,李凯彬,聂湘平
(1. 暨南大学生命科学技术学院生态系//水生生物研究所,广东 广州510632;2. 中国水产科学研究院珠江水产研究所,广东 广州510380)
孕烷X受体(Pregnane X receptor, PXR)是核受体超家族(NRs)中NR1I的重要成员之一,在保护生物机体免于内源性和外源性物质损伤方面有重要作用[1]。PXR 转录因子参与调控众多与解毒代谢相关的基因,例如人体内药物代谢的主要酶系之一细胞色素P450(CYP)就是PXR转录因子调控的下游重要靶基因之一,该酶也是包括鱼类在内许多动物代谢外源污染物的主要代谢酶系。因此PXR核转录因子诱导激活或抑制阻遏[2],可调节外源污染物的代谢和转运[3],对外源污染物在体内的转化、代谢有着重要的作用[4]。目前研究鱼类生物PXR转录因子在环境污染物暴露下的调控响应变化已有报道[5-6]。但对PXR转录因子在污染物解毒代谢中的具体作用机制还缺少深入研究。如果能利用新一代CRISPR/Cas9基因编辑技术[7]对该目标基因进行编辑,获得PXR纯缺陷型PXR(-/-),对比较研究PXR转录因子在污染物代谢过程中作用将会有重要帮助。
CRISPR/Cas9系统是第三代“基因组定点编辑技术”[8],该系统中crRNA(CRISPR-derived RNA)与tracrRNA(trans-activating RNA)结合形成一个单链向导RNA(guide RNA,gRNA),能特异性识别目标基因序列,并引导Cas9核酸内切酶准确识别特定靶位点进行DNA双链剪切[9],利用细胞的非同源末端自我连接修复机制,断裂处的基因片段在自我修复过程中可能会出现插入或缺失突变现象[10],从而改变基因组原始结构,达成基因编辑目的。
本研究利用CRISPR/Cas9基因编辑技术,以模式生物斑马鱼为研究对象,建立鱼类体内和污染物代谢密切相关的核转录因子PXR基因靶向敲除系统,获得完全缺失PXR基因的斑马鱼,为PXR基因的相关研究提供基础研究材料。
1 材料与方法
野生型斑马鱼品系Tuebingen(Tu)由中国水产科学研究院珠江水产研究所提供,Cas9 mRNA表达质粒采用pXT7-Cas9[11],YFP-nanos3质粒由南京大学动物模式研究所提供[11-12]。
1.1 gRNA靶位点的设计
在NCBI上查询斑马鱼PXR基因的核酸序列Sequence ID:XM_005167420.4,查询PXR基因内含子、外显子结构及其转录本信息。设计原则:根据PXR基因组外显子结构(图1),靶位点选取其第2个外显子,靶位点的设计应在起始密码子ATG之后,为了保证基因剪切被破坏,原则上不可选取5-UTR和3-UTR。以PXR基因的第2个外显子的序列为模板,通过网站http://crispr.mit.edu/设计gRNA靶位点,从在线设计结果中挑选符合要求的靶位点序列,并比对高评分且特异性强的靶位点作为候选位点(图2)。再根据各组gRNA靶位点序列(表1)分别设计其对应的特异性正向引物(表2)。

图1 PXR基因组外显子结构示意图Fig.1 PXR genome exon structure diagram

图2 gRNA靶位点示意图Fig.2 gRNA target mapgRNA具体序列见表1The gRNA specific sequence is shown in Table 1
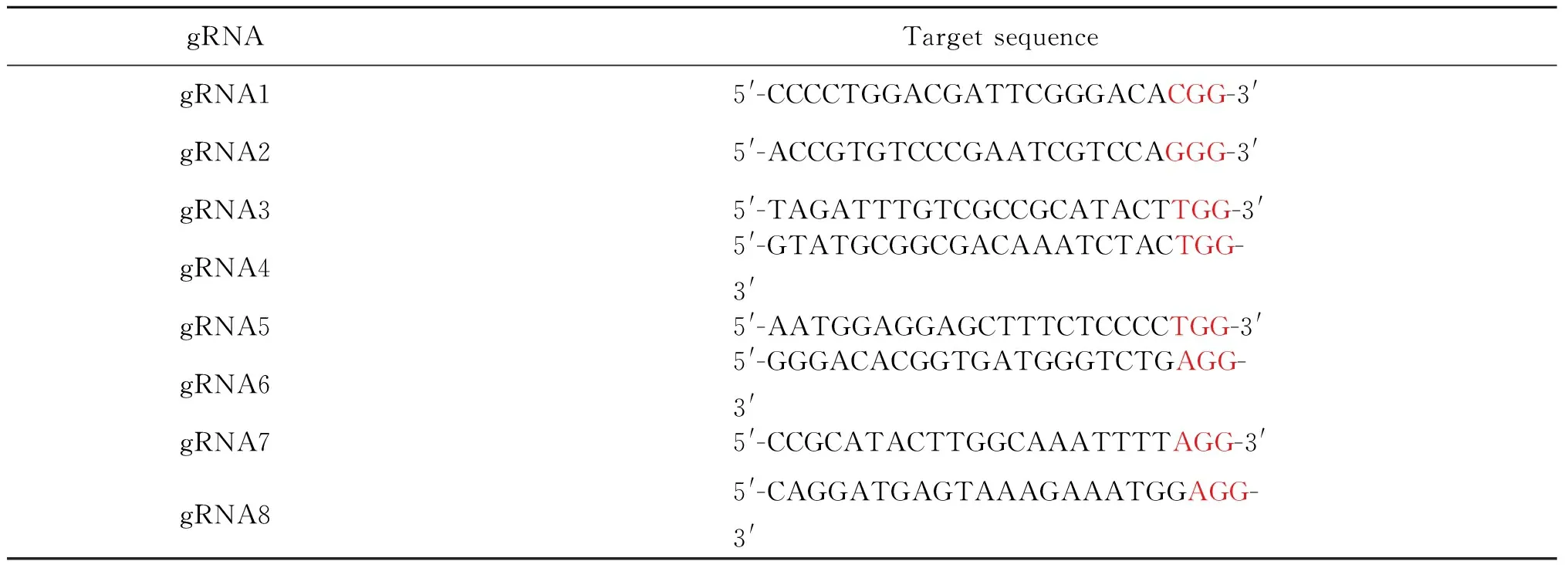
gRNATarget sequencegRNA15'-CCCCTGGACGATTCGGGACACGG-3'gRNA25'-ACCGTGTCCCGAATCGTCCAGGG-3'gRNA35'-TAGATTTGTCGCCGCATACTTGG-3'gRNA45'-GTATGCGGCGACAAATCTACTGG-3'gRNA55'-AATGGAGGAGCTTTCTCCCCTGG-3'gRNA6 5'-GGGACACGGTGATGGGTCTGAGG-3'gRNA75'-CCGCATACTTGGCAAATTTTAGG-3'gRNA8 5'-CAGGATGAGTAAAGAAATGGAGG-3'
1):Cas9 mRNA只能切割PAM(protospacer adjacent motif)上游的序列,红色字体标记为PAM区Cas9 mRNA can only shear the sequence of PAM upstream, the red font marks are the PAM area
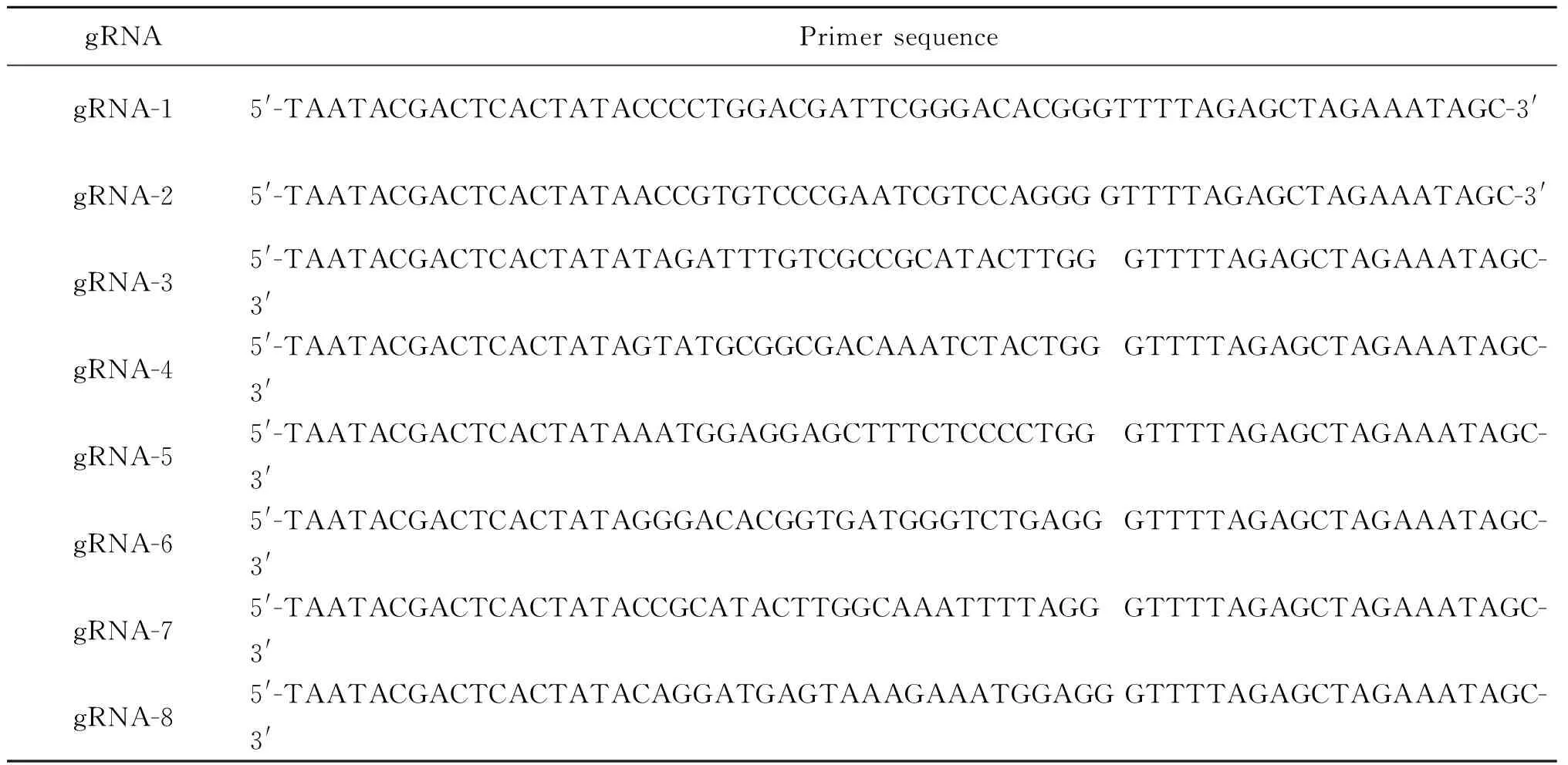
表2 gRNA特异性正向引物Table 2 gRNA specific forward primer
1.2 体外转录合成gRNA
1.2.1 gRNA模板构建 gRNA特异性的正向引物根据各组gRNA靶位点设计,包括T7启动子序列,靶点序列及部分scaffold序列,通过此引物将T7启动子序列和靶点序列带入。通用反向引物为部分scaffold序列及终止信号:5′-AAAAAAAGCACCGACTCGGT-3′。通过PCR方法扩增出目的片段,PCR反应体系构成:PrimeSTAR Max Premix 25 μL,gRNA特异性的正向引物和通用反向引物各2 μL,gRNA模板(即设计的靶位点)1 μL,ddH2O补足至50 μL。
PCR反应条件: 98 ℃下变性10 s,55 ℃下退火5 s, 72 ℃下延伸5 s, 共进行35个循环;将PCR产物用w=2%琼脂糖凝胶进行电泳,目标大小为120 bp左右。
用RNase free的PCR产物回收试剂盒(Axgen)对上述PCR产物进行回收,回收完毕用DEPC-H2O溶解回收到的PCR产物。
1.2.2 gRNA体外转录 使用试剂盒MAXIscript®T7 Kit(Ambion)进行gRNA体外转录,转录完成后,取1 μL产物用w=2%琼脂糖凝胶进行电泳,可检测转录出的gRNA条带的完整性,并用紫外分光光度计测量转录出gRNA浓度,存于-70 ℃。
1.3 Cas9和YFP-nanos3mRNA合成
以pXT7-Cas9质粒为模板制备Cas9 mRNA,用EcoRⅠ、Hind Ⅲ双酶切将质粒线性化(EcoRⅠ和HindⅢ是pXT7-Cas9质粒T7转录下游的2个酶切位点,双酶切是为防止酶切后自连);然后用m MessagemMachine SP6 Kit(Ambion,美国)按说明书的指示进行体外转录,完成转录后取1 μL产物用w=2%琼脂糖凝胶进行电泳以检测转录的目的条带完整性。转录产物用试剂盒RNease Mini kit(Qiagen)纯化。最后用紫外分光光度计测量转录出Cas9 mRNA浓度,存于-70 ℃。在注射gRNA与Cas9 mRNA时不能确保会在每一颗鱼卵中得到表达,后续需要展开大量的测序工作,为提高筛选效率在显微注射中引入YFP-nanos3 mRNA,此mRNA会在斑马鱼胚胎中翻译表达出黄色荧光蛋白,相关文献证明,YFP基因以球虫基因为载体搭建后在真核细胞中黄色荧光蛋白能够得以表达[13],故利用其蛋白的荧光表达性状进行初步筛选可提高后续实验筛选效率。YFP-nanos3mRNA的制备方法与Cas9相同。
1.4 显微注射
选取若干条野生型斑马鱼进行雌雄配对,待其交配产卵后,收集挑选一细胞期的受精卵进行注射,依照gRNA识别位点,将8个gRNA分为3组,第1组为gRNA1、gRNA4、gRNA6;第2组为gRNA3、gRNA5、gRNA7;第3组为gRNA2、gRNA8;使同一组内gRNA识别位点无重复片段。将Cas9 mRNA调整到300 ng/μL,gRNA 300 ng/μL,YFP-nanos3 mRNA 300 ng/μL按1∶1∶1混匀注射,注射量为1~2 nL。
1.5 gRNA活性验证
1.5.1 提取斑马鱼基因组DNA 显微注射24 h后,挑选有荧光表达的受精卵分别从注射组和对照组挑选活卵,用基因组DNA提取试剂盒(尧舜禹生物科技有限公司,南京)提取DNA,存于-20 ℃。
1.5.2 PXR基因的扩增 以提取到的基因组DNA为模板,进行PCR反应。
上游引物PXR6-F: 5′-ACAGATTTTGGTATCAGTG-3′
下游引物PXR5-R: 5′-TTATTAGTACGGGCTTGGA-3′
PCR反应条件:95 ℃下预变性5 min;95 ℃下变性30 s,54 ℃下退火30 s, 72 ℃下延伸45 s, 共进行35个循环;再在72 ℃下延伸5 min。PCR产物用w=2%琼脂糖凝胶进行电泳,根据条带可进行初步分析。PCR的引物是根据NCBI上斑马鱼PXR的基因序列(Gene ID: 565875)进行设计。
1.5.3 DNA序列分析 以上PCR产物用Gel Extraction Kit(OMEGA)试剂盒胶回收,用pMDTM18-T Vector Cloning Kit(TaKaRa)连接,转入DH5α感受态(TaKaRa)中,挑取单克隆,经由广州艾基生物技术有限公司测序验证,测序结果用Chromas和SnapGene软件进行分析比对,通过靶位点附近位置是否出现Indel突变以确定有活性的gRNA。
1.6 可遗传突变个体的筛选与培育
检测到突变的同批显微注射受精卵孵化并饲养至性成熟,再与野生型杂交繁殖获取F1代,对F1代剪尾鳍以提取DNA进行测序鉴定,筛选出缺失PXR基因的杂合突变体,标准化饲养至成鱼,杂合突变体之间进行杂交繁殖,得到F2代,仍然以剪尾鳍的方式提取DNA进行基因鉴定,根据理论分析,在F2代便可以得到完全缺失PXR基因型的纯合子斑马鱼,在后续实验结果中PXR(+4/+4)型斑马鱼在F2代中获取,得以印证理论分析。
2 结果与分析
2.1 gRNA活性测试
合成gRNA与Cas9mRNA后,用w=2%琼脂糖凝胶进行电泳,凝胶成像结果显示gRNA和Cas9 mRNA均为单一条带(图3)。
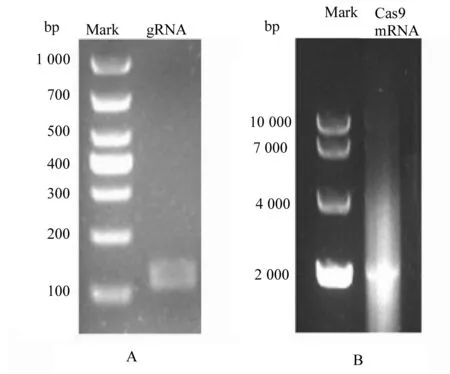
图3 gRNA和Cas9 mRNA凝胶电泳检测Fig.3 gRNA and Cas9 mRNA gel electrophoresis detectionA: gRNA凝胶电泳,其Marker是DL1000; B:Cas9mRNA凝胶电泳,其Marker是DL10000A: mRNA gel electrophoresis and its marker DL1000; B:Cas9 mRNA gel electrophoresis and its marker DL 10000
将合成后的gRNA、Cas9 mRNA和YFP-nanos3 mRNA通过显微注射斑马鱼一细胞期受精卵的方式验证gRNA活性,选取有荧光的斑马鱼鱼卵,提取基因组DNA,PCR扩增目的序列,再进行胶回收,与PMD18-T载体连接转化后,挑取单克隆,通过菌液PCR获得阳性菌株,送广州艾基生物技术有限公司测序,序列比对结果显示,gRNA1、gRNA6、gRNA7具有活性(表3,表4),gRNA2、gRNA3、gRNA4、gRNA5和gRNA8均无活性,在此不再表述。
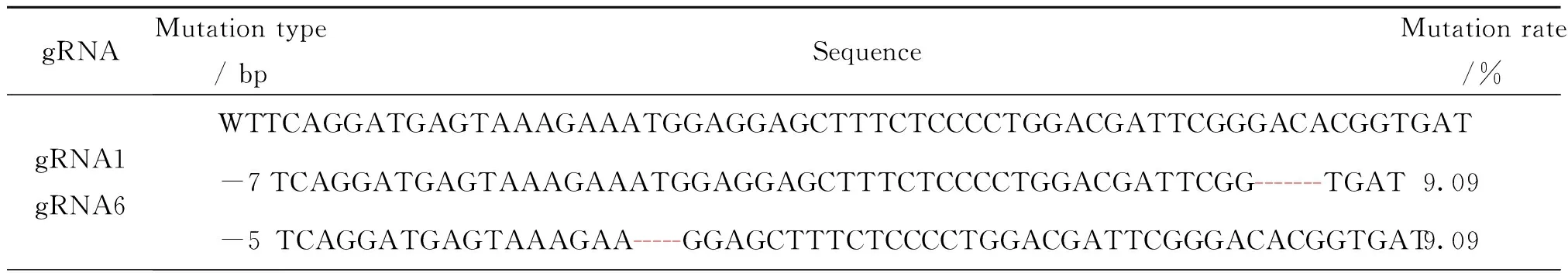
表3 预测区序列的敲除鉴定1Table 3 Deletion identification of the prediction area sequence 1
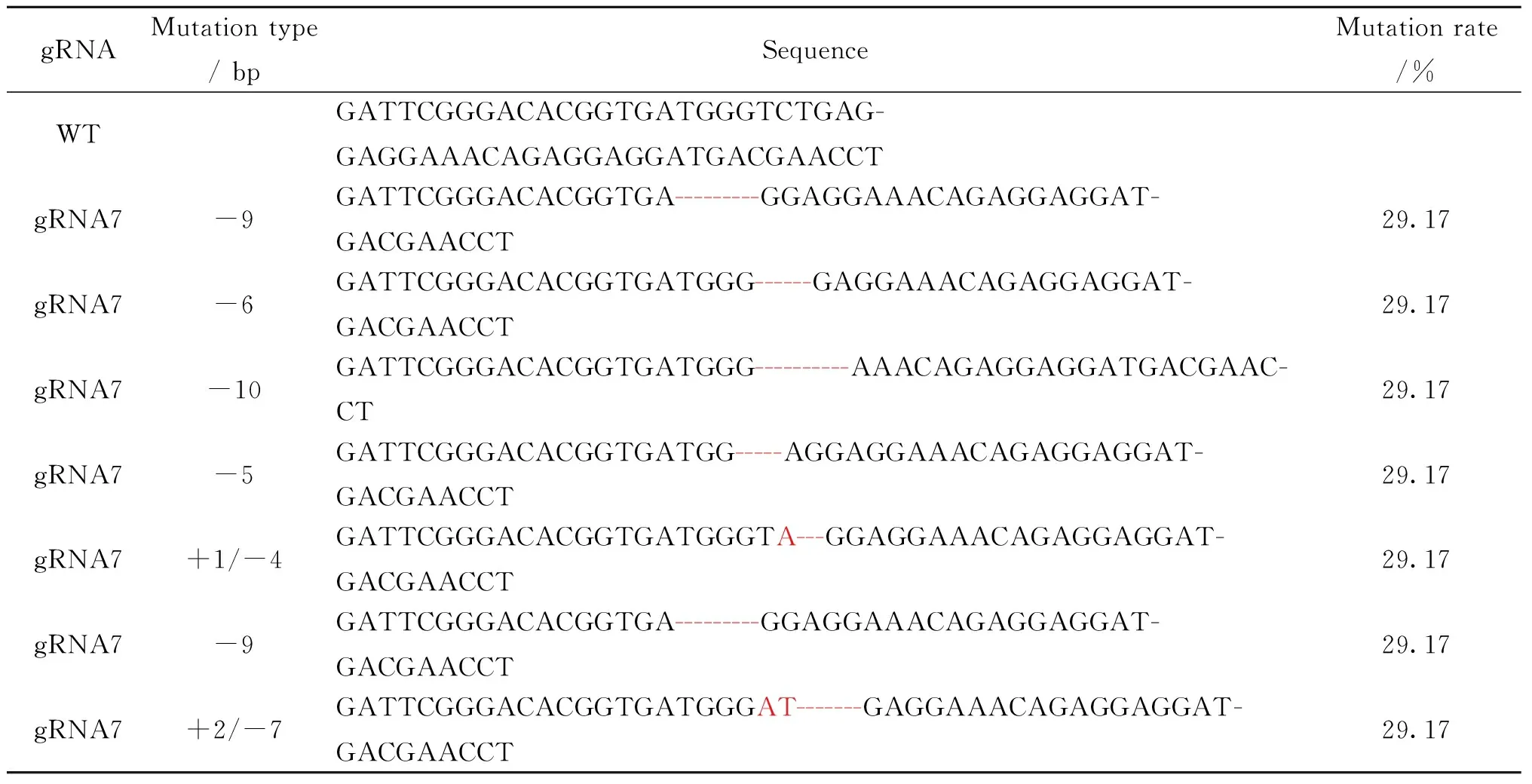
表4 预测区序列的敲除鉴定21)Table 4 Deletion identification of the prediction area sequence 2
1) 红色字体标注为插入基因片段,红色标注连字符为缺失基因片段
Red font is labeled as inserted gene fragment and red labeling hyphen is missing gene fragment
2.2 筛选稳定敲除PXR基因的斑马鱼
将筛选到具有活性的gRNA1、gRNA6和gRNA7混匀后与Cas9 mRNA和YFP-nanos3 mRNA按照1∶1∶1的剂量显微注射受精卵得到F0代,与野生型斑马鱼杂交繁殖获取F1代,对F1代剪尾鳍以提取DNA进行测序鉴定,筛选出缺失PXR基因的杂合突变体有4种突变型(图4),挑选indel 4 bp A型为F1代。标准化饲养至成鱼,F1代之间进行杂交繁殖,得到F2代,在F2代中通过DNA测序验证挑选,indel 4 bp A峰图(图5)单一整齐,没有杂峰套峰出现,表示两条等位基因均在同一位点插入相同的4个碱基导致该段基因移码突变,从而达到基因敲除的目的,得到纯合突变体。
3 讨 论
CRISPR是细菌和古细菌为应对病毒和质粒不断攻击而进化而来的获得性免疫防御机制[14]。在此基础上发展建立起来的CRISPR/Cas9基因编辑技术是近代分子生物学研究中一项重要革新技术,该技术可以直接对基因组进行编辑,使目标基因出现不可逆的改变[15]。CRISPR/Cas9基因编辑技术与较早的锌指核酸酶(Zinc-finger nucleases, ZFNs)以及转录激活因子效应物核酸酶(Transcription activator-like effector nucleases, TALENs)系统相比,在设计上更为简便快捷,成本低廉且敲除高效[16]。
本实验依据CRISPR/Cas9基因编辑技术,以模式生物斑马鱼为研究对象,在PXR基因上选取其第二个外显子,设计gRNA靶位点,体外转录合成gRNA和Cas9 mRNA,对野生型斑马鱼鱼卵进行显微注射,进行基因敲除。CRISPR/Cas9技术通过破坏DNA双链引起细胞非同源末端自我修复,在自我修复过程中所发生的情况有缺失、插入和缺失插入同时存在,非同源末端自我修复导致的基因片段移码突变类型是不可控因素,本实验在验证gRNA1、gRNA6、gRNA7具有活性后将三组混匀通过显微注射进入野生型斑马鱼鱼卵,出现缺失和插入基因突变类型。其中缺失6 bp对PXR基因编码的蛋白序列影响较小,插入4 bp B型包含插入3 bp和缺失1 bp,这种情况较为复杂,插入4 bp A型为完整插入4 bp,可以破坏原始基因序列并确保影响PXR基因编码的蛋白序列,故而选取插入4 bp A型的斑马鱼通过逐代杂交筛选,最终获得完全缺失PXR基因的斑马鱼,并能稳定繁殖后代。
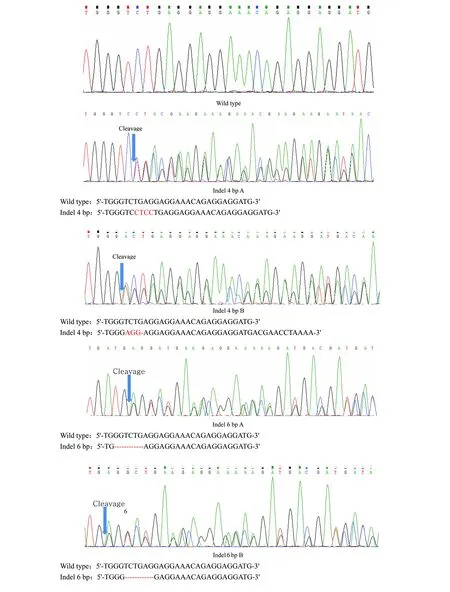
图4 DNA序列测序图Fig.4 Sequence map of DNA sequence红色字体标注为插入基因片段,红色标注连字符为缺失基因片段Red font is labeled as inserted gene fragment and red labeling hyphen is missing gene fragment
图5 F2代DNA测序验证Fig.5 F2 generation DNA sequencing validation红色下划线与红色字体标注为插入的基因片段The red underline is marked with the red font as the inserted 4 bp
YFP-nanos3 mRNA表达的黄色荧光蛋白可发出稳定荧光且不需要依赖其他辅助因子,转入目的细胞后的荧光蛋白基因稳定且对多数宿主的生理无影响作用,是理想的报告基因,简化了显微注射的检测工作,通过直观观察筛选出研究对象[17],提高实验效率。相关研究表明CRISPR/Cas9技术可成功建立在非模式生物当中如罗非鱼[18],说明CRISPR/Cas9技术具有普适性。本研究在斑马鱼体内成功建立PXR基因的CRISPR/Cas9敲除系统,为后续PXR基因对药物代谢的研究以及理解鱼类PXR基因的功能提供实验依据。

