人博卡病毒微滴数字PCR定量方法的建立
邓幼平,刘颖娟,王笑臣,刘佳明,杨占秋,赵东赤,*
(1 武汉大学中南医院 儿科,武汉 430071;2 武汉大学中南医院 检验科,武汉 430071;3 武汉大学 医学院 医学病毒学研究所,病毒学国家重点实验室,武汉 430071)
人博卡病毒(Human bocavirus, HBoV)是单链无包膜的DNA病毒,属于细小病毒科博卡病毒属,基因全长约5.2 kb,由瑞典学者采用随机PCR克隆测序方法在儿童呼吸道感染病例中发现. HBoV与人类呼吸道感染密切相关,易感人群主要是婴幼儿,临床表现为发热、咳嗽、喘鸣及不同程度的呼吸窘迫,极少数患者可出现纵膈气肿和双侧气胸,是儿童呼吸道感染重要的呼吸道病原之一[1,2].
由于缺少可靠的HBoV体外培养系统和动物模型,目前临床诊断主要依靠血清学方法检测病毒抗体和PCR技术检测病毒核酸[1,3-6].荧光定量PCR法(real-time PCR)法较常规PCR法更敏感,并能定量病毒拷贝数,但它依赖CT值和标准曲线间接定量,对低拷贝和复杂来源的临床样本检测存在较大的局限性.随着PCR定量技术的不断改进,微滴数字PCR(ddPCR)可实现对DNA分子的绝对定量.ddPCR的原理是将微量DNA样品大倍数稀释和分液,使其分布在一定数目的微滴中,微滴中每个样品中的待测分子数不超过1,再将所有样品进行PCR扩增,对发生了反应的样品计数,并根据泊松分布计算DNA分子进行定量[7].为了快速、准确地检测和诊断HBoV,本研究建立了HBoV ddPCR检测方法并对临床鼻咽分泌物咽拭子样本进行了检测.
1 材料与方法
1.1 材料和仪器
人博卡病毒阳性标本由武汉生物工程学院李毅教授实验室惠赠[8],呼吸道合胞病毒(RSV)、腺病毒(Adv)、鼻病毒(RV)、流感病毒A(H1N1)和巨细胞病毒(CMV),由武汉大学医学院病毒所保存.AxyPrep Body Fluid Viral DNA/RNA Miniprepkit试剂盒(爱思进),微滴数字PCR定量试剂盒(美国伯乐),引物(上海生工).
Nanodrop 2000C超微量紫外分光光度计(美国赛默飞),CFX96 Real-Time System PCR仪、QX100TM微滴式数字PCR仪(美国伯乐).
1.2 样本来源
选取2012年7月至2013年6月武汉大学中南医院儿科住院患儿鼻咽拭子样本182例,患儿年龄20 d至10岁,鼻咽拭子采集时间为入院2 d内;同时选取24例1个月至12岁健康体检儿童为对照.
1.3 病毒核酸的提取
根据DNA提取试剂盒的方法,提取临床标本总核酸,用50 μL的洗脱液洗脱,置于-80 ℃冰箱中保存.
1.4 引物及探针的设计
根据NCBI上检索的HBoV-sh9(NO:JN632519)基因序列,设计最佳引物和探针,序列见表1,探针为双荧光探针,5′ 端FAM报告基因,3′ 端TAMRA淬灭基因.

表1 HBoV引物和探针序列Tab.1 Primer and probe sequence for HBoV
1.5 HBoV ddPCR方法的建立
1.5.1 ddPCR扩增反应条件的优化
ddPCR方法的准确性与PCR扩增体系中的引物、探针浓度密切相关.为获得最佳ddPCR效果,对引物、探针浓度和扩增体系进行了优化. 将HBoV阳性标本进行普通PCR扩增[9],产物经测序证实后克隆入puc57载体制备了HBoV质粒标准品(puc57-HBoV)[10],根据其吸光度计算质粒标准品浓度为53.3 ng/μL,优化方法为以制备的HBoV质粒标准品(puc57-HBoV)为模板[10],选择55~60 ℃设置梯度退火温度,50~900 nM设置引物浓度,50~250 nM设置探针浓度,分别进行ddPCR反应,根据结果选择线性回归曲线最佳R2和浓度获得最大信号/背景比值的组合做为ddPCR反应体系建立的条件.
1.5.2 ddPCR反应体系和扩增程序
根据优化结果,确定ddPCR反应体系为:2×dd PCRTM Supermix for Probes 10 μL,DNA模板4 μL,900 nM引物1.8 μL,250 nM探针0.5 μL,纯水1.9 μL,共20 μL.将配制好的20 μL PCR反应液,转移至微滴发生卡样本孔中,再加入70 μL微滴发生油至油孔中,利用微滴生成器制备反应微滴.将每个样品的微滴分别转移至96孔PCR反应板中对应的反应孔中,在普通PCR仪上进行扩增.扩增循环条件和温度见表2.

表2 HBoV ddPCR循环程序
注:a检查调整升温速率为2 ℃/s;使用热盖设定为105 ℃,样品体积设置为40 μL
1.5.3 ddPCR反应定量分析方法
将PCR扩增后的96孔板放入数字PCR仪微滴分析器中,并在软件QuantaSoft上设定检测模式,检测FAM和HEX的荧光信号,结合泊松分布统计原理,由软件自动统计发生PCR反应的阳性微滴的比例,并对PCR反应体系中的起始模板进行定量.
1.5.4 ddPCR定量限
根据HBoV质粒标准品(puc57-HBoV)吸光度计算质粒标准品浓度为53.3 ng/μL,依次将质粒标准品进行10倍的梯度稀释,取10-5~10-9稀释样品4 μL作为ddPCR反应的模板,确定人博卡病毒微滴数字PCR定量限.
1.5.5 人博卡病毒ddPCR特异性检验
提取由武汉大学医学院病毒所保存的儿童易感病毒的基因组,包括:RSV,Adv,RV,H1N1和CMV引物序列见表3,按照上述优化条件进行检测,验证ddPCR扩增反应的特异性,同时设阴性对照(NTC)和阳性对照(阳性质粒).

表3 儿童易感病毒PCR引物序列
1.6 微滴数字PCR检测临床样本
利用所设计的引物、探针和建立的微滴数字PCR反应体系,对182例住院患儿咽拭子样本和24例健康儿童咽拭子样本,进行ddPCR检测,每个样本重复3次,另设有阴性对照(NTC)和阳性对照(阳性质粒).
2 结果与分析
2.1 ddPCR反应条件优化和检测定量限
根据1.5.1优化引物、探针浓度和退火温度,确定引物和探针最终浓度分别为900 nM和250 nM,退火温度为57 ℃.取4 μL 10倍梯度稀释HBoV质粒标准品作为模板,进行ddPCR反应,确定定量检测限,各样品稀释倍数与ddPCR检测HBoV拷贝数见图1.
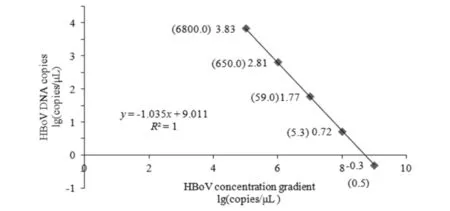
图1 HBoV微滴数字PCR定量限Fig.1 Limit of quantitation of droplet digital PCR for HBoV
由图1可知,HBoV的标准曲线为:y= -1.035x+ 9.011,R2=1, 表明样品模板浓度在0.5~6800 copies/μL,ddPCR具有良好的线性和精确度;HBoV的ddPCR定量限低至0.5 copies/μL样品ddPCR反应液,可用来进行未知样本的HBOV拷贝数定量检测.
2.2 ddPCR特异性检测
将RSV,Adv,RV,H1N1和CMV进行ddPCR方法特异性检测,编号分别为D01,D02,D03,D04和D05,结果表明:除了HBoV质粒标准品(puc57-HBoV)有特异性扩增外,5种病毒和NTC扩增结果均为阴性,表明建立的ddPCR扩增体系特异性高(见图2).

图2 HBoV ddPCR特异性检测微滴信号图Fig.2 ddPCR droplet signal diagram for HBoV specificity detection
2.3 临床样本检测
采用ddPCR方法对182例临床样本和24例健康对照组样本进行HBoV检测,结果见图3.由图3可见,182例临床样本检出15例阳性,阳性率8.24%,阳性样本在每次重复中均能稳定检测,拷贝数为(0.5±0.2)~(76.0±5.4)copies/μL,HBoV阳性样本的ddPCR定量结果和临床诊断见表4;阴性样本无微滴出现;在24例健康对照组样本的72次反应中,只有1个样品1次技术重复中有1个信号值相对较低的疑似阳性微滴,其他2次重复无疑似阳性微滴出现,可能为非特异性扩增或异常的荧光物质导致,表明健康对照组未发现HBoV感染(见图3d).

a)15例阳性样本; b)单例阳性样本图; c)部分阴性样本; d)24例健康对照组图3 临床样本HBoV ddPCR检测微滴信号图Fig.3 ddPCR droplet signal diagram for HBoV clinical samples detection
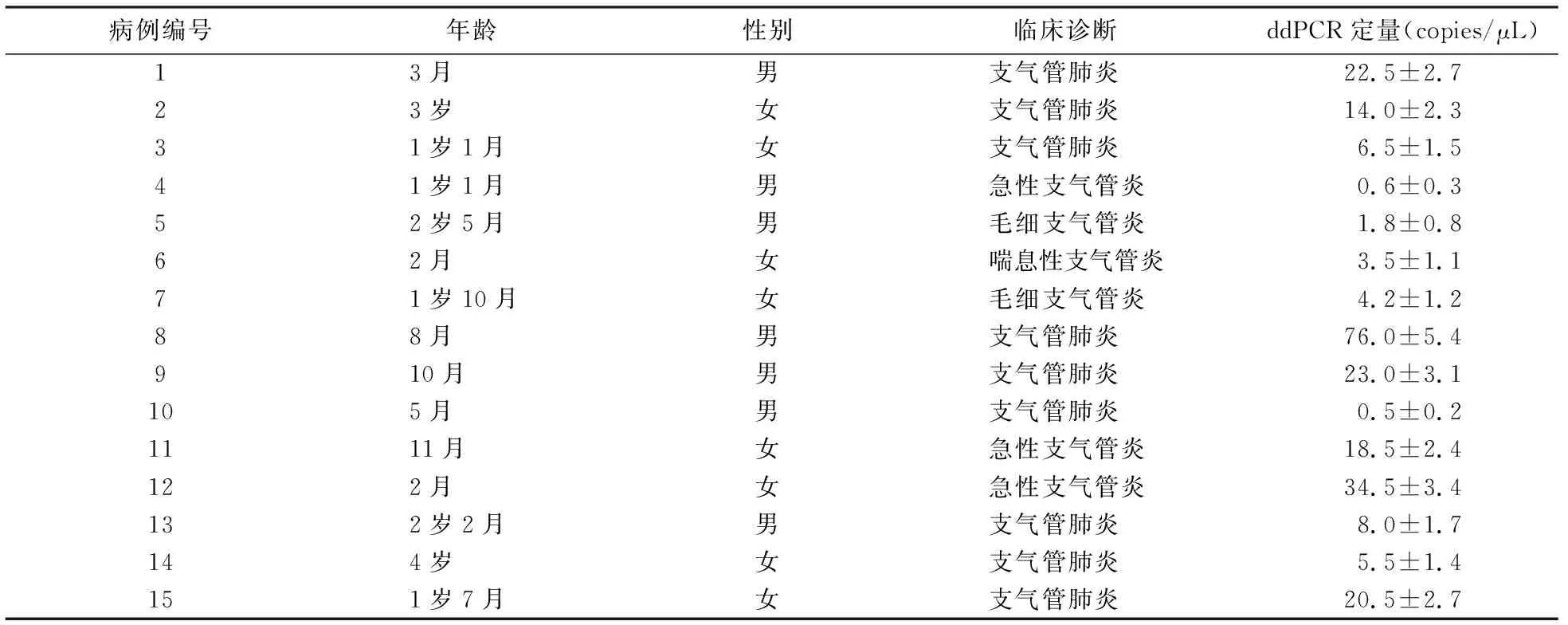
病例编号年龄性别临床诊断 ddPCR定量(copies/μL)13月男支气管肺炎22.5±2.723岁女支气管肺炎14.0±2.331岁1月女支气管肺炎6.5±1.541岁1月男急性支气管炎0.6±0.352岁5月男毛细支气管炎1.8±0.862月女喘息性支气管炎3.5±1.171岁10月女毛细支气管炎4.2±1.288月男支气管肺炎76.0±5.4910月男支气管肺炎23.0±3.1105月男支气管肺炎0.5±0.21111月女急性支气管炎18.5±2.4122月女急性支气管炎34.5±3.4132岁2月男支气管肺炎8.0±1.7144岁女支气管肺炎5.5±1.4151岁7月女支气管肺炎20.5±2.7
3 讨论
在我国,HBoV流行病学特征与国外报道类似,呼吸道感染者HBoV的感染率为1.4%~19.3%[11],但目前对HBoV的检测还存在着诸多问题.林峰和Dijkman R等[12,13]采用人类假复层上皮细胞,成功培养了HBoV,但细胞成本高昂、来源困难,且实验周期长、对标本的运输和存储条件要求高、培养阳性率低,难以满足临床检测的要求.目前对HBoV的分子结构、免疫原性、免疫反应等尚不完全清楚,制备HBoV单克隆抗体过程复杂、成本高昂、缺乏合适的动物模型,难以检测特异抗体.而免疫印迹技术因价格昂贵、实验制备过程复杂、技术难度大、干扰因素较多等,使对HBoV VP2 蛋白抗体的检测运用临床受限[14,15].巢式PCR(Nest-PCR)特异性强,但此技术操作复杂,不能定量,临床检测受限.
实时荧光定量PCR应用广泛,但检测时间长,必须依赖标准曲线才能定量[16].目前,新一代ddPCR迅速发展成为一种替代方案,近年不少报道证实了其理论上更高的精确度,能广泛运用于临床样本检测[17-19].Choi J H等[4]利用real-time PCR方法检测HBoV其定量限为5 copies/μL);Lu X等[5]建立Taqman PCR方法检测HBoV定量限为2 copies/μL.本实验结果表明:ddPCR无需标准曲线即可确定靶分子的起始浓度或拷贝数,能有效检测HBoV含量低至(0.5±0.2) copies/μL的临床样本,阳性样本拷贝数范围是(0.5±0.2)~(76.0±5.4)copies/μL,HBoV感染的阳性率为8.24%.可见ddPCR方法在检测低含量病毒核酸序列具有更高的灵敏度,不受样品基质和扩增效率的影响,对于满足临床精准检测要求更具优势.
综上所述,本研究建立了HBoV的ddPCR检测方法,具有更低的定量限,能够快速、精确地定量检测出儿童咽拭子标本中的HBoV,对HBoV等低丰度病毒的诊治提供了更为迅速、准确的检测和研究方法.

