PD-1/PD-L1在食管鳞状细胞癌中的表达及临床意义*
李琦,李涛,范羽,吕家华,袁道足
610041 成都, 四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 放疗科
食管癌在全球癌症相关性死亡原因中位居第5,我国食管癌的死亡率仅次于肺癌、肝癌、胃癌排第4位[1],其中以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主,约占90%[2]。目前食管癌的治疗效果较差,单纯手术后的患者5年生存率仅为20%~30%[3]。B7家族的程序性死亡配体-1(programmed cell death-ligand 1,PD-L1)是近年来肿瘤免疫治疗研究的新热点,程序性死亡受体-1(programmed cell death-1,PD-1)是一种Ⅰ型跨膜糖蛋白,属于协同刺激信号分子CD28家族的成员。PD-1在激活状态下的T淋巴细胞及B淋巴细胞中表达上调[4-6]。PD-L1是PD-1的主要配体,研究还发现在非小细胞肺癌、头颈部鳞癌、食管癌、肝癌等肿瘤细胞上也有PD-L1的表达[7-10],且肿瘤细胞中PD-L1的表达比正常组织中更高。有研究报道检测到PD-1在肝癌及乳腺癌[11]肿瘤细胞上表达,但还未有研究检测到PD-1在食管癌中的表达。另外,目前许多研究检测到PD-L1在食管鳞癌中的表达率高低不一,其表达高低与患者预后的关系仍有争议。故本文旨在检测PD-1及PD-L1在食管鳞癌病理组织上的表达水平,并探索此二者与患者预后的关系。
1 材料与方法
1.1 临床资料
收集四川省肿瘤医院2012年1月至2013年12月期间收治的87例经内镜活检病理确诊的初治食管鳞癌患者临床资料,具体见表1。患者年龄43~86岁,中位年龄62岁。纳入标准:a.治疗前行内窥镜活检,病理确诊为ESCC;b.均为初次治疗,拒绝或不适合行手术,在我院行单纯放射治疗或同步放化疗;c.放射治疗前、后患者均已行胸部增强CT扫描和食管钡餐造影检查;d.接受的放射总剂量均≥60Gy[12];e.患者无其他系统(如心、肺、肾、脑等)严重合并症,无放疗禁忌症;f.放疗前卡氏评分(KPS评分)均≥70分。排除标准:a.治疗前未病理确诊或病理确诊为非食管鳞状细胞癌患者;b.非初治或未行放疗的患者、行手术治疗的患者;c.治疗前后未行影像学检查的患者;d.接受的放射总剂量<60Gy;e.患者有严重合并症或放疗禁忌症;f.放疗前卡氏评分(KPS评分)<70分。
诊断标准:按AJCC/UICC 2009年第7版食管癌TNM分期。
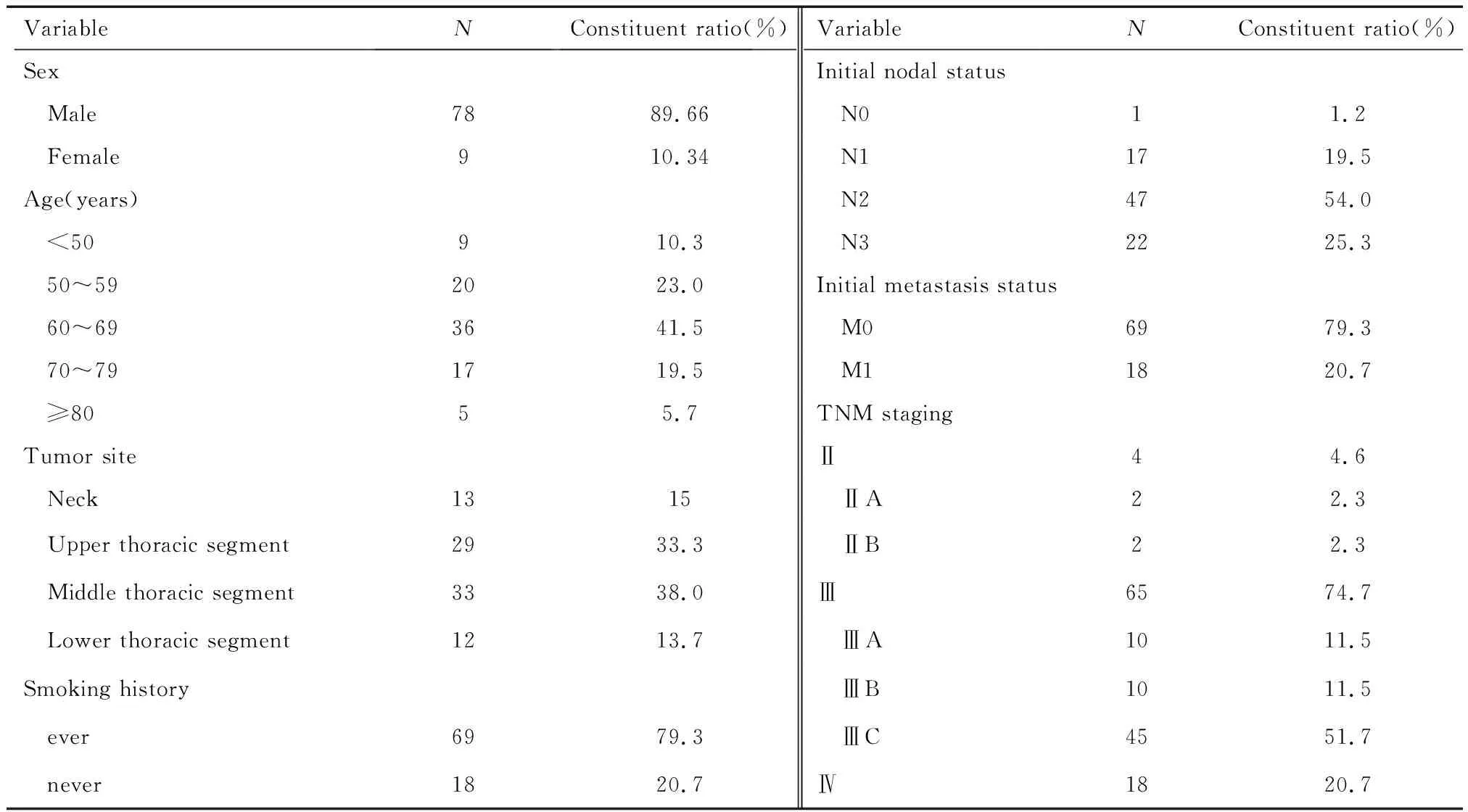
表1 87例食管鳞癌患者临床资料Table 1 Clinical data of 87 cases of ESCC
(TBC)
aRT:radiotherapy;bCCRT:concurrent chemoradiotherapy
1.2 治疗方式
放疗:单纯放疗组和同步放化疗组的放疗方案完全相同,采用IMRT或IGRT放疗,针对病灶2Gy/天,每周5天,接受放射总剂量均≥60Gy。化疗采用TP方案,具体剂量为:顺铂25mg/m2,d1-3 +紫杉醇135mg/m2,d1或多西他赛75mg/m2,d1,静脉滴注 ,每21天一个周期,2~6个周期,中位数2个周期。
1.3 病理检查
87例患者的食管鳞癌病理标本均经过HE制片及免疫组化染色检测PD-1和PD-L1的表达水平,抗体购自(北京中杉金桥生物科技有限公司)。免疫组化具体操作参见试剂盒说明书进行。免疫组化结果由2名高级职称病理科医师按照组织化学评分(histochemistry score,H-Score)标准[13]进行独立观察评估,将评分的结果进行Kappa一致性分析。
1.4 疗效评价
治疗前、治疗中及治疗后1月复查胸部增强CT及上消化道造影。结合影像学检查结果按照新版实体瘤疗效评价标准:修订的RECIST1.1(response evaluation criteria in solid tumors vision 1.1)指南评价近期疗效。
1.5 随访
电话随访患者的生存情况及其他相关信息,所有病例的随访截止日期为2017年1月。
1.6 统计学方法
应用SPSS17.0统计软件,使用卡方检验、Fisher精确检验、Logistic回归、Kaplan-Meier生存分析、Log-rank检验以及Cox比例风险回归模型等方法进行统计分析,P<0.05认为差异有统计学意义。
2 结 果
2.1 病理结果
将正常扁桃体组织中PD-1的表达作为阳性对照。PD-1/PD-L1免疫组化染色在食管鳞癌组织中细胞膜上表达。本研究的所有食管鳞癌细胞标记PD-1(-);有50例食管鳞癌细胞标记PD-L1(+),其表达率为57.5%。使用X-tile软件计算PD-L1免疫组化结果得出其cut-off值为3分,即总得分≤3分为低表达,总得分>3分为高表达。本研究中PD-L1表达大于cut-off值患者共25例,即高表达率为28.7%。(图1、图2)。
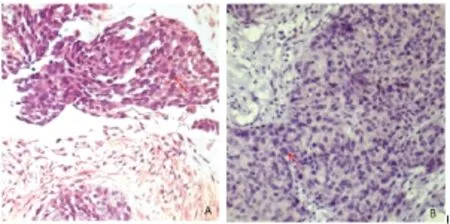
图1 食管鳞状细胞癌HE染色及PD-1免疫组化(40×)Fig. 1 HE staining and immunohistochemical staining of PD-1 in ESCC tissues(40×)A:HE staining of tumor cells(as indicated by the arrow); B:Negative immunoreactivity in tumor cells(as indicated by the arrow)
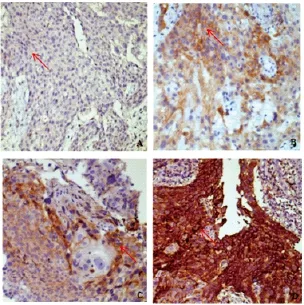
图2 食管鳞状细胞癌PD-L1免疫组化(40×)Fig. 2 Immunohistochemical staining of PD-L1 in ESCC tissues(40×) A:Low expression of PD-L1 in tumor cells(as indicated by the arrow); B、C、D:High expression of PD-L1 in tumor cells(as indicated by the arrow)
2.2 PD-L1在食管鳞状细胞癌中的表达及其与临床特征的关系
使用SPSS统计软件统计PD-L1表达高低与食管癌一般临床特征的关系,统计结果见表2。分析得出有远处转移的食管癌PD-L1高表达率为55.6%,明显高于无远处转移的食管癌(21.7%),两组间差异有统计学意义(P=0.005)。
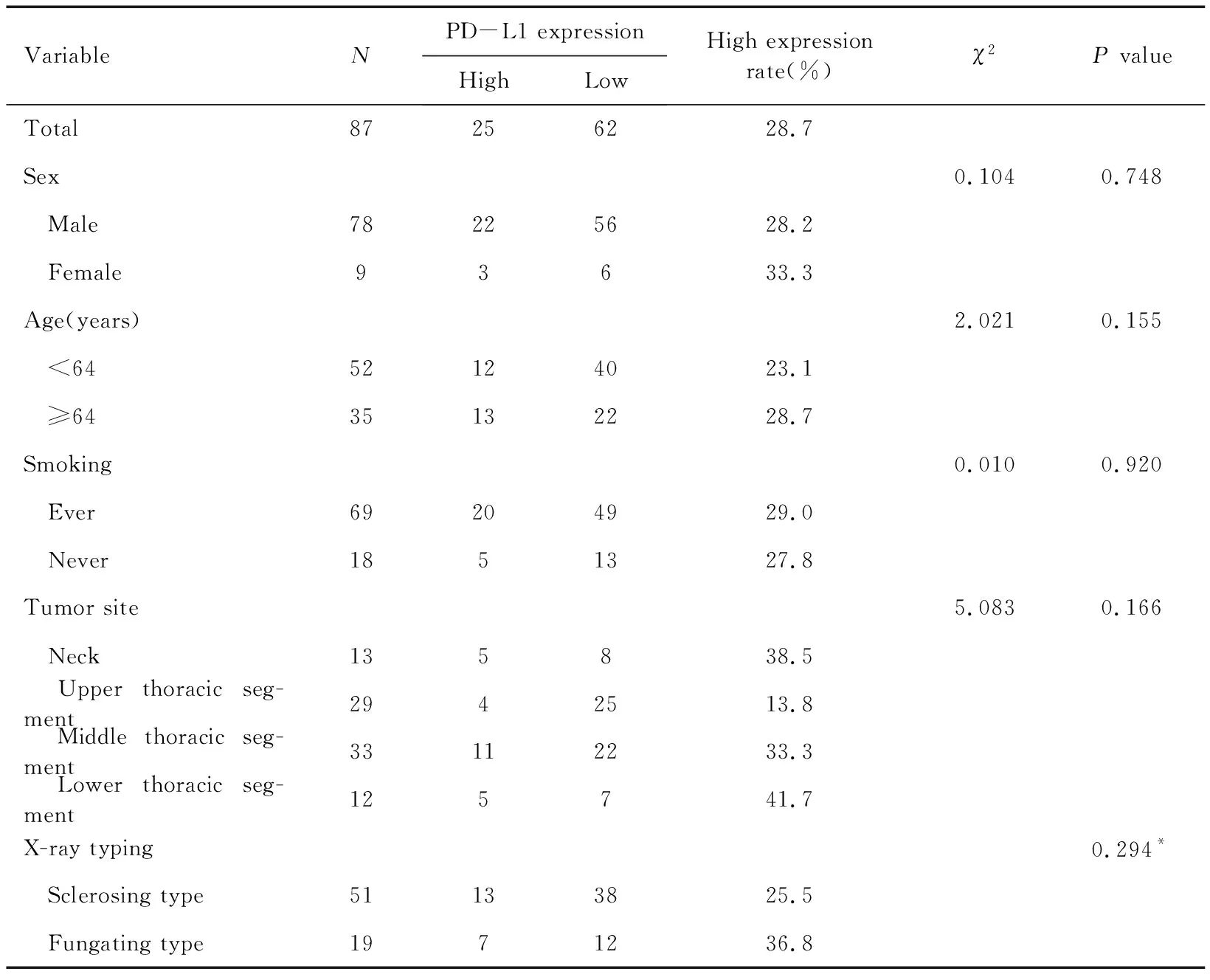
表2 PD-L1表达与食管鳞癌临床病理特征的关系Table 2 Relationship between PD-L1 expression and clinicopathological features of ESCC
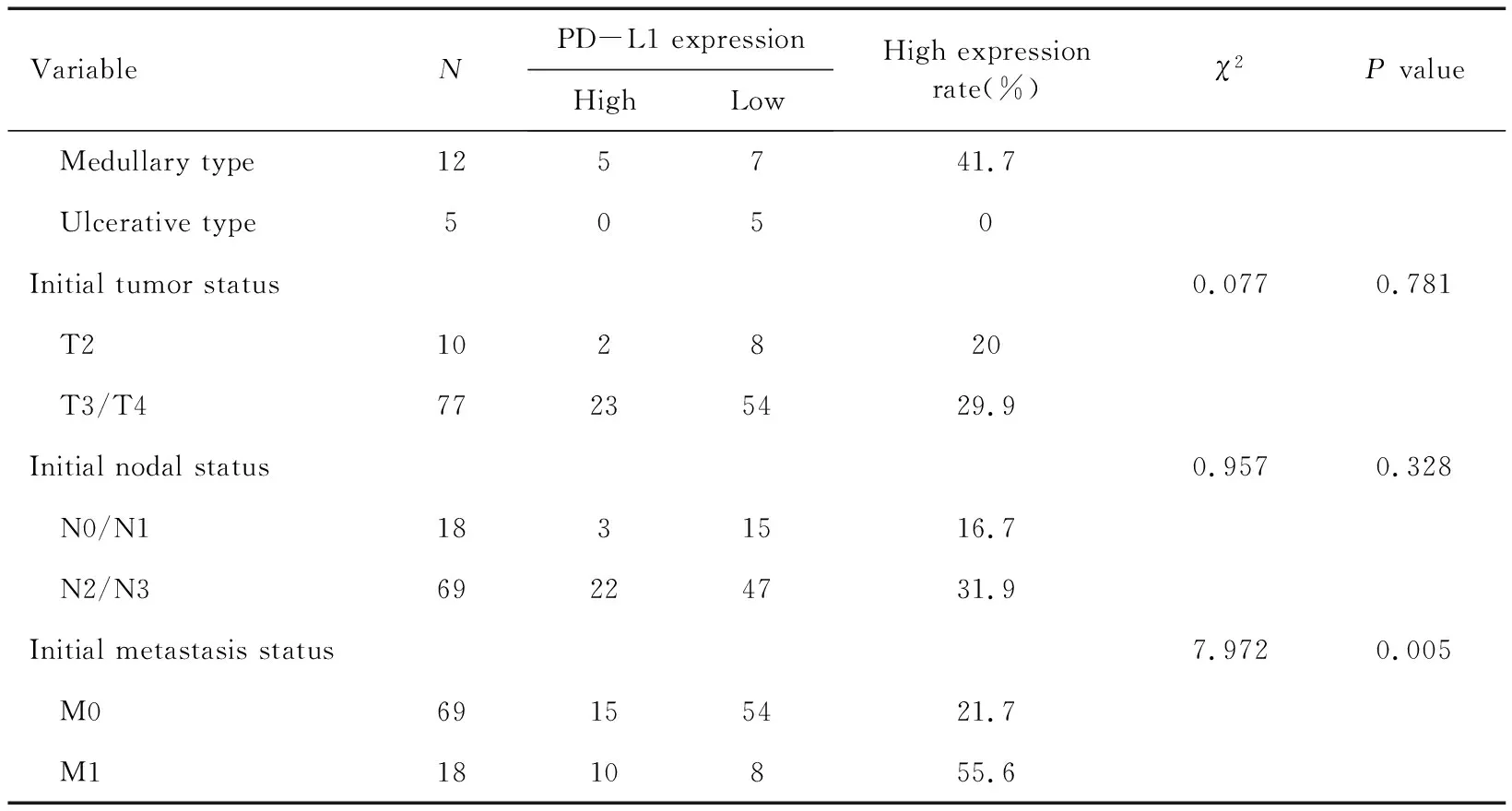
(TBC)
*Fisher’s exact test is used
2.3 不同临床因素与食管癌近期疗效的相关性分析
在食管鳞癌患者完成放疗后,以肿瘤客观缓解率评价近期疗效。全部87例食管鳞癌患者在放疗前、放疗结束时以及放疗结束后1个月分别行胸部增强CT扫描和食管钡餐造影检查,根据检查结果进行疗效评价,各临床指标与食管癌近期疗效的单因素分析见表3。
表3各临床病理指标与食管鳞癌放疗后近期疗效的单因素分析结果
Table 3 Clinico-pathological indexes and results of single factor analysis of clinical efficacy and short-term curative effect of radiotherapy for ESCC
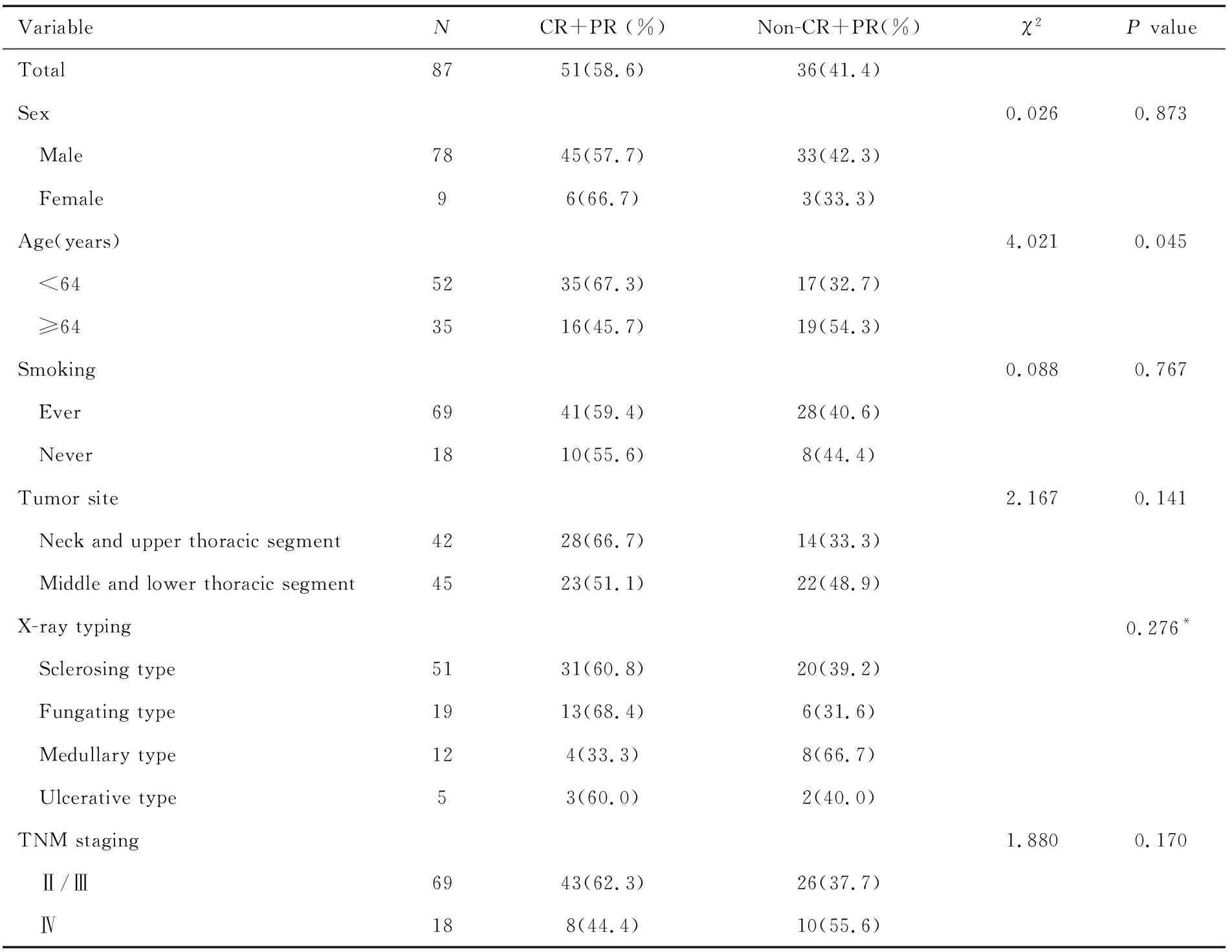
VariableNCR+PR (%)Non-CR+PR(%)χ2P value Total8751(58.6)36(41.4) Sex0.0260.873 Male7845(57.7)33(42.3) Female96(66.7)3(33.3)Age(years)4.0210.045 <645235(67.3)17(32.7) ≥643516(45.7)19(54.3)Smoking0.0880.767 Ever6941(59.4)28(40.6) Never1810(55.6)8(44.4)Tumor site2.1670.141 Neck and upper thoracic segment4228(66.7)14(33.3) Middle and lower thoracic segment4523(51.1)22(48.9)X-ray typing0.276* Sclerosing type5131(60.8)20(39.2) Fungating type1913(68.4)6(31.6) Medullary type124(33.3)8(66.7) Ulcerative type53(60.0)2(40.0) TNM staging1.8800.170 Ⅱ/Ⅲ6943(62.3)26(37.7) Ⅳ188(44.4)10(55.6)
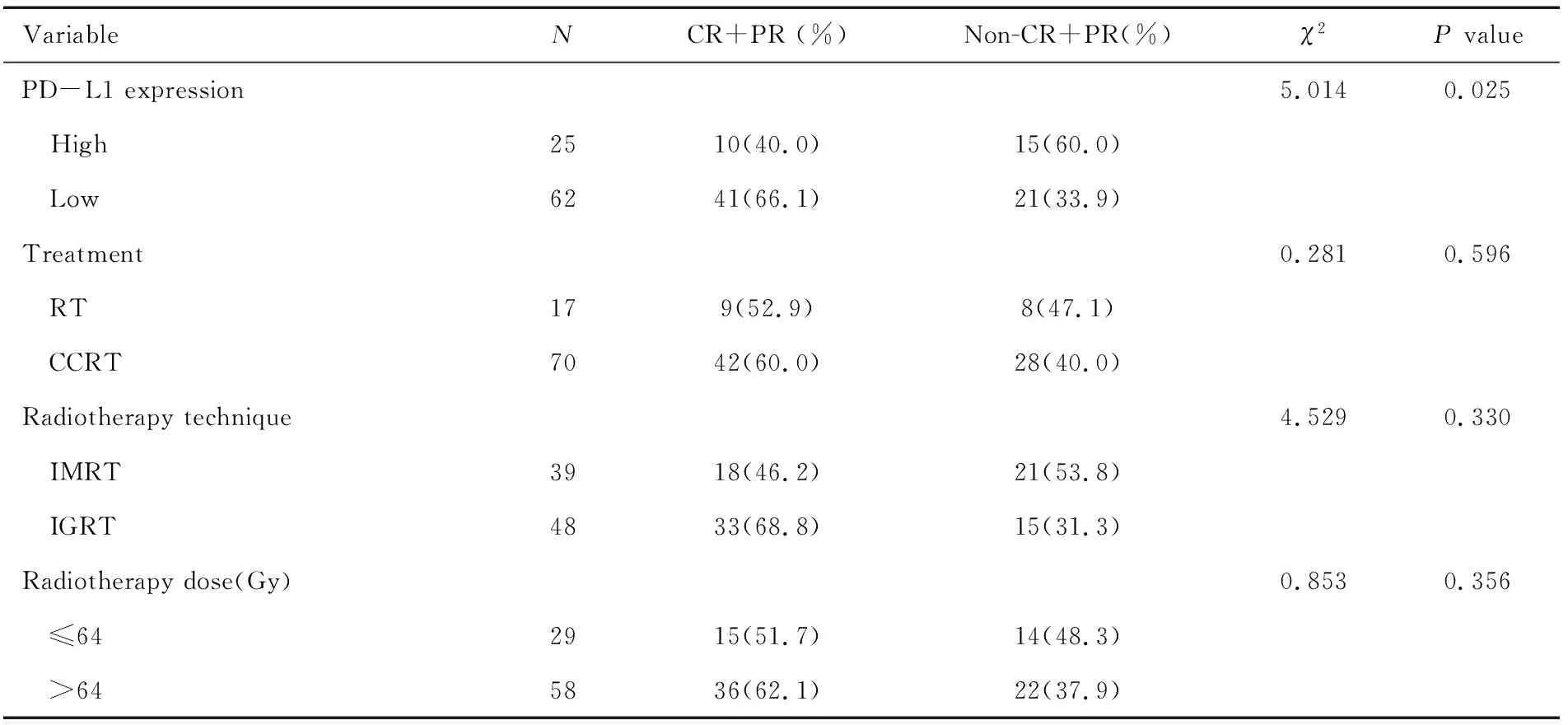
(TBC)
*Fisher’s exact test is used
通过卡方检验和Fisher精确检验对各临床特征与近期疗效的单因素分析的结果显示,年龄及PD-L1表达水平与食管癌放疗后近期疗效具有相关性。将年龄和PD-L1表达水平纳入二分类Logistic回归模型分析结果显示:PD-L1低表达食管癌患者的近期疗效比PD-L1高表达患者更好。详见表4。
2.4 不同临床因素与食管癌总生存期的相关性分析
2.4.1 随访 87例食管鳞癌患者随访至2017年1月,失访2例,随访率为97.7%。截止随访日期有15例患者仍生存,随访时间6~60个月,中位随访时间38个月,中位总生存时间为14个月。
2.4.2 食管鳞癌治疗预后单因素分析 通过Kaplan-Meier生存分析及Log-rank检验分析各临床因素及治疗指标对食管鳞癌治疗后总生存时间(overall survival,OS)产生的影响,详见表5。结果显示:年龄、PD-L1表达、肿瘤部位、治疗方式、TNM分期和近期疗效与食管癌治疗预后有关。
表4食管鳞癌放疗近期疗效的影响因素的参数估计值及检验
Table 4 Estimated parameters and test of influencing factors of short-term effects of radiotherapy for ESCC
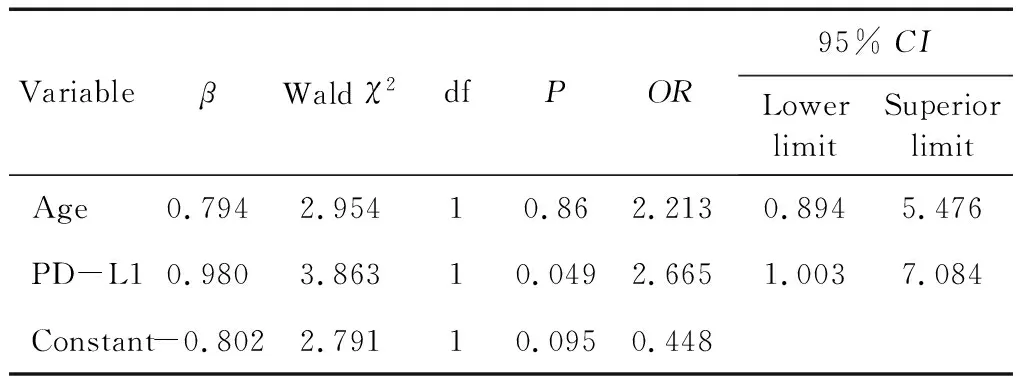
VariableβWald χ2dfPOR95% CILower limitSuperior limitAge0.7942.95410.862.2130.8945.476PD-L10.9803.86310.0492.6651.0037.084Constant-0.8022.79110.0950.448
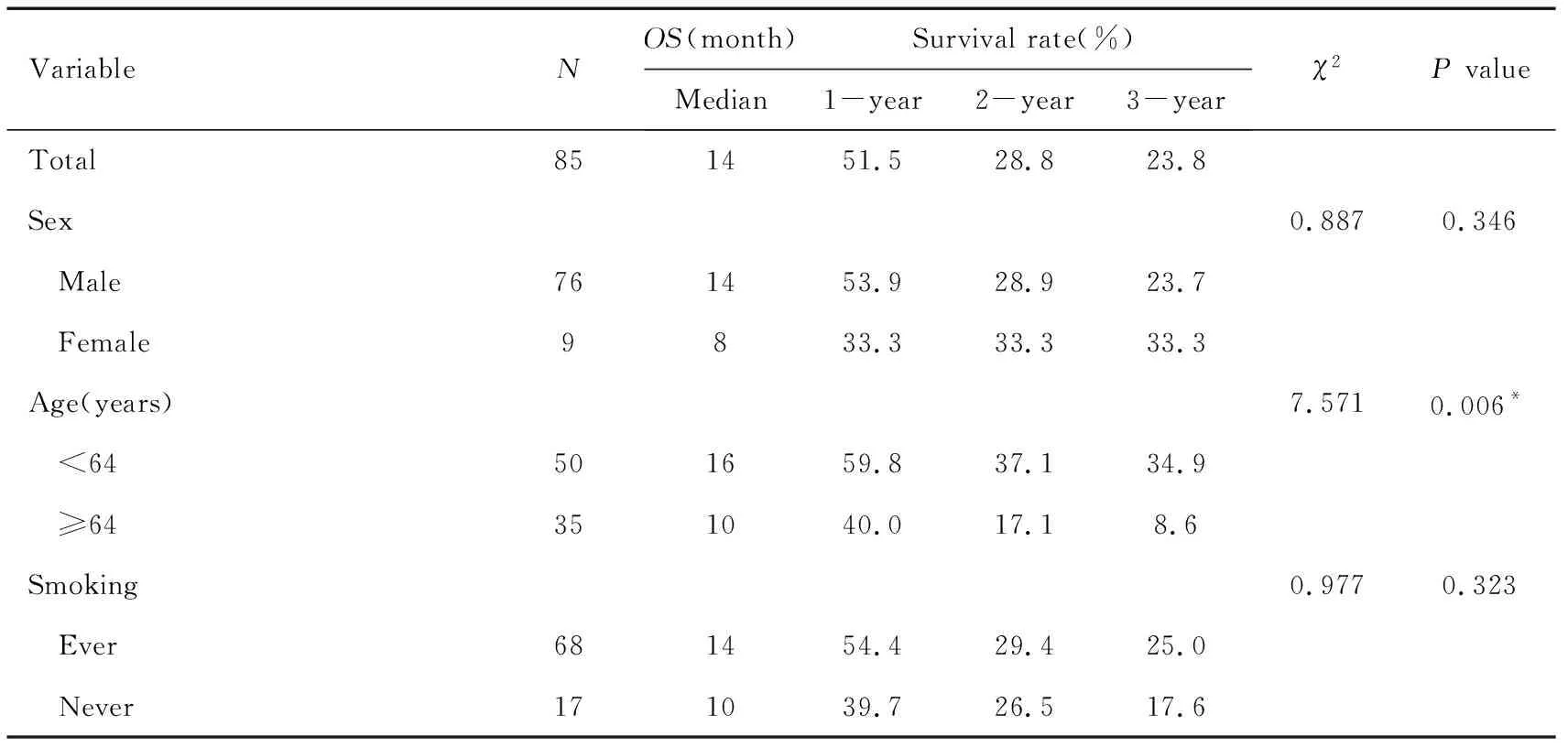
表5 临床因素及治疗指标对食管鳞癌预后影响的单因素分析Table 5 Single factor analysis of the effects of clinical factors and treatnsent indicators on prognosis of ESCC
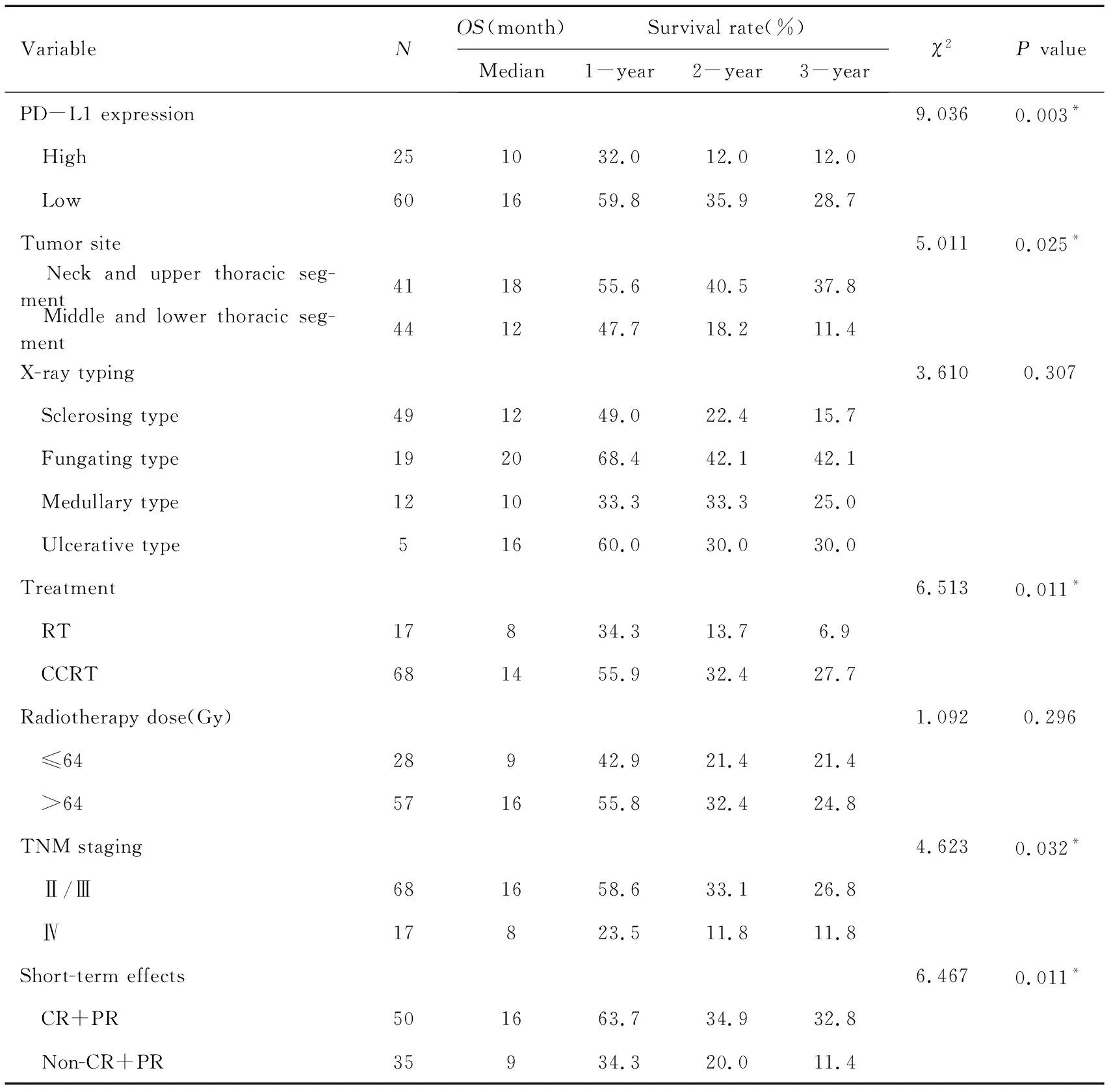
(TBC)
2.4.3 食管鳞癌治疗预后多因素分析 将对预后影响有意义的单因素均纳入Cox回归模型,分析多因素对预后的影响,分析结果可见,年龄是影响食管鳞癌生存预后的独立因素(P=0.018);同时,PD-L1也是影响食管鳞癌生存预后的独立因素(P=0.043),其相对危险度HR=1.587,说明PD-L1高表达的患者死亡风险为PD-L1低表达的患者的1.587倍,详见表6。
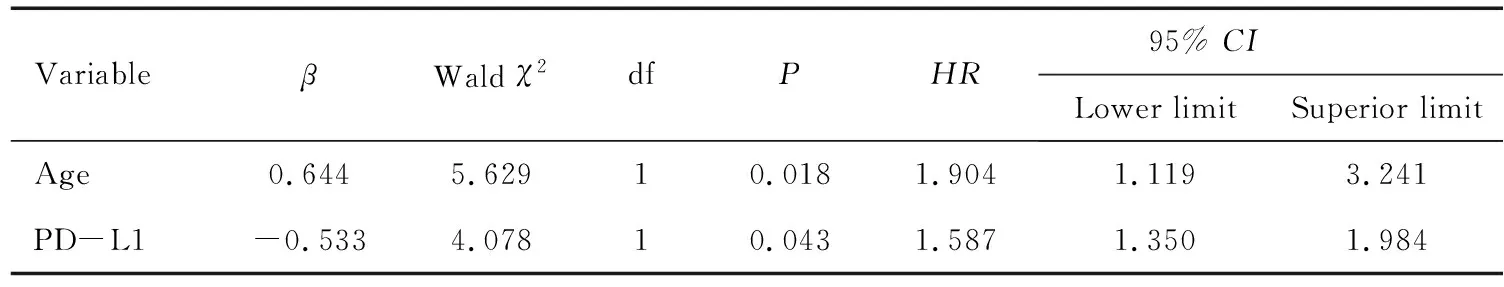
表6 影响食管鳞癌生存的Cox多因素分析Table 6 Cox multivariate analysis for the survival of patients with ESCC
3 讨 论
本研究采用了免疫组织化学的方法对87例食管鳞癌组织中的PD-1和PD-L1的表达水平进行了检测,结果显示,食管鳞癌组织中未检测到PD-1表达。Chen等[14]研究食管鳞癌时也未在肿瘤细胞上检测到PD-1表达,而在肿瘤间质淋巴细胞上可检测到PD-1表达,考虑原因与PD-1多表达于活化的T、B细胞有关;但也有研究报道PD-1在其他肿瘤细胞上有表达:张勇等[15]采用组织芯片研究肝癌患者时,在肝癌组织及癌旁组织上均检测到PD-1的表达。因有相关研究提示肝细胞可诱导淋巴细胞上PD-1表达上调,故张勇等的研究与本实验结果存在差异考虑原因与此有关。另外,赵文健等[11]在研究乳腺癌时也检测到PD-1在肿瘤细胞的表达。本研究采用的组织标本未检测到PD-1的表达,这是否与采用的组织标本是内镜下取得的,标本组织较小,所含肿瘤组织少有关,还需后续研究进一步证实。
PD-L1在食管鳞癌组织中的表达率为57.5%,其中大于cut-off值的高表达率为28.7%,结果与文献报道基本相符合:Hatogai等[16]采用免疫组化检测了196例食管癌组织标本中的PD-L1的表达水平,得出其高表达率为18.4%;Kim等[17]对200例食管鳞癌手术标本行免疫组化检测得出PD-L1高表达率为33.5%;Ohigashi[18]及Chen等[14]用免疫组化法分别检测41例及536例食管鳞癌组织上PD-L1的表达水平,得出其高表达率分别为43.9%和41.4%。目前大部分研究均采用免疫组织化学法检测肿瘤组织上PD-L1表达,得出的PD-L1表达结果参差不齐,可能与不同的研究中免疫组化检测的准确性有关。而影响免疫组化准确性的因素主要有以下几点:首先,不同研究中使用抗体的敏感性不同;其次,不同研究中,PD-L1染色阳性的标准不同;另外,PD-L1在肿瘤中表达不均匀,取样时间和部位都可能影响PD-L1染色的结果[19]。为了尽量减少以上因素对免疫组化结果准确性的影响,未来可通过多个平台进行统一抗体选择,规定染色阳性标准等多种手段提高测量的标准化,增加各项研究间的可比性。同时,下一步的研究中将通过更多种的检测手段来测定PD-L1的表达水平。
本研究结果提示,有远处转移的食管鳞癌PD-L1高表达率为55.6% 无远处转移的食管癌PD-L1高表达率为21.7%,且差异有统计学意义。在肿瘤微环境中,PD-1/PD-L1信号通路激活可使T细胞免疫效应降低,介导肿瘤免疫逃逸,促使肿瘤在原发部位及转移部位生长。另外,有研究者提出PD-1/PD-L1信号通路可影响CD4+CD25+Foxp3+(Forkhead Box P3+,叉状头螺旋转录因子)的分化,PD-L1通过上调第10号染色体同源丢失性磷酸酶-张力蛋白基因(phosphatase and tension homology deleted on chromosome ten,PTEN)及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、PKB、S6激酶(S6 kinase,S6)和细胞外调节蛋白激酶2(extracellular regulated protein kinases 2,ERK2)的磷酸化,促进调节性T细胞的产生,通过抑制机体抗肿瘤免疫反应,促进肿瘤的免疫逃逸。Chen[14]等通过免疫组化检测得出食管癌组织中PD-L1表达与肿瘤浸润深度显著相关。小鼠实验证明在肿瘤发生过程中,PD-L1能促进肿瘤细胞中Slug和Twist转录因子的表达,使上皮细胞间质化过度发生,促进肿瘤细胞获得迁移能力,导致肿瘤的侵袭和转移。综合上述研究结果可知:PD-L1高表达的患者更容易发生远处转移。
近期疗效是用于评估治疗中及治疗后近一段时间肿瘤消退情况的指标,可直接反映肿瘤治疗的近期效果。本研究中所有患者在治疗后近期疗效中的客观有效率与患者的年龄大小及PD-L1的表达水平有关。年龄<64岁的食管鳞癌患者的客观有效率明显高于年龄≥64岁的食管鳞癌患者(P=0.045);PD-L1高表达组的客观有效率明显低于PD-L1低表达组(P=0.025)。食管癌近期疗效好的患者不一定预后就好,这与食管癌的易复发及易转移特性有关。但是将近期疗效用于食管癌患者的评估仍然有重要意义,因为肿瘤的明显消退可以改善患者的进食梗阻症状,从而通过改善患者的营养状况,增强机体免疫功能,提高患者的生活质量。
本研究多因素分析结果提示,年龄与食管鳞癌预后呈负相关(P=0.018),PD-L1高表达的食管鳞癌患者预后更差(P=0.043)。年龄和PD-L1表达水平均是食管鳞癌的独立预后因素。Loos等[20]通过101例食管癌标本的免疫组化实验也得出相同结论。大量研究得出,PD-1/PD-L1信号通路与肿瘤的发生发展有密切联系:PD-L1可以通过传递负性调控信号抑制活化T细胞的增殖,诱导T细胞功能耗竭,使机体免疫反应受到抑制,促使肿瘤细胞逃脱免疫监控。本研究中也揭示了食管鳞癌上PD-L1表达与远处转移有关;同时,与食管鳞癌患者的预后也有一定联系。Ohigashi等[18]通过对食管鳞癌中PD-L1表达与患者总生存关系的研究,分析得出PD-L1表达与分期晚、有淋巴结转移及远处转移的患者的预后显著相关,且PD-L1状态是一个独立预后因素,本研究结果也与上述结论相符。但也有不同的观点的存在,Jiang等[21]通过对278例食管鳞癌标本进行免疫组化研究发现:在Ⅰ、Ⅱ期及无淋巴结转移的情况下,肿瘤PD-L1表达是患者的独立预后因素,而在Ⅲ、Ⅳ期及有淋巴结转移的情况下,PD-L1表达不是独立预后因素。该实验得出的不同结论,考虑其与不同研究中研究者对于PD-L1表达cut-off值的选取,即对于PD-L1高表达的判定标准有关。此外,Topalian等[22]提出PD-L1的阳性表达能反映免疫反应状态,可提示更好的总生存。Hatogai等[16]等采用免疫组化检测了196例食管癌组织标本中的PD-L1表达水平,发现食管癌肿瘤细胞PD-L1阳性表达率为18.4%,得到PD-L1在肿瘤细胞上的表达与总体生存率呈正相关的结论。该实验提出,在肿瘤发生时,活化T细胞诱导PD-L1表达,肿瘤细胞周围出现大量炎性浸润细胞如CD8+、PD-1+细胞,PD-1和PD-L1的表达可反映机体的免疫反应水平,将其作为良好预后的指标。这与前文研究结果不一致,考虑是因为免疫检查点调节器在免疫抑制通路中同时发挥着正负两方面的作用,而PD-L1在T细胞的免疫反应中也有双重作用,即共刺激性和共抑制性:共刺激性是指PD-L1升高后,可以刺激机体的初级T细胞增殖分化;共抑制性是指PD-L1可以通过传递负性调节信号抑制活化T细胞的增殖,诱导T细胞功能耗竭,甚至促使T细胞凋亡。
大量研究结果显示,肿瘤细胞PD-L1高表达提示预后不良。PD-L1可能会成为一个判断肿瘤预后的新指标,进而成为肿瘤免疫治疗的新靶点,临床上也可通过检测肿瘤患者PD-L1的表达状态,筛选出部分高风险、疾病预后差的患者,对其进行的有效治疗,最大程度延缓疾病进展,延长患者的生命。
目前免疫治疗已成为肿瘤治疗新的研究热点,近年来大量研究得出,PD-1/PD-L1信号通路与肿瘤的发生发展有密切联系。PD-1/PD-L1抗体在非小细胞肺癌、恶性黑色素瘤等肿瘤的治疗上也有了较好的成果。目前食管鳞癌组织中可测出PD-L1的表达,本研究也证实了PD-L1的高表达与食管鳞癌患者的预后呈负相关,这些研究均为将抗PD-1/PD-L1用于食管鳞癌的免疫治疗提供了理论依据,虽然还需要进一步的临床研究来证实其疗效,但这也在食管鳞癌的治疗方法上,除传统的手术、放疗、化疗等外,为临床工作者提供了新的思路。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。

