以脊髓病变为突出表现的干燥综合征:1例报告及文献复习
上海交通大学医学院附属仁济医院神经内科,上海 200127
1 病例报告
患者,男性,74岁。因“双下肢无力麻木、二便困难半年,加重1周”于2018年6月10日在上海交通大学医学院附属仁济医院神经内科接受住院诊治。
患者于2017年11月无明显诱因下出现双脚麻木,伴有二便难解,起初未予重视;至2018年3月,自感上述症状加重,并逐渐出现剑突以下感觉减退,伴双下肢乏力和行走困难。2018年3月28日患者于外院就诊,脊髓磁共振成像(magnetic resonance imaging,MRI)平扫+增强检查显示颈段及胸段脊髓弥漫性病变,考虑炎症可能性大;腰椎穿刺脑脊液检查结果显示脑脊液中蛋白含量为1 130 mg/L;血清和脑脊液中视神经脊髓炎(neuromyelitis optica,NMO)/水通道蛋白4(aquaprorin-4,AQP4)抗体免疫球蛋白(immunoglobulin,Ig)G、抗髓磷脂碱性蛋白(myelin basic protein,MBP)抗体IgG、抗髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体IgG、血清副瘤综合征相关抗体检测均为阴性;脑脊液脱落细胞学未见肿瘤细胞。患者在外院接受丙种球蛋白和甲泼尼龙琥珀酸钠对症治疗以及神经营养支持治疗,症状较前好转;出院后口服甲泼尼龙片40 mg/d,2周后停药。
患者本次入住上海交通大学医学院附属仁济医院神经内科前1周,无明显诱因下出现胸部以下束带感,且肢体麻木较前略加重。
入院后追问病史,患者既往有高血压史,平素服用氨氯地平片控制血压;有肺气肿、慢性阻塞性肺病史;否认其他慢性病史;否认肝炎、结核等传染病史;无外伤史、手术史、输血史;否认食物及药物过敏史;否认吸烟史、酗酒史;否认有药物嗜好;否认疫水接触史,否认疫区久居史。目前已退休,既往工作中无工业毒物、粉尘、放射性物质接触史。近半年来体质量减轻15 kg。入院前1周内,精神尚可,睡眠尚可,食欲正常,二便正常。
入院时常规体格检查结果:体温为36.3 ℃,脉搏为72次/min,呼吸频率为17次/min,收缩压为156 mm Hg(1 mm Hg=0.133 kPa),舒张压为74 mm Hg;无其他内科系统查体异常。神经系统查体结果:神志清晰,构音清晰;双侧瞳孔等大等圆,直径为0.3 cm,双侧瞳孔对光反射(+++);鼻唇沟对称,伸舌居中;咽反射正常;颈软,四肢肌张力正常,颈屈肌力Ⅳ级,双上肢肌力Ⅴ级,左下肢近端肌力Ⅳ+级,右下肢近端肌力Ⅴ-级,双下肢远端肌力Ⅴ级;剑突以下针刺觉减退;四肢腱反射未引出,左侧巴宾斯基征(+)、反巴宾斯基征(+),右侧巴宾斯基征(±)、反巴宾斯基征(+),双侧凯尔尼格征(-)。
实验室检查结果如下。(1)腰椎穿刺脑脊液检查结果:脑脊液压力为16 cm H2O(1 cm H2O=0.098 kPa);脑脊液中未见白细胞和红细胞,蛋白含量为490.0 mg/L(参考值范围:150~450 mg/L);脑脊液中IgG为98.1 mg/L(参考值范围:0~34 mg/L)、IgA为11.2 mg/L(参考值范围:0~5 mg/L)、IgM为3.1 mg/L(参考值范围:0~1.3 mg/L),均高于正常值上限;脑脊液IgG局部合成率为31%,提示中枢鞘内合成;脑脊液中可见多条IgG寡克隆区带;脑脊液中氯含量稍低,为114.0 mmol/L(参考值范围:120~132 mmol/L);脑脊液中糖含量为3.32 mmol/L(参考值范围:2.5~4.5 mmol/L),位于正常范围内;脑脊液革兰染色、抗酸染色、墨汁染色结果均为阴性;脑脊液副瘤综合征相关抗体、脱髓鞘相关抗体及自身免疫性脑炎相关抗体均为阴性。(2)自身免疫相关抗体检查结果:抗核抗体谱检测为核颗粒型,效价为1︰80,其中抗SSA/Ro-52为60,有阳性意义;其余抗Sm、抗U1RNP、抗SSA/Ro-60、抗SSB/La、抗Jo-1、抗Sc1-70、抗核糖体P蛋白、抗组蛋白抗体、抗着丝点蛋白B、抗PM-ScI抗体、抗增殖细胞核抗原、抗ds-DNA、抗核小体、抗线粒体抗体M2型检测结果均为阴性。此外,抗“O”试验、免疫蛋白电泳以及血免疫球蛋白、类风湿因子、抗环瓜氨酸肽抗体、抗葡萄糖-6-磷酸异构酶抗体和抗中性粒细胞抗体检测结果均位于正常范围内。(3)其他实验室检查结果:血常规、尿常规、粪常规、出凝血功能、肝功能和肾功能均无明显异常;电解质、空腹血糖、血脂、糖化血红蛋白均位于正常范围内;血清肿瘤标志物均位于正常范围内;人类免疫缺陷病毒(human immunodeficiency virus,HIV)、梅毒螺旋体、乙型肝炎病毒检测结果均为阴性;血清维生素B12水平>1 500.0 pg/mL(入院前已接受甲钴胺治疗1个月),叶酸未见明显缺乏;甲状腺功能及甲状腺抗体检测结果中,仅血清游离甲状腺素水平高于正常值上限,为22.80 pmol/L,其余均未见明显异常;淋巴细胞亚群计数指标均位于正常范围内。
影像学及其他特殊检查结果如下。B超检查结果:全身浅表淋巴结(颈部、颌下、锁骨上、腋下及腹股沟淋巴结)均未见明显肿大。正电子发射体层成像(positron emission tomography,PET)和PET-计算机体层成像(PET-computed tomography,PET-CT)检查结果:双肺肺气肿伴多发肺大疱,肺慢性炎症。肌电图(electromyogram,EMG)检查结果:被检肌未见明显肌源性及神经源性肌电改变。神经传导速度(nerve conduction velocity,NCV)检测结果:双侧胫神经H反射未引出;双侧腓总神经、胫神经运动传导复合肌肉动作电位(compound muscle action potential,CMAP) 波 幅 下 降;其余感觉和运动NCV和波幅均位于正常范围内。躯体感觉诱发电位(somatosensory evoked potential,SEP)检查结果:双侧胫神经刺激,皮质记录SEP P40波不能诱发出。脑干听觉诱发 电 位(brainstem auditory evoked potential,BAEP)检查结果:以声音刺激双侧耳后记录SEP,各波潜伏期均位于正常范围内。视觉诱发电位(visual evoked potential,VEP)检查结果:以翻转模式刺激双眼,皮质记录VEP,其P100波潜伏期位于正常值下限。颈椎MRI平扫+增强扫描检查结果:第6颈椎下缘至第3胸椎水平可见颈髓和胸髓多发斑片状T2加权成像高信号影,考虑脊髓炎可能性(图1A)。胸椎MRI平扫+增强扫描检查结果:胸髓多发斑片状T2加权成像高信号影,考虑脊髓炎可能性大(图1B和C)。头颅MRI平扫+增强扫描检查结果:双侧脑室旁腔隙灶,双侧额部硬膜下积液,老年脑改变,右侧晶状体信号异常。
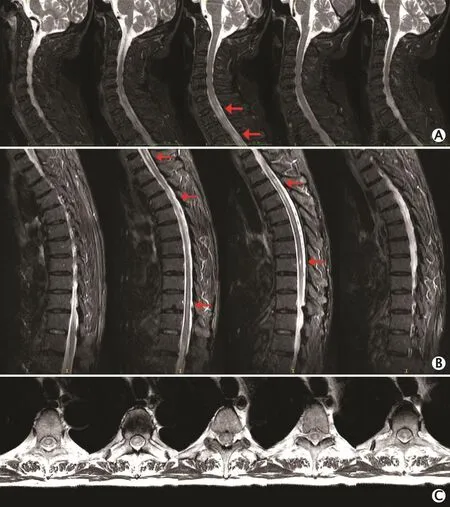
图1 1例诊断为原发性干燥综合征并脊髓病变的男性患者的脊髓磁共振成像表现
请眼科会诊,干燥性角结膜炎(keratoconjunctivitis sicca,KCS)检测结果为阳性(Schirmer Ⅰ试验和泪膜破裂时间试验);唇腺活检病理结果显示唇腺腺体中度萎缩,脂肪组织浸润明显,淋巴浆细胞浸润灶1处。
请风湿科会诊,考虑为干燥综合征并脊髓病变(Sjögren’s syndrome myelopathy,SSM),遂转至风湿科进行治疗。患者在风湿科接受糖皮质激素治疗,并分别于2018年6月27日和2018年7月13日接受利妥昔单抗200 mg静脉滴注治疗,同时接受维生素B12和维生素B1神经营养治疗。2018年7月13日,患者主诉肢体乏力和麻木症状均较前好转。
2 讨 论
原发性干燥综合征(primary Sjögren’s syndrome,pSS)是一种以淋巴细胞浸润外分泌腺体和其他器官为特征性表现,并导致口干、眼干及其他各种腺体以外的症状的自身免疫性结缔组织病[1-2]。许多pSS患者早期可能不会出现如口干、眼干的临床症状,而是以神经系统症状为首发表现,但如果病理检查证实为干燥综合征,则不能排除该病诊断[3]。pSS可导致神经系统损害,其发生率为8.5%~70%,平均为20%[4-5]。其中,周围神经系统累及发生率远高于中枢神经系统[6]。
pSS累及中枢神经系统的临床表现非常广泛,主要包括认知障碍、无菌性脑膜炎、癫痫发作、头痛、脊髓损伤、视神经炎、播散性脑病和多发性硬化等[1,7];发病者中以女性居多,推测可能与性激素有关[8-9]。其中,pSS引起的SSM相对少见。1992—2008年的一项单中心回顾性研究显示,pSS患者中19%患有枢神经系统损害,包括脑病(50%)、无菌性脑膜炎(33%)以及脑白质病变和脊髓损伤(17%)[10]。SSM在临床上主要表现为急性横贯性脊髓炎、慢性进展性脊髓炎、神经源性膀胱、下运动神经元疾病以及类似于多发性硬化的一系列脊髓疾病[11-12]。
类似于风湿热与链球菌的关系[13],推断SSM的发病可能由人类T淋巴细胞病毒(human T-lymphocytic virus,HTLV)感染引起,而这一因素也被认为可能是诱发pSS发病的一项环境因素[14-17]。也有观点认为,SSM系由pSS自身免疫过程中直接损伤脊髓神经细胞所致,而非由于HTLV感染[11,18]。此外,有研究发现,许多表现为SSM的患者的NMO-IgG为阳性,或是其性别比、病程、影像学表现以及治疗结果均符合NMO诊断标准,因此认为SSM实际上是由NMO所导致的一种临床表现[19-20]。所以,对于这些SSM患者的治疗可以参照NMO的治疗,在发病早期就给予积极治疗。10%~40%的NMO患者可合并系统性自身免疫病(systemic autoimmune disorder,SAD),如干燥综合征或系统性红斑狼疮等,可以表现为脊髓炎或是视神经炎。然而,目前尚不明确脊髓炎或视神经炎是SAD多脏器损害的一部分表现,还是独立的疾病[21-22]。
对SSM脑脊液的变化还需深入探究。HTLV感染患者的脑脊液中可能存在相关自身免疫性抗体水平的升高,包括抗SSA抗体、抗SSB抗体以及其他针对中枢神经系统抗原的抗体、抗神经节苷脂抗体或抗磷脂抗体[16]。其中,尤其值得注意的是对AQP4抗体的检测。
MRI是评估脊髓病变的重要的影像学检查手段,可以鉴别各种类型的急性和亚急性脊髓病变。按影像学特征可将常见的脊髓炎分为如下5种类型:(1)长节段的广泛性、横贯性脊髓损伤;(2)短节段的卵圆形或周围型脊髓损害;(3)脊髓灰质炎样损害;(4)肉芽肿型脊髓损伤;(5)伴有皮疹的节段性脊髓损害[23]。
SSM在髓内的典型表现为T2加权成像上的长信号[24-25],其病灶主要集中在胸髓[11,26],其次是颈髓[27],腰髓受累较少见[28];病灶可以呈现为多发性的局灶性分布[8,25],也可以表现为长节段的横贯性分布[23,27],且以后者最为常见[1,29-30]。然而,部分表现出脊髓受累症状的SSM也可能缺乏相应的影像学异常发现[24]。有研究报道,在表现为运动神经元病样症状的SSM患者中,其MRI图像上并未见明显的脊髓异常信号[3,31]。此外,不同部位的病灶可表现出不同的症状,包括急性横贯性脊髓炎、Brown-Séquard综合征[32]、累及后索所致的深感觉障碍和共济失调[19,33]、累及前角运动神经元所致的肌无力和肌萎缩[31]、累及上运动神经元所致的四肢轻瘫[3,31]。有研究分析了14例干燥综合征继发神经系统症状患者的MRI特征,结果发现分布于颈髓背索(薄束和楔束)的T2加权长信号病灶与干燥综合征有关,其受累范围和信号强度可以用于评估病情的严重程度[33]。SSM在MRI矢状位上主要表现为长节段病灶。长节段横贯性脊髓损伤是指在影像学图像上的脊髓损害病灶范围≥3个椎体范围,在NMO谱系疾病的诊断中具有重要意义。除此以外,炎性、感染性、血管性、副瘤性、代谢性等诸多病因均可以引起长节段的脊髓受累[30,34]。RAJAGOPALA等[35]报道了1例表现为长节段脊髓炎(第7颈髓~第3胸髓)的干燥综合征患者,该患者甚至出现了呼吸衰竭的危重症表现;KURZ等[29]报道了1例伴有银屑病样皮炎和长节段脊髓炎(延髓~第7颈髓)的pSS患者。此外,相对罕见的是累及全脊髓节段的pSS[11]。除此之外,pSS也可引起硬脊膜病变。BURETA等[36]报道了1例肥厚性硬脊膜炎所致椎管狭窄及脊髓受压的pSS患者,由于该患者合并HTLV Ⅰ型感染,因此无法明确引起硬脊膜肥厚的主要病因(HTLV Ⅰ型感染,抑或是干燥综合征)。
在SSM治疗方面,针对B淋巴细胞的免疫调节治疗仍然是最重要的治疗手段。对于伴有脊髓损害的pSS,可以选择激素联合环磷酰胺[27,37]、甲氨蝶呤[26]、硫唑嘌呤[38]等治疗,其中硫唑嘌呤并不常规用于pSS的治疗,但推荐用于合并有系统性症状的pSS的治疗[39]。血浆置换应用于pSS[40]已早有报道,并且取得了肯定的疗效[29],尤其适用于需要在急性期迅速缓解症状的患者[26]。此外,相较于合并其他中枢神经系统表现的pSS患者,利妥昔单抗对SSM有明确的治疗效果[41]。
本文报道的这例患者为老年男性,慢性病程,病情呈进行性加重,表现为累及颈髓和胸髓的横贯性脊髓炎,临床症状主要包括运动功能和排便功能障碍。经相关实验室检查和影像学检查,未发现有明确的多发性硬化、NMO谱系疾病、亚急性联合病变等常见疾病的证据,也未找到副瘤综合征的相关证据;常规筛查抗核抗体谱时发现抗SSA/Ro-52抗体水平升高;眼科KCS检查和唇腺活检病理证实为干燥综合征。因此,该例患者最终被诊断为SSM。
综上所述,在神经内科的临床工作中,应考虑到pSS与脊髓炎共病的可能性。由于脊髓病灶有可能是中枢神经系统脱髓鞘疾病(如NMO谱系疾病)的首发表现,因此需要同时关注其他部位(视神经、大脑白质等)的病灶及相应的症状,并随访AQP4抗体、叶酸、维生素B12等指标,以便及时作出正确的诊断,并制定合适的治疗方案。

