运动与骨骼肌自噬研究进展
徐瑞曹友祥严翊谢敏豪
1北京体育大学运动人体科学学院(北京100084)
2国家体育总局运动医学研究所(北京100061)
运动在有效提高心肺耐力水平和肌肉质量、促进线粒体合成、提高胰岛素敏感性等的同时,也会导致机体氧化应激增加和能量代谢失衡。自噬作为一种保守的细胞内动态维稳机制,在运动过程中促进分解代谢的同时也能够清除受损细胞器和错误折叠蛋白质。运动能够通过多条信号转导途径调控自噬活性,不同运动方式和条件下自噬活性变化不同。目前,有关运动调节自噬的研究多集中于运动后自噬活性的变化,并未结合能量代谢途径/因子探讨运动后自噬变化的具体机制。因此,本文在总结运动对自噬活性影响的基础上进一步探讨运动调控自噬的代谢途径,以期为探究运动调控自噬的有效机制提供理论依据。
1 自噬
自噬是细胞通过形成自噬体降解破损细胞器及有害蛋白碎片的过程[1],是细胞应对外界刺激时维持细胞内环境稳态的一种机制[2]。在哺乳动物体内,自噬启动后,首先会形成自噬体膜,包裹待降解物后形成自噬体,继而自噬体与溶酶体融合后降解[3]。自噬包含以下几个步骤:自噬启动、自噬体成核、自噬体膜扩张、选择包裹底物、自噬体和溶酶体融合以及降解6个步骤。目前研究已经发现至少有31种自噬相关基因(ATG)和蛋白(Atg)参与自噬的调控过程[4,5]。
ULK1/ATG1(哺乳动物称ULK1,酵母中称ATG1)激酶复合体由丝氨酸/苏氨酸蛋白激酶ULK1、Atg13以及ATG17组成[6],是调控自噬启动的关键因子[7],参与介导自噬前体(phagophore)的形成,诱导自噬的启动[8]。ULK1激酶复合体能够促进PI3K和ATG14形成复合物,并促进Beclin1从Bcl2-Beclin1复合体中解离出来,形成Beclin1复合体(Beclin1-PI3K-ATG14复合物),Beclin1复合体是参与自噬体核形成的关键因子[9]。游离于细胞质中的无活性的微管相关轻链蛋白3(microtubule-associated protein 1-light chain 3,简称LC3)被ATG4切割后形成LC3Ⅰ,继而在自噬体膜上通过ATG7被脂化形成LC3Ⅱ[10]。ATG12首先通过ATG7与ATG5共价结合形成ATG5-ATG12复合物,ATG5-ATG12复合物进一步与ATG16相结合,形成ATG5-ATG12-ATG16复合物,与LC3Ⅱ相结合最终形成ATG12-ATG5-ATG16-LC3Ⅱ复合物,与自噬体膜相结合后促进自噬体膜弯曲融合[11],LC3Ⅱ和ATG5-ATG12-ATG16复合物表达量也决定自噬体的大小[12]。自噬体形成后,在LAMP2的作用下,自噬体与溶酶体相结合,形成“自噬-溶酶体”降解包裹物,降解产生的氨基酸等物质参与机体再循环[13]。
在自噬发生过程中,LC3Ⅰ需要不断脂化形成LC3Ⅱ,促进自噬体膜的形成,因此一般以LC3Ⅰ向LC3Ⅱ转化的比例作为判断自噬活性的标志[14]。但有研究认为,LC3Ⅱ表达量升高并不完全代表自噬降解过程的发生[15],自噬体与溶酶体结合的过程被抑制后,导致溶酶体降解自噬体的速率降低,也会出现LC3Ⅱ和LC3Ⅱ/LC3Ⅰ比例表达量上升[16,17],而此时自噬体并没有被完全降解,自噬通量没有增加[18]。p62作为LC3包裹泛素化底物的纽带,在自噬过程中不断降解,建议在检测自噬的时候将p62,LC3转换率以及其他自噬相关蛋白结合判断。
2 运动对骨骼肌自噬的影响
目前关于运动对骨骼肌自噬活性影响的研究较多,但结论尚不一致。分析其可能原因,包括:运动干预方式差异;运动后取材时间的差异;组织间差异;运动干预前实验对象的营养水平差异;运动干预周期差异等。
2.1 一次性运动对骨骼肌自噬的影响
Kim等[19]发现小鼠进行一次性50 min的跑台训练(v=12.3 m/min)后,LC3Ⅱ、Beclin1、Atg7、AMP2表达量下降,自噬活性降低;而一次性90 min训练(55%VO2max)后,LC3Ⅱ表达量显著升高,LC3Ⅱ/LC3Ⅰ比值有升高趋势[16]。造成以上研究结果差异的原因可能是由于运动强度和时间不同导致的能量消耗不同。Schwalm等[20]发现,一次性运动后,55%VO2max组LC3Ⅱ/LC3Ⅰ比值下降,p62不变;而70%VO2max组LC3Ⅱ/LC3Ⅰ比值显著升高,p62表达显著下降。分析其原因可能是由于低强度运动对细胞器损伤小,能量消耗较少,不能促进自噬过程的启动,而在Kim等[19]的研究中,一次性中低强度运动后,虽然LC3Ⅱ表达水平下降,但促进蛋白质降解的MuRF1蛋白的表达水平升高,可能是由于在能量消耗较小的条件下,机体为维持能量平衡对自噬活性降低的代偿机制。
另外,运动后的不同采样时间也会对自噬活性产生影响。He等人[21]发现,一次性力竭跑台运动后,小鼠骨骼肌(股外侧肌、比目鱼肌、胫骨前肌、趾长伸肌)、心肌LC3Ⅱ蛋白表达量在运动后15 min有下降趋势,随后在30min、50min、80min逐渐递增,并在80 min达到稳定;而p62表达在运动后即刻升高,30 min、1h逐渐降低,3h后又升高。另外,随着运动后时间的推移,Bcl2-Beclin1复合物在运动后15 min表达量下降,30 min后几乎检测不到[22]。因此,运动后自噬活性变化具有时效性,在探讨一次性运动后骨骼肌自噬的变化时应注意采样时间。
运动前肌糖原水平也可能是影响自噬变化的因素之一[23,24]。运动前肌肉糖原浓度与自噬活化程度呈负相关。禁食24 h后小鼠比目鱼肌、跖肌和腓肠肌中自噬体数量增多,而在此基础上对小鼠进行一次性中等强度运动干预(12 m/min、2 h、坡度10°)后LC3Ⅱ/LC3Ⅰ比值降低[25],提示在禁食条件下运动会抑制小鼠的自噬活性。Moller等[26]在人体实验中也发现,禁食36 h后以50%VO2max强度进行60 min的自行车运动干预后即刻股外侧肌LC3Ⅱ/LC3Ⅰ比值均出现显著下降,运动后90 min有所上升,但仍显著性低于运动前。自噬在清除受损蛋白的同时,还能够促进分解代谢,在肌糖原缺失的条件下运动会抑制自噬活性可能是由于机体对于骨骼肌的保护,防止骨骼肌被过度降解。一次性运动对自噬相关因子的影响见表1。

表1 一次性运动影响骨骼肌自噬相关性因子的研究

KruseR等(2017)[30]成年男性股外侧肌60 min跑台训练(70%VO2max)LC3Ⅱ、Beclin1、Atg7mRNA保持不变Atg7、p62、FOXO3蛋白表达量不变↓LC3Ⅱ蛋白表达、LC3Ⅱ/LC3Ⅰ比值(P<0.05)↑p-ULK1ser555(P<0.05)↓p-ULK1ser757(P>0.05)
2.2 长时间运动对骨骼肌自噬的影响
目前关于长时间运动对骨骼肌自噬影响的研究主要是观察运动干预后基础自噬和自噬通量的适应性变化,因此多在最后一次训练24~48小时后取材[31,32]来观察运动后自噬活性的变化。运动干预周期以及取材骨骼肌类型是决定长期运动对骨骼肌自噬影响的主要因素[33-36]。
Smuder等[33]对小鼠进行连续5天(30 m/min,60 min/天)的跑步运动干预后发现,大鼠比目鱼肌中Beclin1、Atg12、Atg4、Atg7、LC3、Atg12-Atg5复合物、cathepsin L蛋白水平未发生变化。而Lira等人[34]在对小鼠进行4周的转轮运动干预后发现,小鼠比目鱼肌LC3Ⅱ、LC3Ⅱ/LC3Ⅰ蛋白表达显著升高,p62蛋白水平显著降低,Beclin1、Bnip3和Atg7等蛋白表达水平也有上升趋势,基础自噬通量和自噬蛋白表达水平均显著上升。Lira等[34]人还发现不同的肌纤维类型/组织对于自噬的刺激也会产生不同应答。4周运动干预后,比目鱼肌和跖肌中自噬相关蛋白Atg6、Atg7,线粒体自噬蛋白Bnip3以及线粒体合成蛋白PGC1-α、Cox-4等均显著升高,且比目鱼肌中各项自噬相关蛋白均显著高于跖肌。提示运动干预对慢肌纤维主导的肌肉的自噬活性有明显促进作用。除了骨骼肌以外,运动对脂肪组织自噬活性的影响也存在组织间差异[34]。另外,长期耐力运动与抗阻运动均能够提高大鼠和小鼠骨骼肌中自噬相关蛋白表达水平以及自噬通量[34,35]。8周的抗阻运动[36]和有氧运动[37]均能够提高大鼠骨骼肌LC3Ⅱ、Beclin1和Atg7表达水平,但其中抗阻运动后大鼠骨骼肌自噬活性变化主要集中于趾深屈肌,而有氧运动后大鼠趾长伸肌自噬活性变化明显。
虽然抗阻运动和有氧运动均能够提高大鼠骨骼肌自噬活性,但是运动干预时间过长可能会导致骨骼肌出现适应性变化。Bayod等对大鼠进行36周中等强度运动干预后,大鼠骨骼肌、海马体、心肌、肝脏组织中Beclin1、LC3Ⅱ/LC3Ⅰ比例均未出现变化[39]。大鼠进行终身(10周龄购置至24月龄取材)转轮运动后其骨骼肌中Beclin1、LC3Ⅰ、LC3Ⅱ、Atg7和Atg9的蛋白质表达水平均未显著变化。说明运动干预周期过长可能会导致心肌、骨骼肌、肝脏、海马体等组织对运动刺激产生适应,自噬活性不再变化[38]。
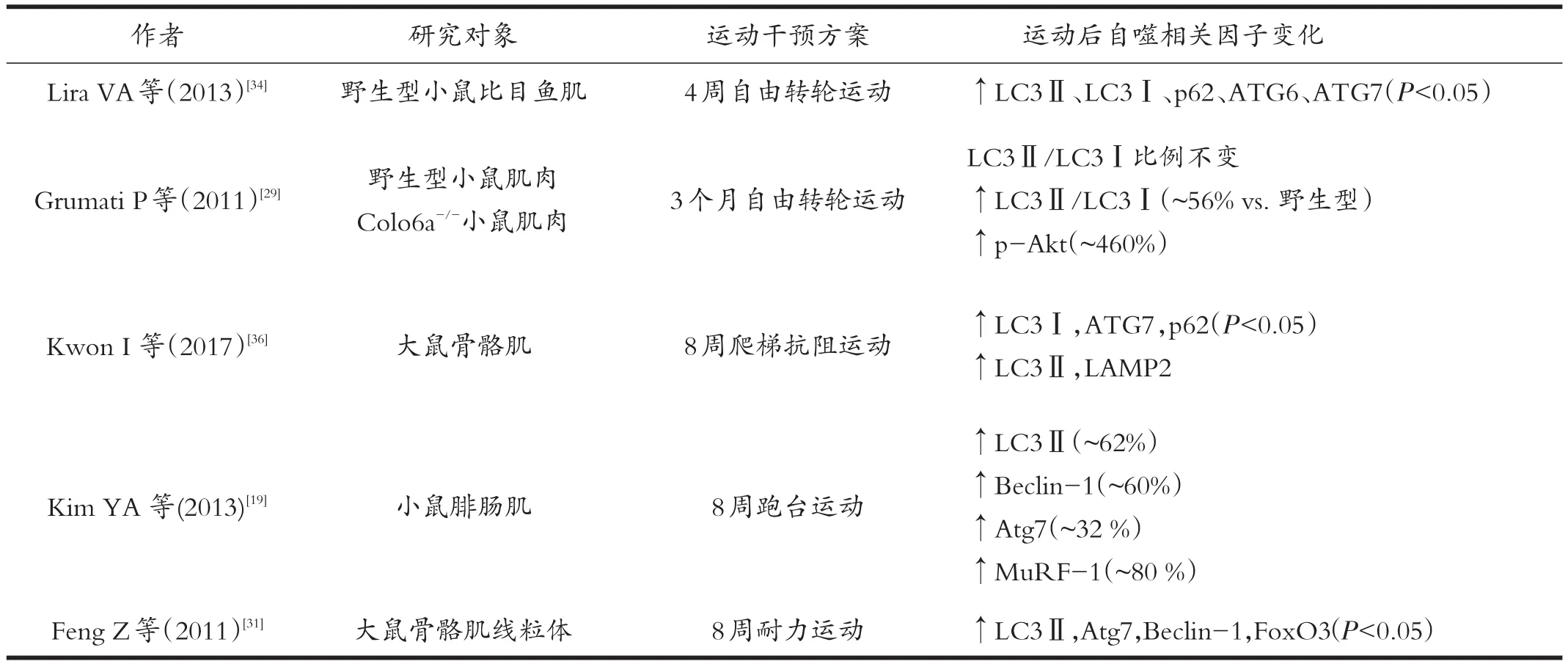
表2 长期运动影响骨骼肌自噬相关因子的研究
除了正常的实验对象以外,许多学者也围绕特异性敲除相关基因的大鼠和小鼠进行研究,发现当能量代谢出现障碍时,机体自噬活性通常不会发生改变。长时间运动训练不能改善存在自噬缺陷小鼠的运动能力[34]。He等[42]人也发现运动干预不能刺激Bcl2AAA小鼠的Bcl2磷酸化,进而抑制了Beclin1从Bcl2-Beclin1复合物中解离,因此经过运动干预的Bcl2AAA小鼠的能量代谢水平和自噬活性均未发生改变。Grumati等[29]通过对比发现,运动能够提高野生型小鼠LC3Ⅱ/LC3Ⅰ比值,但会使Colo6a-/-小鼠LC3Ⅱ/LC3Ⅰ比值降低,自噬活性下降。Vainshtein等[27]敲除小鼠PGC-1α基因后发现,运动干预不能对骨骼肌LC3Ⅱ与p62 mRNA表达水平产生影响。
虽然目前关于运动对自噬的影响主要集中于骨骼肌的研究,但也有研究发现,运动也能够对脂肪组织等其他组织的自噬活性产生影响。Tanaka等[41]对大鼠进行9周的跑台运动干预后,大鼠皮下白色脂肪LC3Ⅱ、ATG7表达量显著升高,说明运动干预能够刺激大鼠白色脂肪组织自噬活性提高。其他研究也发现,运动能够对胰腺、肝脏、脑等非运动器官中的自噬活性产生影响[21,42-45]。但有关运动后非运动器官自噬活性的变化是由于运动直接刺激对应组织引起自噬活性变化?还是通过改变骨骼肌等运动器官自噬活性后,间接对其周围组织产生影响?有待进一步研究。
3 运动影响骨骼肌自噬的可能机制
在运动过程中,机体对能量需求激增,能量需求大于供应,AMP/ATP比值升高,从而激活能量感应激酶——腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)[46]。因此,运动后机体首先出现AMPK大量增加。AMPK除了能够激活细胞生物体中的分解代谢过程,抑制脂质、蛋白质和碳水化合物生物合成以外[47],也是自噬启动过程的关键因子。
AMPK能够通过促进ULK1在Ser555位点磷酸化激活自噬的启动,也能通过抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)提高自噬的活性。mTOR是高度保守的丝氨酸/苏氨酸蛋白激酶,能与其他配体相结合形成mTORC1和mTORC2,其中主要是mTORC1参与抑制自噬。AMPK能够通过抑制mTORC1上Raptor亚基磷酸化来抑制mTORC1[48],mTOR能够促进ULK1Ser757位点磷酸化来抑制ULK1的表达,进而抑制自噬的启动[26]。
mTORC1除了受到AMPK的抑制外,还受到胰岛素样生长因子(insulin like growth factor,IGF)、细胞内磷脂酰肌醇激酶(phosphoninositide 3-kinase,PI3K)以及蛋白激酶B(protein kinase B,Akt)等因子的调控。运动能够通过抑制IGF/Akt/mTOR信号通路来调控自噬,IGF通过受体酪氨酸激酶(receptor tyrosine kinase,RTKs)激活Akt/mTOR信号通路,Akt在与生长因子结合后被募集到质膜上,随后被PDK1磷酸化激活[49]。活化Akt能促进TSC2磷酸化,抑制TSC1/TSC2异二聚体形成。TSC2作为GTP酶的激活蛋白,能够通过抑制GTP酶的Rheb进而激活mTORC1[50-53]。除了IGF因子以外,PI3K也能够通过作用于mTOR,形成PI3K/Akt/mTORC2信号通路控制FoxO转录因子的磷酸化来调控自噬的变化[54]。进化上保守的FoxO家族转录因子是最早发现调节自噬的基因[54],能够刺激LC3、p62、BNIP3、cathepsin L、BNIP3等自噬相关因子转录[55-58],运动刺激能够激活FoxO的转录程序,进而增加自噬通量。另外,FoxO1乙酰化后能够与ATG7特异性结合来促进自噬[59]。
运动除了能够刺激能量代谢因子表达升高以外,也能够增加线粒体呼吸及氧化还原反应的发生,促进NADH氧化成NAD+,使NAD+/NADH比例升高[60],进而激活各种下游信号激酶以及应激反应物如SIRT1、FoxO家族转录因子等[61]。SIRT1的活化依赖NAD+[61],通过NAD+与细胞能量状态直接相连,SIRT1脱乙酰酶活性主要是由NAD+的水平所决定的[62]。另外,在运动过程中,AMP/ATP比值上升的同时NADH氧化成NAD+,AMPK也是通过改变细胞内NAD+/NADH比例间接激活SIRT1脱乙酰酶的活性[61,62],使SIRT1表达水平大量增加[63]。SIRT1活化后能够刺激自噬相关因子Atg5、Atg7和LC3去乙酰化来激活自噬[64]。另外,SIRT1也能够使FoXO3转录因子去乙酰化以促进Bnip3、ATG4、Beclin1、ATG12等自噬因子的转录[65]。因此,在运动过程中细胞能量代谢主要通过NAD+/NADH比例的变化对自噬过程产生影响。
由运动导致的细胞内外离子变化也能够通过其下游的激酶影响自噬的发生。运动过程中Ca2+浓度大幅升高,促进下游的钙调蛋白磷酸酶和钙调蛋白激酶(Ca2+/calmodulin-dependent protein kinase,CaMK)活性增加[66]。CaMK能够促进细胞转录因子TFEB表达量上升[67]。TFEB在自噬体形成过程中能够促进Beclin1表达以及通过提高自噬体-溶酶体降解速率来促进细胞内物质回收利用[68]。CaMK还能够促进PGC-1α磷酸化[69],PGC-1α磷酸化后能够刺激FoxO转录因子调节自噬相关基因的表达。而AMPK和p38MAPK也能够促进PGC-1α的表达[70]。AMPK在激活PGC-1α的同时能够促进PGC-1α转录[71]。p38MAPK能够促进PGC-1α磷酸化[22]。
综上,运动刺激自噬是复杂且多元的。自噬能够被AMPK信号调节通路、IGF/Akt/mTOR信号调节通路、PI3K/Akt/mTORC2信号调节通路等运动诱导的多条能量代谢相关途径调节,这些信号通路大部分最终汇集于AMPK和mTOR,主要通过调控ULK1磷酸化来调节自噬的启动。同时,运动也能够促进FoxO家族转录因子表达来增加自噬相关蛋白转录,进而促进自噬体的形成;运动后相关离子的变化也能够促进自噬相关蛋白表达增加,NAD+和Ca2+在刺激自噬相关蛋白的同时,能够促进FoxO转录因子的表达来调控自噬相关蛋白的变化。除此之外,肌肉通过自噬释放的因子是另一条重要的探索途径[72]。运动还有可能从其他能量代谢途径/因子调控自噬,但还有待进一步研究。运动刺激诱导自噬的可能机制见图1。
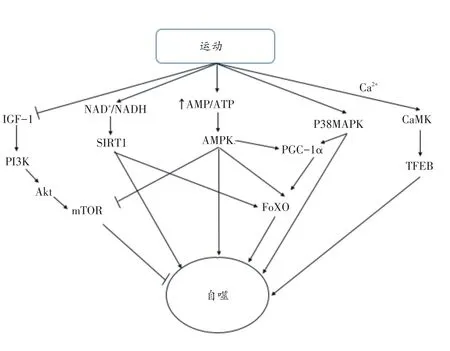
图1 运动诱导自噬的可能机制
4 小结
4.1 目前研究中存在的问题
(1)总结以往的研究可以看出,耐力运动对骨骼肌自噬活性的作用更加明显,且运动干预后以慢肌纤维为主导的骨骼肌中自噬活性变化更加明显。但目前尚未深入探讨运动干预后组织间自噬变化特异性差异的原因。
(2)运动干预后自噬过程中相关因子变化并未完全同步,目前研究一般以LC3Ⅱ表达量作为判断自噬活性的标志物,但自噬体的过度累积也会导致LC3Ⅱ表达量上升,运动促进自噬启动增加并不意味着基础自噬和自噬通量增加,运动刺激自噬活性改变的具体机制还需进一步探究。
(3)运动能够通过多条信号转导通路调控自噬,但是通过促进自噬启动因子表达增加,还是通过在自噬体形成过程中促进相关因子的表达来对自噬产生影响?目前尚未明确,有待进一步研究。
(4)当前研究结果显示长期运动后基础自噬水平能够升高,其原因是由于运动促进信号转导通路中的能量因子适应性增加,进而不断激活自噬?还是由于运动后自噬相关因子表达水平适应性升高?结论尚未明确,还需进一步探讨。
4.2 未来研究展望
综上所述,关于运动和自噬的研究尚在起步阶段,还需要进一步研究运动对自噬的激活机制以及长期运动下自噬适应性变化的原因。因此,未来的实验研究中可从运动能量代谢途径/因子变化的源头来探究运动对自噬的影响,进一步为探讨运动有益于健康提供重要依据。

