光强对盆栽芒萁光响应过程与抗氧化酶系统的影响
金桂宏,张明如,王立竹,夏侯佐英,许 焱,何云核
(1.浙江农林大学 风景园林与建筑学院,浙江 杭州311300;2.浙江农林大学 林业与生物技术学院,浙江 杭州 311300)
芒萁Dicranopteris dichotoma为里白科Gleicheniaceae芒萁属Dicranopteris多年生常绿蕨类植物,分布于长江中下游及长江以南、西南等亚热带低山丘陵区,被视为亚热带森林分布地区退化植被的 “标志种”[1-3]。 近年来, 从更新扩散后生物量的分布[4]、 对生境因子的响应[5]到对光强的生态适应性, 学者们对芒萁进行了广泛研究。自然条件下,芒萁分布于马尾松Pinus massoniana,杉木Cunninghamia lanceolata单优群落和疏灌草丛的下层及其群落外缘,形成单优草本层片[6-7]或成为马尾松人工林草本层的优势种[8];易在马尾松人工林1 200~1 600 m2的林窗下扩散定居[9],常在毛竹Phyllostachys edulis林呈聚集分布[10],是生态适应性较强的物种。芒萁对土壤氮、磷等多种元素吸收利用率低,有较强的耐荫性,还能忍耐一定的强光生境[11-12];通过灰分测定,可证实其偏阳性的特性[13-14]。光强和光的可利用性是蕨类植物形态、生理适应性和分布最重要的影响因子[15]。揭示芒萁对光强的生态适应机制,需要从光补偿点和光饱和点加以判断,也需在强光与弱光胁迫条件下分析芒萁叶片抗氧化酶活性和可溶性蛋白质变化的响应特征[16-18]。研究发现:全光与过度遮阳处理会导致8个容器苗树种光合速率下降[19],中等强度遮阳亦会使强耐荫大豆Glycine max失去耐荫能力[20],持续弱光胁迫使马铃薯Solanum tuberosum苗期植株对强光和弱光的利用能力同时下降,对强光的利用范围变窄[21]。理论上,抗氧化酶活性对环境胁迫抗性有一定的阈值,抵抗性强的植物具有更高的抗氧化酶活性[22]。当生长于暖性单优针叶群落下层、疏灌草丛或撂荒地,由弱光生境变化为全光生境的时候,芒萁必然受到弱光或强光的抑制影响。因此,为研究芒萁对光强的生态适应范围和光强对芒萁的抑制效应,提出如下假设:①芒萁对光强生态适应范围较大,表现为光饱和点较高和光补偿点较低;②芒萁气体交换参数(净光合速率、蒸腾速率、气孔导度)的响应过程,以中度遮阳处于最高水平、胞间二氧化碳摩尔分数处于较低水平;③抗氧化保护酶活性的变化能够表征芒萁对光抑制缓冲胁迫能力的大小,强光与弱光条件都能诱发芒萁叶片活性氧的增加。为验证上述3个假设,本研究以盆栽芒萁为试验材料,模拟不同类型群落下层的光强环境,比较分析不同光强条件下芒萁光合生理响应与抗氧化保护酶活性的变化特征,为进一步探究芒萁扩散定居的生态现象提供参考。
1 材料与方法
1.1 材料与试验方案
于 2016 年 6 月 5 日, 从杭州市临安区玲珑山(30°13′05″N,119°40′23″E)海拔 160 m 处, 选择长势良好且高度基本一致的芒萁幼苗100株,栽植在40 cm×21 cm×17 cm的长方形花盆中。栽培基质为马尾松单优群落下层表土,栽种1株·盆-1,放置于3层遮阳网下缓苗。缓苗期间正常浇水,待芒萁幼苗成活后,于8月6日搬至不同光照强度的遮阳大棚内,每个处理15盆,保证幼苗间互无遮阳干扰。于11月3日开始光响应进程测定,并取样用于酶活性的分析。
遮阳大棚位于浙江农林大学东湖校区(30°15′28″N, 119°43′35″E), 分别覆盖 1 层、 2 层、 3 层的黑色尼龙网,并以自然全光为对照(ck)。各处理随机选择3盆盆栽芒萁,选择南侧的功能叶用于光合响应、保护酶活性等测定。为准确分析不同遮阳强度下光强的减弱程度,于2016年11月初,选择2个晴天从8:00-18:00时,隔2 h利用光量子仪测定光量子通量密度,并与全光对照处理比较。各处理测定数据30个,其中遮阳大棚选3个测点,各测点测定数据10个。测定分析结果如表1所示。

表1 不同遮阳处理的大棚透光率Table 1 Light transmittance under different shadings treatments
1.2 测定分析方法
光合指标与气体交换参数的测定:利用Li-6400XT光合测定仪在晴天的8:00-11:30,对盆栽芒萁叶片的净光合速率进行测定。设定光强梯度依次为2 000,1 500,1 200,1 000,800,500,300,100,50,30, 10, 0 μmol·m-2·s-1。 测定前,让待测叶片在饱和光(1 500 μmol·m-2·s-1)下照射 20 min,使叶片充分活化。测定已设定光强下的净光合速率(Pn),气孔导度(Gs),蒸腾速率(Tr)和胞间二氧化碳摩尔分数(Ci)等参数,重复3次,计算平均值。采用光合助手软件(Photosynthesis)拟合盆栽芒萁的光响应曲线,利用非直角双曲线模型[23]获得光补偿点(PLC),光饱和点(PLS),最大净光合速率(Pnmax),表观量子效率(AQY)和暗呼吸速率(Rd)。
抗氧化酶、可溶性蛋白质与丙二醛(MDA)的测定[24]:各处理选择幼苗3株进行测定,磨样2个·株-1,各重复3次。称取0.5 g叶样,研磨离心后提取上清液,直接用于可溶性蛋白质、MDA和抗氧化酶活性的测定。 可溶性蛋白质(μg·g-1)参照考马斯亮蓝 G-250 染色法, MDA(mmol·g-1)采用硫代巴比妥酸比色法, 过氧化物酶 (POD) 活性 (16.67 nkat·g-1·min-1)采用愈创木酚显色法, 过氧化氢酶 (CAT)活性(16.67 nkat·g-1·min-1)采用紫外吸收法。 超氧化物歧化酶(SOD)活性(16.67 nkat·g-1)采用试剂盒测定, 货号:A001-1,南京建成生物工程研究所。
1.3 数据处理
运用Excel进行数据处理,利用Origin 9.1绘图,借助SPSS 19.0软件,采用单因素方差分析法(one-way ANOVA)对数据进行差异显著检验。
2 结果与分析
2.1 不同光强处理对盆栽芒萁光合参数的影响
由表2可见:随光照强度增加,盆栽芒萁的最大净光合速率、光饱和点、光补偿点、暗呼吸速率和表观量子效率均呈先增加后下降的变化特征,其中2层遮阳处理下均出现了最大值,对照处理下均最小。说明全光条件下盆栽芒萁出现了光胁迫抑制现象,2层遮阳环境下比较适合于盆栽芒萁的生长。
在 3 种遮阳强度下,L3的光补偿点最低, 由 L2的 34.669 μmol·m-2·s-1降低到 13.843 μmol·m-2·s-1,并与L1和L2差异显著(P<0.05),说明遮光处理后叶片通过降低光补偿点以适应弱光环境。在不同遮阳条件下,L2和L3的暗呼吸速率与对照差异显著(P<0.05),L1与ck无显著差异(P>0.05);与ck相比,L1,L2和L3的暗呼吸速率分别升高了2.07%,4.97%和4.74%。表观量子效率为L1,L2与ck差异显著(P<0.05),而L3与ck差异不显著(P>0.05)。可见,在全光和弱光条件下盆栽芒萁捕获光量子的能力较强。
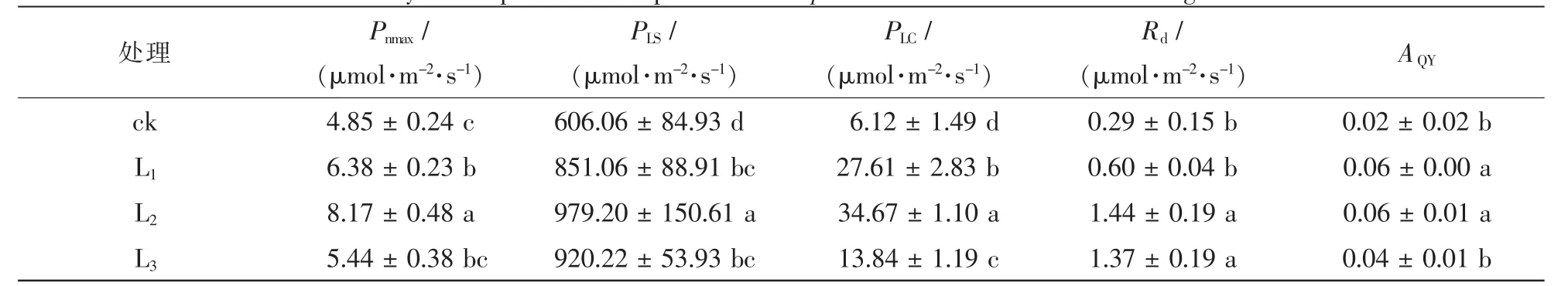
表2 不同光强处理下盆栽芒萁的光合参数比较Table 2 Photosynthetic parameters of potted Dicranopteris dichotoma under different light treatments
2.2 不同光强处理对盆栽芒萁气体交换参数的影响
由图1可知:当光合有效辐射<300 μmol·m-2·s-1时,随着光合有效辐射的增加,3种遮阳处理和ck的盆栽芒萁的净光合速率呈快速增加,其中L1和L2近似于线性增加,L3的增加速率减缓,ck的增加速率最小;当光合有效辐射在300~800 μmol·m-2·s-1时,3种遮阳处理与ck的盆栽芒萁净光合速率增加趋缓;当光合有效辐射在200~2 000 μmol·m-2·s-1时,不同遮阳处理与ck的净光合速率大小依次为:L2>L1>L3>ck。
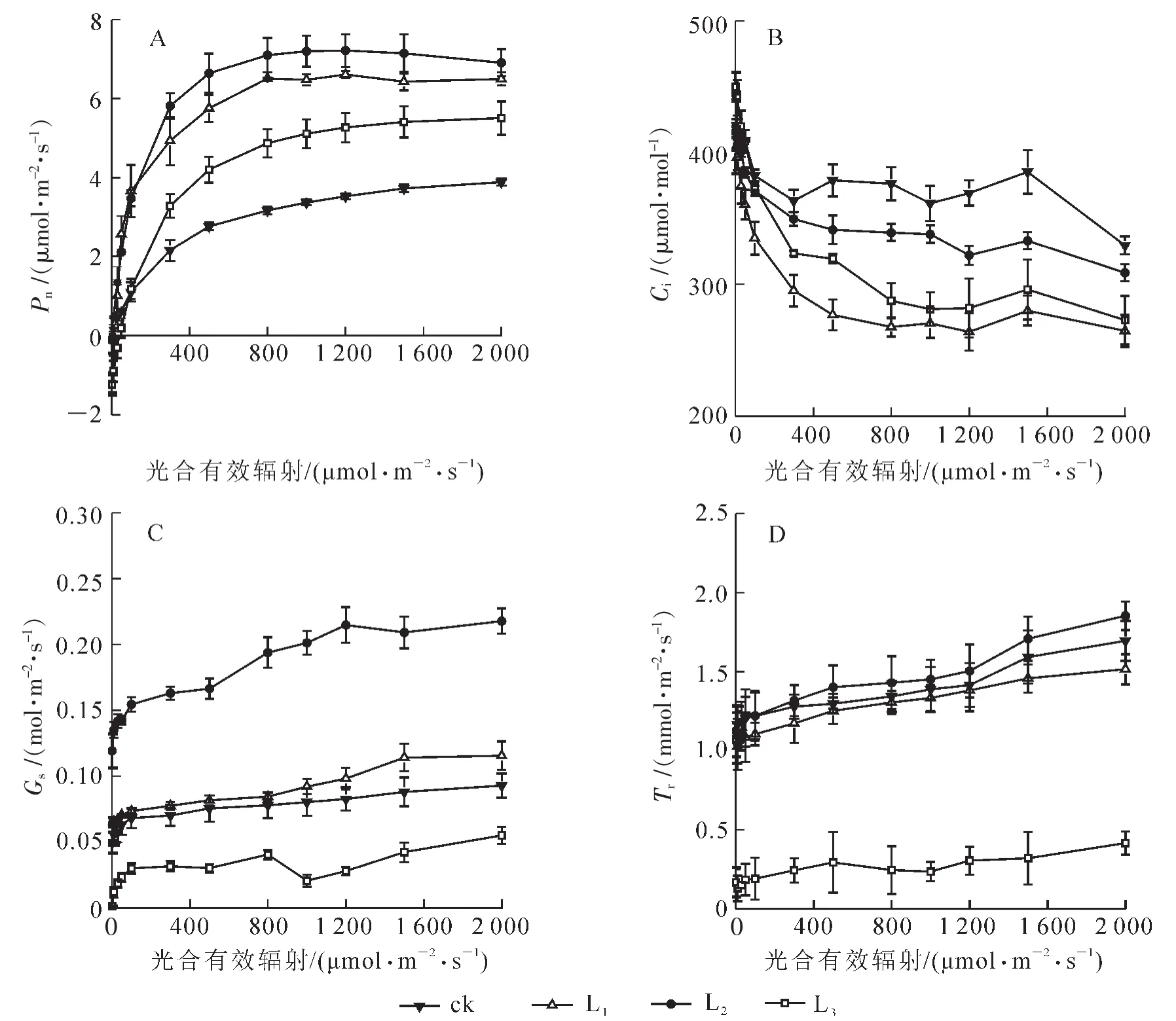
图1 不同光强处理下盆栽芒萁的气体交换参数比较Figure 1 Gas exchange parameters of potted Dicranopteris dichotoma under different light treatments
分析图1可知:全光下的净光合速率最低,表明盆栽芒萁受到了光抑制;与全光相比,L2可显著提高盆栽芒萁的净光合速率。盆栽芒萁叶片气孔导度对光合有效辐射的响应基本一致,但在L3的蒸腾速率和气孔导度随光强增加的变化不明显,可能是弱光下植物气孔的调节功能会减弱,表现在对光强变化的不敏感。随着光合有效辐射的增加,各处理下芒萁的净光合速率、蒸腾速率和气孔导度呈增加趋势,胞间二氧化碳摩尔分数则减小,并在光合有效辐射为0时均最大,呈现L2>L1>L3的规律。随着光照强度的增加,ck的净光合速率下降,而蒸腾速率、胞间二氧化碳摩尔分数上升,L1,L2和L3的净光合速率、气孔导度、胞间二氧化碳摩尔分数变化均同向。可见强光使得气孔导度降低,并使得二氧化碳滞留导致胞间二氧化碳摩尔分数增高。因此判断胞间二氧化碳摩尔分数是制约盆栽芒萁叶片净光合速率的主要因素之一,全光下净光合速率下降的主要原因是发生了由气孔因素向非气孔限制因素的转变,透光率大约35.96%时,会出现临界点。
2.3 不同光强处理对盆栽芒萁可溶性蛋白质、MDA和抗氧化酶活性的影响
渗透调节物质和膜脂过氧化作用与植物受逆境胁迫的程度有关,通常可溶性蛋白质和MDA越高,说明植物受到胁迫的程度越高。由图2可知:盆栽芒萁的可溶性蛋白质随光强的增加变化显著,其大小依次为ck>L1>L2>>L3,表明当光胁迫逐渐减弱后,盆栽芒萁叶片可溶性蛋白质不断下降,光强的增加是导致可溶性蛋白质合成和积累的重要因素之一。在3种遮阳强度下,盆栽芒萁叶片MDA随遮阳强度的增加呈上升趋势,但均低于对照组,且L1,L2和L3的MDA分别比ck减少了86.21%,38.53%和34.68%,表明遮阳后盆栽芒萁叶片的膜脂过氧化损伤较轻,而全光条件下的盆栽芒萁膜脂过氧化严重,推测此时盆栽芒萁叶片活性氧的产生超出了细胞的清除能力。可见,全光下的盆栽芒萁可溶性蛋白质与MDA皆显著高于遮阳处理(P<0.05),表明此变化属于盆栽芒萁有效适应强光环境的一种生理生态对策。
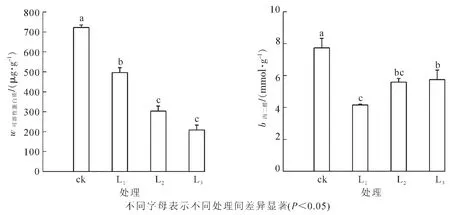
图2 不同光强处理下盆栽芒萁的可溶性蛋白与MDA变化Figure 2 Change of soluble protein content and MDA contentof potted Dicranopteris dichotoma under different light treatments
抗氧化酶系统是植物受环境胁迫时的重要防御系统,其中超氧化物歧化酶(SOD)能保护细胞免受氧化胁迫。过氧化物酶(POD)能反映植物对环境的适应性,过氧化氢酶(CAT)是清除过氧化氢的重要酶。从图3可知:经不同遮阳处理后,各处理间盆栽芒萁叶片SOD活性的差异不显著(P>0.05),但均高于对照处理;相反,各处理间POD和CAT的活性差异显著(P<0.05),且均低于对照处理。遮光后,盆栽芒萁叶片的SOD活性随遮阳强度的增加呈下降趋势,POD活性呈上升趋势,CAT则出现先降后升,推测是CAT的存在抑制了SOD的活性,也可能POD和CAT活性的增加是对SOD活性降低的补偿协调[25]。3种遮光处理下,POD与CAT活性都在L3下达最大值,与其他处理差异达显著水平(P<0.05),推测盆栽芒萁不仅在全光下受到光胁迫的伤害,弱光也能促使抗氧化酶的变化。
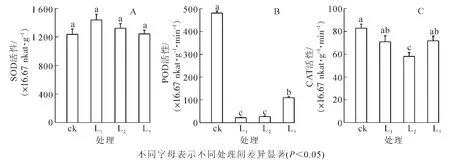
图3 不同光强处理下盆栽芒萁的抗氧化酶活性Figure 3 Change of antioxidant enzyme activity of potted Dicranopteris dichotoma under different light treatment
3 讨论
植物的光补偿点、光饱和点、表观量子效率和最大净光合速率是植物对光能利用的重要指标。在弱光条件下,降低光补偿点属于适应群落下层弱光生境的生理生态对策之一。本研究表明:盆栽芒萁光补偿点为 6.119~34.669 μmol·m-2·s-1, 光饱和点为 606.056~979.195 μmol·m-2·s-1, 符合耐荫植物的特征[26]。在L2下,盆栽芒萁的光补偿点和光饱和点均出现最高值,而在L3下有所降低,但仍高于ck,表明中等光强处理后,盆栽芒萁光补偿点和光饱和点间跨度较大,适应光强变化幅度大。L3下盆栽芒萁则依靠较低的光补偿点和暗呼吸速率来适应弱光环境。有研究证实:凡是具有较高的最大净光合速率、光饱和点和较低的光补偿点、表观量子效率的植物,无论是对强光环境还是弱光环境都有较强的适应能力[27-28]。耐荫性较强的盆栽芒萁在L2下具有更高的最大净光合速率和较低的光补偿点,说明在低光环境下该处理的盆栽芒萁幼苗有更高的光合效率和更低的物质消耗来维持植物碳平衡。同时,L2的表观量子效率值较高,进一步表明了L2的盆栽芒萁有较强的耐荫性和弱光利用能力。本研究表明:最适合盆栽芒萁生长的光强生境属于L2的中等光强,L3亦能自我调节维持正常生长,说明其光适应范围较大。
为进一步研究光强与生长分布之间的关系,后续研究可选择马尾松和杉木单优群落下层生境、林缘地段与阔叶林群落下层生境为样地,测定光量子通量密度,并与光强控制试验相结合,分析单优层片芒萁与盆栽芒萁间的生态差异究竟与哪些因素有密切的关系,比如是否与芒萁光斑的瞬时利用效率、芒萁层片的自遮阳现象和芒萁克隆整合等特性有关。
气孔是植物叶片与外界进行气体交换的主要通道,可根据不同的环境条件来调节孔径大小而使植物在损失水分较少的条件下获取更多的二氧化碳。不同生境对植物叶片气孔形态特征有显著影响。研究表明:芒萁的气孔密度较大(440.23个·mm-2),气孔长度较短(16.88 μm),可知芒萁气孔具有更大的气孔导度和光合速率,对光强降低的响应敏感,能适应多变的光强环境[29-30]。本研究表明:在L2下,盆栽芒萁的净光合速率、蒸腾速率和气孔导度均最高,胞间二氧化碳摩尔分数则处于较低水平,表明L2是净光合速率的最适光环境。L3下气孔部分关闭,气体交换参数都下降,而全光条件下净光合速率的下降伴随着蒸腾速率的升高,也就是说,遮光胁迫下盆栽芒萁光合作用对弱光环境的响应相对迟缓,即净光合速率的降低主要是由气孔限制因素引起的,当全光下胁迫加重时,光合限制因素过渡到非气孔限制因素, L1为其转折点[31-32]。
在逆境胁迫条件下,植物体内过量的活性氧使细胞膜受到破坏并失去活性。可溶性蛋白质是降低渗透势、清除活性氧、保护细胞膜、维持酶活性的一种渗透调节物质[33]。MDA是度量膜脂过氧化程度的参数标志,其含量的高低代表着细胞膜的受损程度。SOD,POD和CAT都是膜脂过氧化防御系统中的保护酶,SOD几乎存在于细胞内的所有区域,是植物抗氧化系统的第1道防线,可将活性氧转化为过氧化氢,然后通过POD和CAT将过氧化氢转化为水和氧气。一般情况下,保护酶活性随胁迫的增大而增加,或是呈先增加后减少的规律[34-35]。有研究表明:弱光胁迫导致膜脂过氧化的反应程度与弱光胁迫程度呈正相关,同时SOD活性在轻度弱光处理下升高,在严重弱光逆境条件下出现下降趋势;POD和CAT活性在弱光下上升[36-37]。本研究结果与上述研究的变化特点一致:随光照强度的增加,盆栽芒萁SOD活性呈先增加后减少的趋势,推测全光条件下植物产生的活性氧超出了自身可调节限度,伴随过氧化氢积累对SOD活性的抑制,POD和CAT活性增加对其进行补偿以平衡抗氧化酶系统[38-39]。
本研究表明:随遮阳强度的增加,盆栽芒萁叶片的可溶性蛋白质逐渐增加;MDA依次为:弱光>中等光强>强光;SOD,POD和CAT等抗氧化酶活性也显著升高。其中,全光下的各项指标皆近乎于最大值,说明盆栽芒萁叶片受到全光胁迫最为严重,由此可知:弱光与全光处理下的盆栽芒萁受胁迫的程度超过了抗氧化酶的清除速度,结果导致MDA的积累,需要合成较多的逆境蛋白以提高自身抗性[40]。形态特征是植物适应环境变异最直接的外在表现,测定分析结果印证了全光下盆栽芒萁叶片外部形态特征的变化:生长纤细低矮、叶片色泽呈黄绿色,伴有叶缘枯黄、皱缩等现象出现,植株生长势极差。本研究期恰逢深秋,无法排除植物生长情况与低温因素对清除活性氧能力波动变化的影响[41],今后可尝试在春季与夏季进行同类试验,对比分析不同季节酶活性的差异及季节产生的影响。
4 结论
在不同光照条件下,盆栽芒萁的净光合速率在13.00%自然光照下最大,而在全光下和弱度光强下出现光抑制现象;弱度光强下的高光饱和点、低光补偿点和低表观量子效率能够表征盆栽芒萁对光强生态适应范围广,能在群落下层一定的弱光环境下维持正常生长。
在4个光强梯度变化过程中,盆栽芒萁在中度遮阳下的净光合速率、蒸腾速率和气孔导度均处于最高水平,而胞间二氧化碳摩尔分数减小。35.96%全光处理是盆栽芒萁气孔因素向非气孔限制因素转变的转折点,表现为全光下的抗氧化酶系统出现损伤。
全光条件下盆栽芒萁的可溶性蛋白质为 722.27 μg·g-1, MDA 为 7.74 mmol·g-1, 均达最高水平。SOD,POD和CAT在光胁迫下相互补偿、协同作用,全光与弱光条件都能诱发盆栽芒萁叶片活性氧的增加。
5 参考文献
[1] 钱崇澍,陈焕镛.中国植物志:第2卷[M].北京:科学出版社,1959:116-121.
[2] CHEN Zhiqiang,CHEN Zhibiao,YAN Xinyu,et al.Stoichiometric mechanisms ofDicranopteris dichotomagrowth and resistance to nutrient limitation in the Zhuxi watershed in the red soil hilly region of China [J].Plant Soil,2016,398(1/2):367 - 379.
[3] 叶居新,洪瑞川,聂义如,等.芒萁植株浸出液对几种植物生长的影响[J].植物生态学与地植物学学报,1987, 11(3): 203 - 211.YE Juxin,HONG Ruichuan,NIE Yiru,et al.The effect of maceration extract ofDicranopteris dichotomaon the growth of several plant species [J].Acta Phytoecol Geobot Sin,1987,11(3):203 - 211.
[4] 刘迎春,刘琪璟,汪宏清,等.芒萁生物量分布特征[J].生态学杂志,2008,27(5):705-711.LIU Yingchun,LIU Qijing,WANG Hongqing,et al.Characteristics of biomass allocation ofDicranopteris dichotoma[J].Chin J Ecol,2008,27(5):705 - 711.
[5] 李小飞,陈志彪,陈志强,等.南方红壤侵蚀区芒萁生长特征及其对环境因子的响应[J].水土保持通报,2013, 33(3):33 - 37.LI Xiaofei,CHEN Zhibiao,CHEN Zhiqiang,et al.Response ofDisranopteris dichotomagrowth to environmental factors in eroded red-soil region of southern China [J].Bull Soil Water Conserv,2013,33(3):33 - 37.
[6] 张明如,温国胜,张汝民,等.千岛湖森林群落下层芒萁层片发育机理初步判断[J].内蒙古农业大学学报,2010, 31(3):28 - 34.ZHANG Mingru,WEN Guosheng,ZHANG Rumin,et al.A study of development mechanisms ofDicranopteris dichotomasynusium of the forest communities in Thousands Lake [J].J Inn Mong Agric Univ,2010,31(3):28 - 34.
[7] 张明如,何明,温国胜,等.芒萁种群特征及其对森林更新影响评述[J].内蒙古农业大学学报,2010,31(4): 303 - 308.ZHANG Mingru,HE Ming,WEN Guosheng,et al.The charateristics ofDicranopteris dichotomapopulation and its effects on the forest regeneration [J].J Inn Mong Agric Univ,2010,31(4):303 - 308.
[8] 崔宁洁,陈小红,刘洋,等.不同林龄马尾松人工林林下灌木和草本多样性[J].生态学报,2014,34(15):4313-4323.CUI Ningjie,CHEN Xiaohong,LIU Yang,et al.Shrub and herb diversity at different ages ofPinus massonianaplantation [J].Acta Ecol Sin,2014,34(15):4313 - 4323.
[9] 宋思梦,谭波,周扬,等.林窗大小对马尾松人工林更新植物生态化学计量特征的影响[J].应用环境生物学报, 2016, 22(6): 1040 - 1047.SONG Simeng,TAN Bo,ZHOU Yang,et al.Effects of forest gap size on ecological stoichiometric characteristics of update plants inPinus massonianaplantation [J].Chin J Appl Environ Biol,2016,22(6):1040 - 1047.
[10] 樊艳荣,陈双林,林华,等.不同林下纸杯干扰措施对毛竹林下植物种群分布格局的影响[J].生物多样性,2013, 21(6): 709 - 714.FAN Yanrong,CHEN Shuanglin,LIN Hua,et al.Effects of different disturbance measures on spatial distribution patterns of understory plants inPhyllostachys edulisforests [J].Biodiversity Sci,2013,21(6):709 - 714.
[11] YANG Hao.Effects of nitrogen and phosphorus addition on leaf nutrient characteristics in a subtropical forest [J].Trees,2017,doi:2017,10.1007/s00468-017-1636-1.
[12] 赵芳,欧阳勋志.飞播马尾松林林下植被盖度与环境因子的关系[J].应用生态学报,2015,26(4):1071-1076.ZHAO Fang,OUYANG Xunzhi.Relationships between understory vegetation coverage and environental factors inPinus massonianaplantations from aerial seedling [J].Chin J Appl Ecol,2015,26(4):1071 - 1076.
[13] 陆树刚,陈风.论蕨类植物生态类型的划分问题[J].云南大学学报(自然科学版),2013,35(3):407-415.LU Shugang,CHEN Feng.On the pteridophyte ecological types [J].J Yunnan Univ Nat Sci Ed,2013,35(3):407 -415.
[14] 陈波,金盛杨,黄瑞建,等.浙江天童国家森林公园内几种蕨类植物的能量特征分析[J].浙江大学学报(理学版), 2010, 37(2): 214 - 220.CHEN Bo,JIN Shengyang,HUANG Ruijian,et al.Energy analysis of several ferns in the Tiantong Nation Forest Park [J].J Zhejiang Univ Sci Ed,2010,37(2):214 - 220.
[15] SESSA E B,GIVNISH T J.Leaf form and photosynthetic physiology ofDryopterisspecies distributed along light gradients in eastern north America [J].Funct Ecol,2014,28:108 - 123.
[16] 吕铖香,张明如,邹伶俐.模拟酸雨与光强处理对芒萁叶绿素及荧光特性的影响[J].浙江农林大学学报,2015, 32(1): 52 - 59.LU Chengxiang,ZHANG Mingru,ZOU Lingli.Chlorophyll fluorescence characteristics with simulated acid rain and light intensity treatments forDicranopteris dichotoma[J].J Zhejiang A&F Univ,2015,32(1):52 - 59.
[17] 张晓勤,吴克利,薛大伟.湿害对不同大麦基因型抗氧化酶系统的影响[J].浙江大学学报(农业与生命科学版), 2009,35(3): 315 - 320.ZHANG Xiaoqin,WU Keli,XUE Dawei.Effects of waterlogging stress on antioxidative enzyme system in different barley genotypes [J].J Zhejiang Univ Agric Life Sci,2009,35(3):315 - 320.
[18] 刘柿良,马明东,潘远智,等.不同光强对两种桤木幼苗光合特性和抗氧化系统的影响[J].植物生态学报,2012, 36(10): 1062 - 1074.LIU Shiliang,MA Mingdong,PAN Yuanzhi,et al.Effects of light regimes on photosynthetic characteristics and antioxidant system in seedlings of two alder species [J].Chin J Plant Ecol,2012,36(10):1062 - 1074.
[19] 吴月燕,项锡娜,王忠华,等.光胁迫对容器幼苗生长和生理生化特性的影响[J].植物生理学报,2013,49(5): 469 - 476.WU Yueyan,XIANG Xina,WANG Zhonghua,et al.Effects of light stress on the physiological,biochemical characteristics and growth of vessel seedling [J].Plant Physiol J,2013,49(5):469 - 476.
[20] 刘婷,刘卫国,任梦露,等.遮荫程度对不同耐荫性大豆品种光合及抗倒程度的影响[J].中国农业科学,2016, 49(8): 1466 - 1475.LIU Ting,LIU Weiguo,REN Menglu,et al.Effects of shade degrees on photosynthesis and lodging resistance degree of different shade tolerance soybean [J].Sci Agric Sin,2016,49(8):1466 - 1475.
[21] 秦玉芝,邢铮,邹剑锋,等.持续弱光胁迫对马铃薯苗期生长和光合特性的影响[J].中国农业科学,2014, 47(3): 537 - 545.QIN Yuzhi,XING Zheng,ZOU Jianfeng,et al.Effects of sustained weak light on seedling grown and photosynthetic characteristics of potato seedlings [J].Sci Agric Sin,2014,47(3):537 - 545.
[22] 杨舒骀,陈晓阳,惠文凯,等.逆境胁迫下植物抗氧化酶系统响应研究进展[J].福建农林大学学报(自然科学版), 2016, 45(5): 481 - 489.YANG Shudai,CHEN Xiaoyang,HUI Wenkai,et al.Progress in responses of antioxidant enzyme systems in plant to environmental stresses [J].J Fujian Agric For Univ Nat Sci Ed,2016,45(5):481 - 489.
[23] FARQUHAR G D,von CAEMMERER S,BERRY J A.Models of photosynthesis [J].Plant Physiol,2001,125(1):42 -45.
[24] 王学奎.植物生理化实验原理和技术[M].北京:高等教育出版社,2006.
[25] 韩霜,陈发棣.植物对弱光的响应研究进展[J].植物生理学报,2013,49(4):309-316.HAN Shuang,CHEN Fadi.Research progress in plant response to weak light [J].Plant Physiol J,2013,49(4):309-316.
[26] 殷东生,沈海龙.森林植物耐荫性及其形态和生理适应性研究进展[J].应用生态学报,2016,27(8):2687-2698.YIN Dongsheng,SHEN Hailong.Shade tolerance and the adaptability of forest plants in morphology and physiology:a review [J].Chin J Appl Ecol,2016,27(8):2687 - 2698.
[27] TSVUURA Z,GRIFFITHS M E,GUNTON R M,et al.Ecological filtering by a dominant herb selects for shade tolerance in the tree seedling community of coastal dune forest[J].Oecologia,2010,164(4):861 - 870.
[28] 朱婷婷,王懿祥,朱旭丹,等.遮光对木荷和枫香光合特性的影响[J].浙江农林大学学报,2017,34(1):28-35.ZHU Tingting,WANG Yixiang,ZHU Xudan,et al.Photosynthetic characteristics with shading forSchima superbaandLiquidambar formosana[J].J Zhejiang A&F Univ,2017,34(1):28 - 35.
[29] DRAKE P L,FROEND H R,FRANKS P J.Smaller,faster stomata:scaling of stomatal size,rate of response,and stomatal conductance [J].J Exp Bot,2013,64:495-505.
[30] 熊慧,马承恩,李乐,等.不同生境条件下蕨类和被子植物的气孔形态特征及其对光强变化的响应[J].植物生态学报, 2014, 38(8): 868-877.XIONG Hui,MA Cheng’en,LI Le,et al.Stomatal characteristics of ferns and angiosperms and their responses to changing light intensityat different habitats [J].Chin J Plant Ecol,2014,38(8):868-877.
[31] FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis [J].Annu Rev Plant Physiol,1982,33:317-345.
[32] 裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013, 33(5): 1386-1396.PEI Bin,ZHANG Guangcan,ZHANG Shuyong,et al.Effects of soil drought stress on photosynthetic characteristic and antioxidant enzyme activities inHippophae rhamnoidesLinn.seedlings [J].Acta Ecol Sin,2013,33(5):1386-1396.
[33] 代英超,徐奎源,马凯,等.珍稀濒危植物堇叶紫金牛对持续干旱的生理响应[J].生态学报,2015,35(9):2954-2959.DAI Yingchao,XU Kuiyuan,MA Kai,et al.Physiological responses of the rare and endangeredArdisia violacea(Myrsinaceae) seedlings to progressive drought stress [J].Acta Ecol Sin,2015,35(9):2954-2959.
[34] GONG Jirui,LIU Min,XU Sha,et al.Effects of light deficiency on the accumulation of sailosaponins and the ecophysiological characteristics of wildBupleurum chinenseDC.in China [J].Ind Crops Prod,2017,99:179-188.
[35] 吕铖香.芒萁对光强与4种乔木枯落叶覆盖处理的光合生理生态响应特征[D].杭州:浙江农林大学,2014.LÜ Chengxiang.The Photosynthetic and Ecological Eesponse of Dicranopteris dichotoma under the Light Intensity and4Kinds of Tree Litter Cover[D].Hangzhou:Zhejiang A&F University,2014.
[36] JIA Xia,ZHAO Yonghua,LIU Tuo,et al.Leaf defense system ofRobinia pseudoacaciaL.seedlings exposed to 3 years of elevated atmospheric CO2and Cd-contaminated soils [J].Sci Total Environ,2017,605:48-57.
[37] SUN Jing,GU Jing,ZENG Jun,et al.Changes in leaf morphology,antioxidant activity and photosynthesis capacity in two different drought-tolerant cultivars of chrysanthemum during and after water stress [J].Sci Hortic,2013,161:249-258.
[38]VULETA A,JOVANOVI'C S M,TUCI'C B,et al.Adaptive flexibilty of enzymatic antioxidants SOD,APX and CAT to high light stress:the clonal perennial monocotIris pumilaas a study case[J].Plant Physiol Biochem,2016,100:166-173.
[39] 孙帅,张小晶,刘金平,等.遮阴和干旱对荩草生理代谢及抗性系统影响的协同作用[J].生态学报,2018, 38(5): 1-10.SUN Shuai,ZHANG Xiaojing,LIU Jinping,et al.Synergistic effects of shade and drought on the physiological metabolism and resistance system ofArthraxon hispidus[J].Acta Ecol Sin,2018,38(5):1-10.
[40] 郭慧媛,马元丹,王丹,等.模拟酸雨对毛竹抗氧化酶活性及释放绿叶挥发物的影响[J].植物生态学报,2014, 38(8):896-903.GUO Huiyuan,MA Yuandan,WANG Dan,et al.Effects of simulated acid on the ativity of antioxidant enzyme and the emission of induced green leaf volatiles inPhyllostachys pubescens[J].Chin J Plant Ecol,2014,38(8):896-903.
[41] 陶宏征,赵昶灵,李唯奇.植物对低温的光合响应[J].中国生物化学与分子生物学报,2012,28(6):501-508.TAO Hongzheng,ZHAO Changling,LI Weiqi.Photosynthetic response to low temperature in plant [J].Chin J Biochem Mol Biol,2012,28(6):501-508.

