羊角槭愈伤组织诱导、增殖与分化
胡佳卉,王小德
(浙江农林大学 风景园林与建筑学院,浙江 杭州311300)
羊角槭Acer yangjuechi是槭树科Aceraceae槭属Acer落叶乔木。该种仅分布于浙江西天目山狭窄的范围,生长于海拔700 m的疏林中[1],为浙江省特有种,其数量极少,长势衰退。羊角槭种子繁殖能力低,天然更新能力较弱,已经陷入灭绝的险境,是中国仅存10株以下的珍稀植物之一[2],被列为国家二级保护植物。羊角槭系古老的残遗种,与产自日本的日本羊角槭Acer myabei关系密切,对研究东亚植物区系的起源、演化以及古气候、古地理变迁具有重要价值。植物组织培养技术对物种种质保存、植物育种等方面具有促进作用。目前,国内对羊角槭的研究主要包括种子生物学特征的测定以研究种子深度休眠的原因[3]、 光能和水分利用效率[4]、 基因组DNA提取[5]及叶绿素荧光特性研究[6]等方面, 而以羊角槭外植体为材料进行愈伤组织诱导及植株再生方面的研究还未见报道。为解决羊角槭繁殖系数低、繁殖速度慢,优良品种的推广与培育受到限制,无法满足大规模生产需要的问题,以羊角槭的嫩茎和叶片为外植体材料,研究了不同消毒方法、不同基本培养基及不同植物生长调节剂组合对羊角槭愈伤组织的诱导、增殖及分化的影响,筛选出最适宜诱导愈伤组织的外植体及培养基配比,为建立羊角槭高效的快繁技术体系奠定基础。
1 材料与方法
1.1 材料
以5~6年生羊角槭当年生幼嫩茎段和叶片为外植体。试验在浙江农林大学园林学院组培室进行,样品于2017年4-6月采自浙江农林大学珍稀植物园。
1.2 方法
1.2.1 外植体处理及消毒 天气晴朗的清晨,剪取生长状况良好、无病虫害的羊角槭当年生幼嫩茎段和叶片,装袋带回实验室备用。用流水轻轻洗净表面污渍,后用洗洁精溶液浸泡5 min,漂净后用流水冲洗2 h,沥干水后置于超净工作台,用体积分数为75%的乙醇消毒30 s,无菌水冲洗3~5遍,后再用1.0 g·kg-1的氯化汞(HgCl2)浸泡消毒,叶片消毒8 min,茎段消毒10 min,无菌水冲洗3~5遍,消毒完后用无菌滤纸吸干表面水分,在超净工作台上将叶片切成0.5 cm×0.5 cm大小的方块,茎段切成0.5~1.0 cm的小段待接种。
1.2.2 外植体取样时间选择 分别于4月(处理1)和6月(处理2)剪取生长状况良好、无病虫害的羊角槭幼嫩茎段和叶片,处理消毒后接种于木本植物培养基(WPM培养基)+0.5 mg·L-16-苄氨基腺嘌呤(6-BA)+0.3 mg·L-1萘乙酸(NAA)的培养基中, 接种 15 瓶·处理-1, 接种外植体 2 个·瓶-1, 重复 3 次, 7 d 后统计不同月份取样的存活率、污染率。
1.2.3 外植体消毒方法选择 为确定外植体最佳消毒方法,选择乙醇30 s+氯化汞8 min(处理1),乙醇30 s+氯化汞10 min(处理2),乙醇30 s+氯化汞12 min(处理3)3种消毒方法对羊角槭外植体进行表面消毒,消毒完后接种于 WPM+0.5 mg·L-16-BA+0.3 mg·L-1NAA 的培养基中, 接种 15瓶·处理-1,接种外植体2个·瓶-1,重复3次,7 d后统计污染率,30 d后统计诱导率。
1.2.4 外植体类型对诱导的影响 分别以羊角槭的嫩茎(处理1)和嫩叶(处理2)为外植体,消毒处理后接种于 WPM+0.5 mg·L-16-BA+0.3 mg·L-1NAA 的培养基中, 接种 15 瓶·处理-1, 接种外植体 2 个·瓶-1,重复3次,30 d统计愈伤组织诱导情况。
1.2.5 愈伤组织诱导最佳培养基筛选 以1/2MS,MS和WPM为基本培养基,植物生长调节剂选择NAA(0.1, 0.2, 0.3 mg·L-1), 激动素(KT)(0, 0.5, 1.0 mg·L-1), 6-BA(0.5, 1.0, 1.5 mg·L-1), 根据L9(3)4设计四因素三水平正交试验表,共配置9组培养基,另配置3组只添加基本培养基不添加任何植物生长调节剂的培养基作为对照(表1),接种15瓶·处理-1,接种外植体2个·瓶-1,重复3次,30 d后统计愈伤组织诱导情况。愈伤组织诱导率=产生愈伤组织的外植体数/接种的外植体总数×100%。
1.2.6 愈伤组织增殖最佳培养基筛选 根据愈伤组织诱导结果,选取WPM+1.0 mg·L-16-BA为培养基固定成分,分别添加0,0.05,0.10,0.15 mg·L-1的NAA,将诱导出的生长较好的愈伤组织切成大小相近的颗粒,接种到增殖培养基中,30 d后测定愈伤组织的鲜质量增量,统计增殖倍数。愈伤组织增殖倍数=培养后愈伤组织质量/接入时愈伤组织质量。
1.2.7 愈伤组织分化最佳培养基筛选 以WPM为基本培养基, 1.0 mg·L-16-BA+0.1 mg·L-1NAA 为固定植物生长调节剂成分,分别添加0.5,1.0,1.5,2.0 mg·L-1的TDZ,将诱导及增殖出的生长较好的愈伤组织切成大小相近的颗粒,接种到分化培养基中,30 d后统计出芽数及分化率。愈伤组织分化率=分化出芽的愈伤组织数/接种的愈伤组织总数×100%。
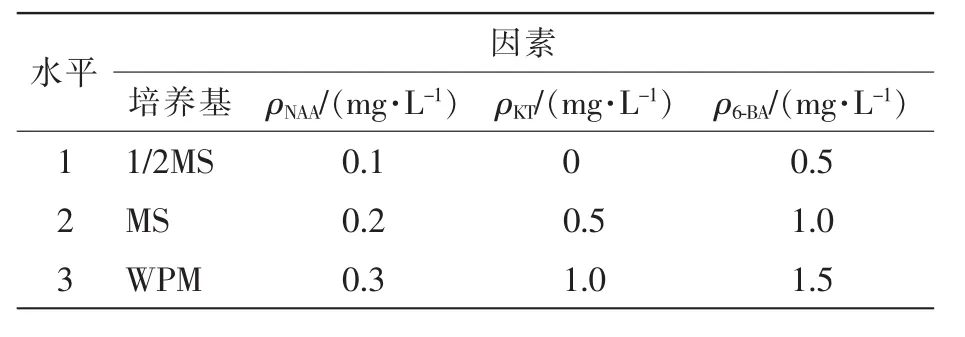
表1 诱导培养各因素质量浓度设置Table 1 Concentration of various factors about induction
1.3 培养条件
所有培养基均添加蔗糖 30 g·L-1, 琼脂粉 7 g·L-1, 调节 pH 值至 pH 5.8, 并在 121 ℃,1.1 kg·cm-2压力下高温高压灭菌 20 min待用。培养基接种外植体2个·瓶-1,接种15瓶·处理-1,3次重复。接种后的材料在光照强度2 000 lx,光照12 h·d-1,温度(25±2)℃的培养室中进行培养。
1.4 数据统计与分析
试验数据采用SPSS 19.0进行方差及极差分析[7],对于差异显著者采用Tukey多重比较,字母法标记;作图在Excel软件下完成。
2 结果与分析
2.1 外植体取样时间选择
处理1的外植体污染率为11.5%,处理2同样消毒方法处理的外植体接种后污染率为61.7%(表 2),显著(P<0.05)高于处理 1, 且处理1的愈伤组织膨大早、生长速度较快,而处理2的愈伤组织生长较为缓慢,说明4月为羊角槭嫩茎嫩叶采样的最佳时期。

表2 不同取样时间的污染率Table 2 Contamination rate at different sampling times
2.2 外植体消毒方法选择
3种处理污染率存在显著差异(P<0.05),从高到底依次为处理1,处理2和处理3,污染率分别为25.0%,20.6%和4.7%,而3种处理的诱导率也存在显著差异(P<0.05),从高到低依次是处理2,处理3和处理1,诱导率分别为79.1%,68.3%和67.8%(表3)。随着氯化汞消毒时间的增加,污染率依次降低,诱导率先升高后降低,说明适当时间的氯化汞消毒有利于防治外植体污染,但消毒时间过长可能导致外植体失去生活力从而抑制诱导。综合污染率和诱导率来看,羊角槭外植体最适合的消毒方法为体积分数为75%的乙醇30 s+1.0 g·kg-1氯化汞10 min。

表3 不同消毒方法的污染率和诱导率Table 3 Contamination rate and Induction rate by different disinfection methods
2.3 外植体类型对诱导的影响
不同的羊角槭外植体接种到相同的培养基上,第7天后茎段开始膨大,从切口处慢慢开始出现瘤状物,叶片在第5天后开始卷曲,在第18天后切口靠近叶脉处开始出现颗粒状物,且极为细小。30 d后统计结果如表4所示:茎段和叶片的诱导率存在显著差异(P<0.05),茎段的诱导率为54.7%,叶片的诱导率为34.0%,茎段愈伤组织颗粒大、愈伤量多,叶片虽也有一定程度的愈伤量,但愈伤组织颗粒小、不能成块。由此可见,茎段是羊角槭愈伤组织诱导的最佳外植体。
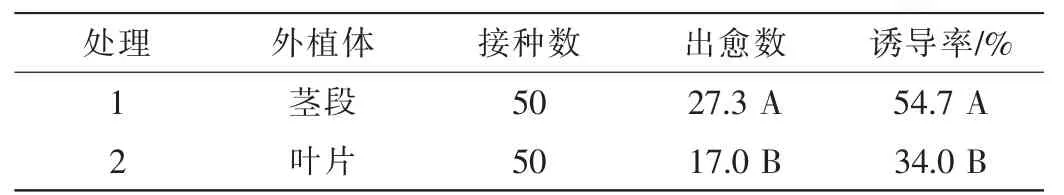
表4 不同外植体的出愈数与诱导率Table 4 Amount of callus and induction rate of different explants
2.4 愈伤组织诱导最佳培养基筛选
不同基本培养基[8]和植物生长调节剂组合均对羊角槭愈伤组织的诱导有不同程度的促进作用。从不同外植体来看,茎段愈伤组织诱导率高于叶片愈伤组织,茎段膨大产生颗粒较大的淡黄色或略偏红色的或紧致或疏松的愈伤组织,叶片蜷缩,且仅在靠近叶柄的位置长出淡青色的颗粒极小的愈伤组织,均不利于继代增殖。茎段在添加了植物生长调节剂的培养基中均诱导出愈伤组织,愈伤诱导率为21.17%~62.90%,愈伤组织的数量及形态方面存在差异。1~3号诱导出的愈伤组织偏红色,呈小颗粒状,愈伤发生量较少,4~6号诱导出的愈伤组织呈白淡黄色,质地松软,颗粒较大,7~9号诱导出的愈伤组织呈淡黄色淡绿色,大颗粒状,有致密有松软。
表5显示:基本培养基对愈伤组织诱导率有显著影响(P<0.05),NAA,KT和6-BA对愈伤组织诱导率的影响不显著,但影响程度略有差异,从高到低依次为6-BA,NAA和KT。综合表5数据可得,最适宜于羊角槭愈伤组织诱导的培养基为 WPM+0.3 mg·L-1NAA+0.5 mg·L-1KT+0.5 mg·L-16-BA。
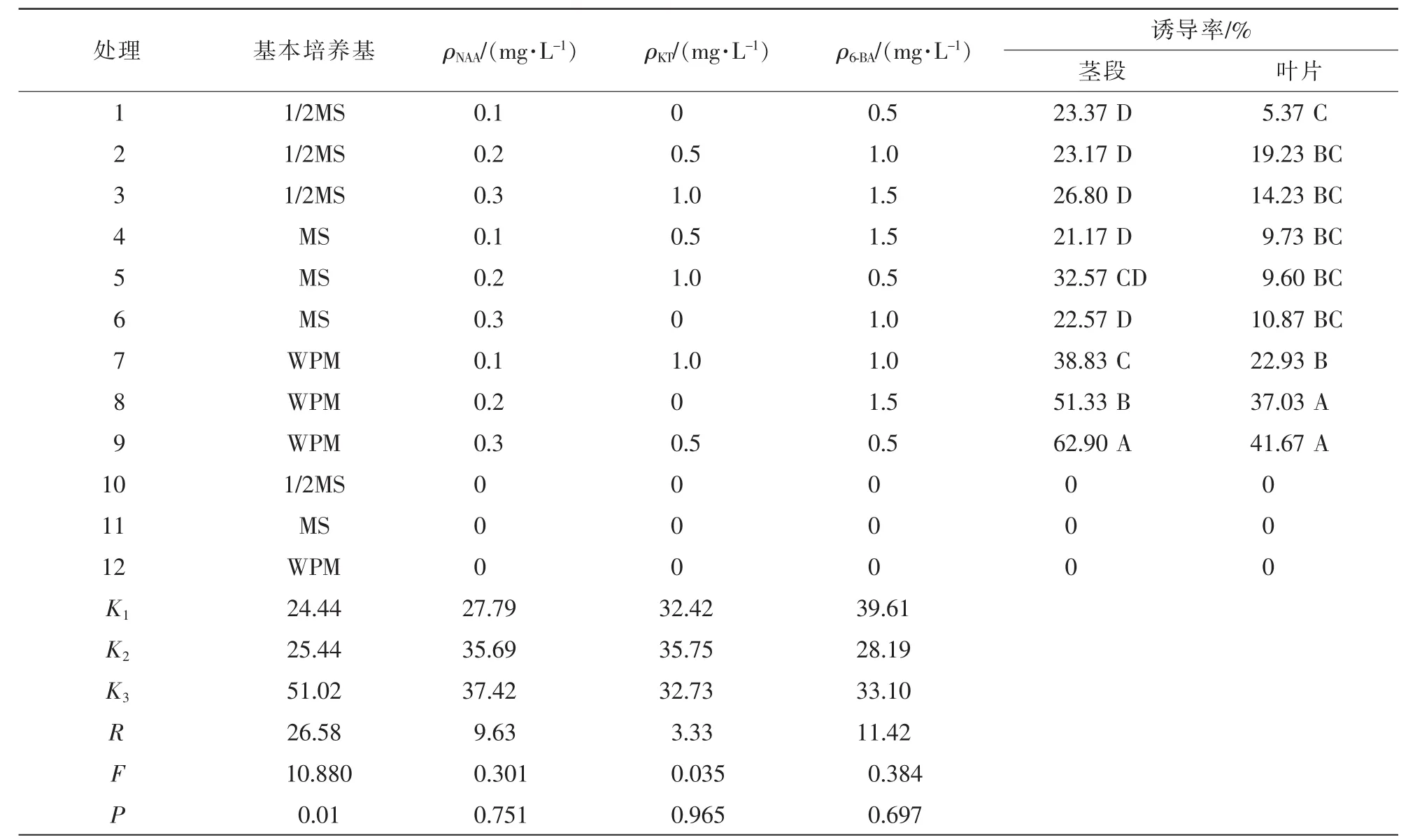
表5 愈伤组织诱导正交试验结果Table 5 Orthogonal design and results for callus induction
2.5 愈伤组织增殖最佳培养基筛选
由表6可知:植物生长调节剂对愈伤组织的增殖有促进作用。当6-BA质量浓度不变时,愈伤组织的增殖倍数随着NAA质量浓度的增加先变大后减小,不添加NAA的处理组增殖不明显,4个处理之间增殖倍数差异不显著(P>0.05),添加0.1 mg·L-1NAA的处理3增殖倍数最大,为2.40,增殖效果最佳,愈伤组织膨大最明显,新产生呈淡绿色的愈伤组织。由此可见,最适宜于羊角槭愈伤组织增殖的培养基为WPM+1.0 mg·L-16-BA+0.1 mg·L-1NAA。
2.6 愈伤组织分化最佳TDZ质量浓度筛选
将生长良好的愈伤组织分别接种到TDZ质量浓度不同的4种处理培养基中诱导不定芽,培养30 d后,4种处理培养基中均无明显的不定芽产生,但其生长情况有所不同。4种处理中愈伤组织均有增殖膨大,表面有颗粒状突起,产生或浅绿色或白绿色的芽点,处理2新增愈伤组织呈深红褐色,处理3呈浅绿色。4种处理中,随着TDZ质量浓度的增加,产生的芽点数量也随之增加,说明TDZ质量浓度对愈伤组织的分化有一定影响,较高质量浓度的TDZ能促进愈伤组织产生较多不定芽芽点,对愈伤组织分化有促进作用。
3 结论与讨论
3.1 结论
本研究分别在4和6月进行羊角槭愈伤组织诱导。结果表明:4月愈伤组织生长快、出愈率大、污染率低。4月正值羊角槭生长季节,较6月更适宜做愈伤组织诱导试验。在外植体消毒试验中,选用了乙醇与氯化汞不同消毒时间的组合。根据培养后外植体的污染率和诱导率,得出羊角槭外植体最佳消毒方法为体积分数为75%乙醇消毒30 s+1.0 g·kg-1氯化汞消毒10 min。根据培养后愈伤组织生长情况可知,最适宜于羊角槭愈伤组织诱导的外植体是其嫩茎,嫩茎愈伤组织诱导率高、诱导出的愈伤组织量大, 利于继代培养。 羊角槭愈伤组织诱导最佳培养基为 WPM+0.3 mg·L-1NAA+0.5 mg·L-1KT+0.5 mg·L-16-BA,增殖最佳培养基为WPM+1.0 mg·L-16-BA+0.1 mg·L-1NAA,TDZ质量浓度的增加有利于羊角槭愈伤组织产生更多不定芽芽点,但诱导其愈伤组织分化出明显不定芽的培养基配比还有待进一步研究。
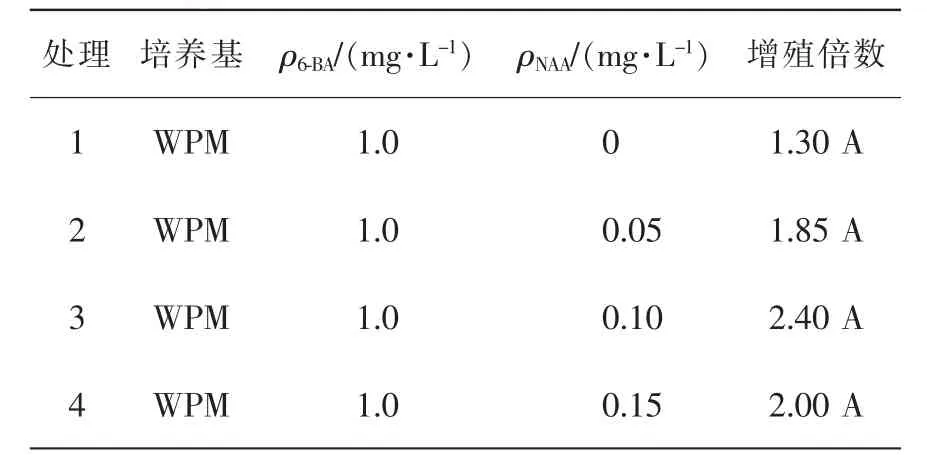
表6 植物生长调节剂对愈伤组织增殖的影响Table 6 Effect of different plant hormones on callus proliferation

表7 植物生长调节剂对愈伤组织分化的影响Table 7 Effect of different plant hormones on callus differentiation
3.2 讨论
4月取材的羊角槭外植体较之6月取材的外植体污染率低,且萌动早、生长速度快,出愈率高,更适宜于做初代培养。4月羊角槭处于叶芽萌动、展叶时期,此时植株长速快,新生幼嫩茎叶易于灭菌。6月取材的羊角槭外植体污染率较高,提高氯化汞灭菌时间也难以降低其污染率,且出愈率较低,可能因为其茎叶生长成熟,菌类等污染物侵入木质部等细胞组织,表面消毒难以达到消毒目的。组培所选外植体若为茎段,应选中度木质化的材料。不同树种的采条最佳时间不同,不同的发生途径对最佳外植体有一定的要求,因此,外植体选择与发生途径应同时考虑,将两者有机结合起来[9]。
植物生长调节剂是植物组织培养中的关键物质。外植体的诱导和增殖不仅与植物生长调节剂的种类有关,还与其质量浓度及配比有关[10-11]。植物生长调节剂在植物不同的发育阶段起决定性作用,其作用和效果也与外植体及愈伤组织本身内源激素的种类和质量浓度有重要关系。在植物组织培养过程中,适宜质量浓度的细胞分裂素6-BA可以有效地诱导芽的萌发与不定增殖,而适宜质量浓度的生长素可以促进茎的伸长[12];2,4-D,KT,NAA等植物生长调节剂的配比使用有利于外植体愈伤组织的形成,且NAA质量浓度越高,形成的愈伤组织质地越好[13]。本研究结果表明:基本培养基类型,6-BA,NAA和KT等植物生长调节剂的质量浓度配比都能促进羊角槭愈伤组织诱导,但愈伤组织的诱导率、生长状态存在一定差异。木本植物培养基(WPM)较之MS和1/2MS对愈伤组织诱导有更好的效果。在3种植物生长调节剂中,6-BA处理对羊角槭愈伤组织诱导的效果最明显。愈伤组织在培养基上生长一段时间后,营养物枯竭,水分散失,并已经积累了一些可能对愈伤组织产生有害影响的代谢产物,此时需要将这些组织转移到新的培养基上[14]。在愈伤组织增殖阶段,愈伤组织的增殖倍数随着NAA质量浓度的增加先上升后下降,NAA质量浓度为0.1 mg·L-1时,增殖倍数最大为2.40,说明NAA对愈伤组织增殖有促进作用,但NAA质量浓度过高会抑制愈伤组织的发生,NAA与6-BA的质量浓度配比为1∶10时增殖效果最佳。这与刘艳丽等[15]诱导盾叶薯蓣Dioscorea zingibernsis愈伤组织的结果相似。愈伤组织诱导不定芽分化的试验中,植物生长调节剂的种类比例对分化的影响十分重要。本研究愈伤组织分化阶段,添加TDZ有利于羊角槭愈伤组织产生更多不定芽芽点,说明TDZ是诱导不定芽分化的重要生长调节剂。这与白芨Bletilla striata[16]愈伤组织分化成不定芽的试验结果相似。但本研究中愈伤组织只分化出芽点,并未分化出明显不定芽,这可能是试验方案中6-BA,NAA与TDZ的植物生长调节剂组合对羊角槭愈伤组织分化出芽的影响不明显,促使其分化成芽的植物生长调节剂组合配比还有待进一步的研究。
4 参考文献
[1] 方文培,包士英.中国植物志:第46卷[M].北京:科学出版社,1981.
[2] 张若蕙.浙江珍稀濒危植物[M].杭州:浙江科学技术出版社,1994.
[3] 许小连,金荷仙,陈香波,等.濒危树种羊角槭种子基本生物学特征[J].林业科技开发,2012,26(3):46-49.XU Xiaolian,JIN Hexian,CHEN Xiangbo,et al.Biological characteristics of the seed inAcer yanjuechi,an endangered species [J].For Sci Technol,2012,26(3):46 - 49.
[4] 王晓燕,杨淑贞,赵明水,等.濒危植物天目铁木和羊角槭的光合及蒸腾特性日动态比较[J].华东师范大学学报(自然科学版), 2015(2): 113 - 121.WANG Xiaoyan,YANG Shuzhen,ZHAO Mingshui,et al.Comparative diurnal variations in photosynthesis and transpiration of endangered plant species,Ostrya rehderianaandAcer yangjuechi[J].J East China Norm Univ Nat Sci,2015(2):113 - 121.
[5] 李倩中,刘晓宏,苏家乐,等.羊角槭基因组DNA提取及SRAP-PCR体系优化[J].江苏农业学报,2009,25(3): 538 - 541.LI Qianzhong,LIU Xiaohong,SU Jiale,et al.Extraction of genomic DNA fromAcer yangjuechiand system optimization of SRAP-PCR [J].J Jiangsu Agric Sci,2009,25(3):538 - 541.
[6] 钟泰林,李根有,石柏林.3种浙江特产濒危植物气体交换特征和叶绿素荧光特性研究[J].上海交通大学学报(农业科学版), 2009, 27(2): 149 - 152, 176.ZHONG Tailin,LI Genyou,SHI Bailin.Comparison of gas exchange and chlorophyll fluorescence parameters in three endangered species of Zhejiang Province [J].J Shanghai Jiaotong Univ Agric Sci,2009,27(2):149 - 152,176.
[7] 李洪成,姜宏华.SPSS数据分析教程[M].北京:人民邮电出版社,2012.
[8] ABOBKAR I M,AHMED M,ABOBKAR I M,et al.Plant tissue culture media [C]//LEVA A,RINALDI L M R.Recent Advances in Plant in Vitro Culture.Rijeka:Janeza Trdine,2012:30-40.
[9] 黄烈健,王鸿.林木植物组织培养及存在问题的研究进展[J].林业科学研究,2016,29(3):464-470.HUANG Liejian,WANG Hong.Advances in tissue culture techniques of trees and the problems existed [J].For Res,2016,29(3):464 - 470.
[10] 韩登媛,李旦,赵健,等.华北落叶松胚性愈伤组织诱导影响因子的研究[J].林业科学研究,2013,26(4):454-458.HAN Dengyuan,LI Dan,ZHAO Jian,et al.Factors affecting induction of embryogenic callus ofLarix principis-rupprechtii[J].For Res,2013,26(4):454 - 458.
[11] CAI Xiaodong,WANG Guiyuan,CAO Wenjuan.In vitro induction and proliferation of callus from immature cotyledons and embryos ofJuglans regiacv. ‘Xiangling’ [J].Not Bot Horti Agrobot,2013,41(2):378 - 384.
[12] 陈菊,陈国惠.6-BA与NAA浓度配比对何首乌不定芽增殖的影响[J].中国农学通报,2006,22(11):173-175.CHEN Ju,CHEN Guohui.Study of the concentration of 6-BA and NAA in the rapid propagation ofPolygonum multiflorumThunb.[J].Chin Agric Sci Bull,2006,22(11):173 - 175.
[13] 何诗虹,王跃华,唐旭,等.羌活植物离体培养及植株再生研究[J].中药材,2017,40(7):1525-1528.HE Shihong,WANG Yuehua,TANG Xu,et al.Study on vitro culture and plant regeneration ofNotopterygium incisumTing ex H.T.Chang [J].J Chin Med Mat,2017,40(7):1525 - 1528.
[14] AHMAD I,HUSSAIN T,ASHRAF I,et al.Lethal effects of secondary metabolites on plant tissue culture [J].Agric Environ Sci,2013,13(4):539 - 547.
[15] 刘艳丽,姚家玲,张友德.盾叶薯蓣愈伤组织诱导研究[J].华中农业大学学报,2004,23(4):389-392.LIU Yanli,YAO Jialing,ZHANG Youde.Study on callus inducement fromDioscorea zingibernsisWright [J].J Huazhong Agric Univ,2004,23(4):389 - 392.
[16] 石云平,赵志国,唐凤鸾,等.白芨愈伤组织诱导、增殖与分化研究[J].中草药,2013,44(3):349-353.SHI Yunping,ZHAO Zhiguo,TANG Fengluan.Induction,proliferation,and differentiation ofBletilla striatacallus[J].Chin Trad Herbal Drugs,2013,44(3):349 - 353.

