晚期糖基化终末产物诱导人卵巢颗粒细胞株COV434凋亡并上调促炎因子HMGB1自分泌*
曾 真, 李建华, 谢新平△
(1福建医科大学生理学与病理生理学系, 福建 福州 350108; 2福建医科大学附属第一医院妇产科, 福建 福州 350005)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种以高雄激素血症、排卵障碍以及多囊卵巢为特征的病变,约困扰10%的育龄期妇女,是育龄期妇女常见的一种内分泌和代谢紊乱性疾病,常导致女性不孕。关于PCOS的发病机制,目前尚未明确定论。临床流行病学研究显示,育龄期PCOS患者血清、卵泡液及卵巢组织颗粒细胞层晚期糖基化终末产物(advanced glycation end products,AGEs)水平显著高于正常育龄期女性,推测AGEs可能通过改变卵泡的微环境,卵泡发育进程受阻,排卵障碍,最终导致女性不孕[1-3]。本研究将AGEs与人卵巢颗粒细胞株COV434共同孵育,观察细胞的凋亡情况,并探讨其可能的机制。
材 料 和 方 法
1 材料
1.1细胞株 人卵巢颗粒细胞株COV434(上海君瑞生物技术有限公司)。
1.2主要试剂 晚期糖基化终末产物牛血清白蛋白(BioVision);DMEM培养基和青-链霉素(Gibco);胎牛血清(杭州四季青公司);Annexin V凋亡检测试剂盒(eBioscience);生化检测试剂盒(南京建成生物工程研究所);抗caspase-3和cleaved caspase-3抗体(Abcam);抗β-actin抗体及II抗(Santa Cruz);高迁移率族蛋白B1(high mobility group box 1 protein, HMGB1) ELISA 检测试剂盒(Shino-Test)。
2 方法
2.1细胞培养 人卵巢颗粒细胞株COV434用含10%胎牛血清的DMEM细胞培养液在37 ℃、5% CO2培养箱中进行培养。每3 d传代 1 次,所有细胞均采用处于对数生长期的细胞,细胞培养至生长密度达到75%时用于实验。
2.2AGEs处理细胞 用无血清的培养液同步化6 h,将细胞随机分成正常对照(control)组和AGEs处理(50 mg/L、100 mg/L和200 mg/L)组。各组分别于药物处理后继续培养24 h,每个浓度设6个复孔。
2.3流式细胞术检测细胞凋亡 用Annexin V 和PI染色,检测凋亡细胞比例。细胞经胰酶消化后,PBS洗涤细胞1次,1×Binding 缓冲液洗涤细胞1次。细胞重悬于1×Binding 缓冲液100 μL,加入Annexin V吹打混匀,室温避光孵育15 min,1×Binding 缓冲液洗涤细胞1次,1 000 r/min离心5 min。细胞重悬于1×Binding 缓冲液200 μL,加入PI吹打混匀,流式细胞仪随机计数10 000个细胞并计算凋亡细胞百分率。
2.4Western blot 检测细胞内蛋白的水平 用PBS洗涤各组细胞,每孔加入蛋白裂解液和蛋白酶抑制剂,冰上裂解20 min,提取总蛋白,测定各样本蛋白浓度,蛋白煮沸变性后,行10% SDS-PAGE。电泳结束后,将蛋白转移至PVDF膜上,含5% BSA的TBST室温封闭2 h,加入I抗4 ℃ 孵育过夜;加入HRP标记的 II抗,室温孵育1 h,化学发光试剂ECL A液和B液检测,IS2000R图像工作站成像。
2.5ELISA检测培养液HMGB1的水平 收集各处理组细胞培养液上清,ELISA测定人卵巢颗粒细胞培养液上清中HMGB1的含量。具体操作步骤按试剂盒说明书进行。
3 统计学处理
采用统计软件SPSS 18.0对实验数据进行统计分析,所有计量资料以均数±标准差(mean±SD)表示,进行单因素方差分析,多组间两两比较采用Student-Newman-Kueuls检验。以P<0.05为差异有统计学意义。
结 果
1 AGEs对人卵巢颗粒细胞株COV434凋亡的影响
AGEs与卵巢颗粒细胞共同孵育24 h后,100 mg/L AGEs组和200 mg/L AGEs组人卵巢颗粒细胞早、晚期凋亡率均显著增加,与对照组比较具有显著性差异(P<0.05),见图1。
2 AGEs对人卵巢颗粒细胞株COV434中caspase-3和cleaved caspase-3蛋白水平的影响
AGEs与人卵巢颗粒细胞共同孵育,Western blot结果发现,各组人卵巢颗粒细胞caspase-3蛋白水平的差异无统计学显著性;但100 mg/L AGEs组和200 mg/L AGEs组人卵巢颗粒细胞的cleaved caspase-3蛋白水平显著增加,与对照组比较差异具有统计学显著性(P<0.05),见图2。
3 AGEs对人卵巢颗粒细胞株COV434分泌促炎介质HMGB1的影响
AGEs与人卵巢颗粒细胞共同孵育,100 mg/L AGEs组和200 mg/L AGEs组人卵巢颗粒细胞液培养上清HMGB1的蛋白分泌水平显著增加,与对照组比较差异具有统计学显著性(P<0.05),见图3。
讨 论
PCOS是以持续性无排卵、高雄激素血症和卵巢多囊样改变为特征的综合征。胰岛素抵抗和糖代谢异常是PCOS的核心病理机制。AGEs是在持续高糖状态下,体内蛋白质多肽、氨基酸、核酸和脂质与还原糖经过一系列非酶糖基化反应(即 Maillard 反应)形成的不可逆性终末期产物。AGEs主要通过2条途径发挥生物学效应:一方面通过对蛋白质、脂质和核酸等的直接修饰改变其结构和功能;二是通过与晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)结合,激活丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)、核因子κB(nuclear factor-κB, NF-κB)信号通路,促进活性氧簇和炎症介质的产生,造成细胞毒性,导致机体病理性损伤[4]。本研究结果提示AGEs牛血清白蛋白诱导人卵巢颗粒细胞凋亡,激活凋亡蛋白caspase-3,促进促炎介质HMGB1的分泌。

Figure 1. Flow cytometric detection of human ovarian granulosa cell apoptosis induced by AGEs. Mean±SD.n=6.*P<0.05vscontrol group.
图1AGEs对人卵巢颗粒细胞凋亡的影响
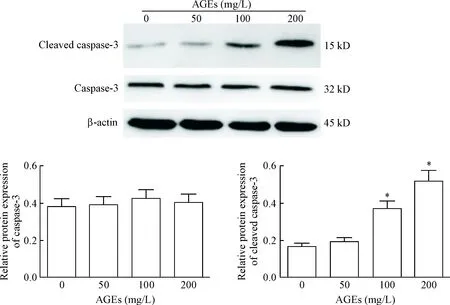
Figure 2. The effects of AGEs on the protein levels of caspase-3 and cleaved caspse-3 in human ovarian granulosa cells. Mean±SD.n=3.*P<0.05vscontrol group.
图2AGEs对人卵巢颗粒细胞caspase-3和cleavedcaspase-3蛋白表达的影响
卵巢颗粒细胞是支持卵细胞发育的重要细胞,影响卵泡启动、发育、成熟及闭锁的全过程,颗粒细胞过度凋亡会降低卵泡的发育潜能及卵母细胞质量。大量研究数据提示PCOS的发病机制与卵巢颗粒细胞凋亡有关。PCOS患者卵巢颗粒细胞促凋亡受体Fas及其配体FasL表达增加[5]。动物实验也显示PCOS模型大鼠卵泡中的颗粒细胞凋亡率增加[6]。本研究进一步明确凋亡参与PCOS的发病机理。

Figure 3. The effects of AGEs on the HMGB1 protein levels in the culture supernatant of human ovarian granulosa cells. Mean±SD.n=6.*P<0.05vscontrol group.
图3AGEs对人卵巢颗粒细胞培养上清HMGB1蛋白表达的影响
研究显示PCOS患者机体的慢性炎症状态,也参与PCOS的发病机制[7]。本研究中发现AGEs促进人卵巢颗粒细胞分泌慢性晚期炎症因子HMGB1。HMGB1在促进细胞凋亡的病理学过程中也发挥着重要作用。研究显示HMGB1也是RAGE的配体之一[8],故其可能通过受体RAGE增强诱发细胞凋亡。研究也显示通过分子生物学的方法上调或下调细胞HMGB1的表达,促进或缓解细胞凋亡[9]。
综合上述结果,我们推测PCOS患者体内高水平的AGEs通过与特异受体RAGE结合,通过跨膜信号转导,促进HMGB1的分泌,引起慢性炎症状态,促进颗粒细胞凋亡,进而导致卵泡生长停滞和卵子发育障碍。

