沙利度胺对TGF-β1 诱导HELF细胞CTGF基因启动子结合蛋白变化的干预作用*
李肖肖, 王达安, 陆大祥, 王华东, 魏 伟, 王彦平
(暨南大学基础医学院病理生理学系, 国家中医药管理局病理生理重点实验室, 广东 广州 510632)
近年来研究发现,沙利度胺(thalidomide, THD)具有良好的抗肺纤维化作用[1-3]。有资料表明,沙利度胺抑制结缔组织生长因子(connective tissue growth factor, CTGF)过表达是其干预肺纤维化进展的重要环节之一[4-5];我们曾报道,沙利度胺能抑制致纤维化细胞因子——转化生长因子β1(transforming growth factor-β1, TGF-β1)对人胚肺成纤维细胞(human embryonic lung fibroblasts, HELF)中CTGF基因启动子的激活[5]。DNA pull-down技术是用于分析基因启动子与蛋白质相互作用的方法,本研究采用DNA pull-down技术,观察TGF-β1对CTGF基因启动子结合蛋白的影响及THD的拮抗效应,以探讨THD抑制CTGF基因过表达的分子机制。
材 料 和 方 法
1 材料
HELF细胞系、核蛋白和胞浆蛋白提取试剂盒、SDS-PAGE凝胶配制试剂盒及蛋白质银染试剂盒(南京凯基);DMED细胞培养液(Gibco);小牛血清(浙江天杭);KOD-Plus (TOYOBO);DM2000 DNA ladder(广州美津);pGL3-CTGFP质粒(本实验室构建保存);pRL-SV40质粒和萤光素酶检测试剂盒Dual-Luciferase Reporter Assay System(Promega);PCR产物抽提试剂盒(Biomiga);GeneFinderTM核酸染料(厦门致善生物科技股份有限公司);琼脂糖(无锡耐思生物科技有限公司);脂质体试剂盒(Polyplus-transfection);人类重组TGF-β1(PeproTech);PMSF、蛋白酶抑制剂cocktail和THD(Sigma);PhosSTOP(Roche);μMACS FactorFinder Kit(Miltenyi Biotec)。
2 方法
2.1TGF-β1对CTGF基因启动子活性的影响及THD的干预作用分析 按每孔1×104个细胞将HELF细胞接种于含10%小牛血清、DMEM培养液的24孔培养板中,5% CO2、37 ℃中培养,待细胞生长至融合度约70%时,更换不含小牛血清的DMEM培养液培养24 h,重新更换全培养液,用脂质体将重组质粒pGL3-CTGFP转染至培养的HELF细胞中,同时转染含有海肾萤光素酶的pRL-SV40质粒作为内参照。培养24 h后,加入终浓度为5 μg/L的TGF-β1,同时按分组加入终浓度分别为0、25、50和100 μg/L的THD,另外以相同培养方法但不添加TGF-β1和THD的细胞为空白对照组。所有细胞继续培养24 h后收获细胞,按Dual-Luciferase Reporter Assay System操作手册,使用MD-SpectraMax M5多光谱微孔板阅读器(Molecular Devices)在波长为560 nm和465 nm波长处检测2种萤光素酶的发光值,以萤火虫萤光素酶发光值/海肾萤光素酶发光值的比值 (F/R) 为相对萤光素酶活性,以反映CTGF基因启动子的活性;每次每组3复孔,实验重复3次。
2.2TGF-β1对CTGF基因启动子结合蛋白影响及THD作用的分析
2.2.1生物素标记的CTGF启动子探针(CTGFP-biotin探针)的制备 根据人类CTGF基因启动子序列(GenBank登录号AF316368,-964~+62)设计合成引物(由上海捷瑞合成),5’端带生物素标记的上游引物序列为5’-CTTCCCTTTTTCTGGAAACATTGATGG-3’,下游引物序列为5’-CTGACAGGGCGAGGAGGAGGAC-3’,以pGL3-CTGFP质粒为模板,通过PCR扩增获取CTGFP-biotin探针,PCR产物长度为1 026 bp,反应条件:94 ℃预变性2 min; 94 ℃变性30 s,60 ℃退火30 s,68 ℃延伸1 min,共35个循环。扩增产物行1% 琼脂糖凝胶电泳检测,切胶并用PCR产物抽提试剂盒回收CTGFP-biotin探针,用核酸定量仪对回收产物进行DNA定量,分装保存在-20 ℃备用。
2.2.2细胞培养和处理 将HELF细胞接种于含10%小牛血清、DMEM培养液的150 mm培养皿中,每组3皿,3组共培养9皿细胞,细胞置5% CO2、37 ℃中培养,待细胞生长至融合度约70%时,更换不含小牛血清的DMEM培养液培养24 h,重新更换全培养液,按分组分别加入不同试剂,空白对照组(control group):终浓度0 μg/L TGF-β1+0 μg/L THD,TGF-β1刺激组(stimulation group):5 μg/L TGF-β1+ 0 μg/L THD和THD干预组(intervention group):5 μg/L TGF-β1+50 μg/L THD,继续培养24 h后收获细胞。
2.2.3核蛋白的提取 上述细胞培养结束后按核蛋白和胞浆蛋白提取试剂盒说明书,提取各组细胞核蛋白:胰酶消化后收集细胞,同组3皿细胞合并,细胞计数后取3×107个培养细胞,4 ℃、500×g离心3 min后弃上清, 按每20 μL细胞体积加入200 μL预冷Buffer A(含1∶100 PMSF、1∶500 cocktail和1∶10 PhosSTOP),旋涡振荡15 s,置冰上15 min后加入11 μL预冷Buffer B,旋涡振荡5 s,放置冰上1 min,再次旋涡振荡5 s,4 ℃、16 000×g离心5 min,将上清移出;在离心沉淀物中加入100 μL预冷Buffer C(含1∶100 PMSF、1∶500 cocktail和1∶10 PhosSTOP),旋涡振荡15 s,置冰上40 min,4 ℃、16 000×g离心10 min,取上清即为提取的核蛋白,定量后调整各组蛋白质浓度一致后保存在-80 ℃中备用。
2.2.4DNA pull-down实验 参照μMACS FactorFinder Kit说明书,各组分别按如下步骤操作:每100 μL核蛋白提取物,加入200 μL Binding Buffer(每100 μL Binding Buffer含10 μL PMSF、2 μL cocktail、100 μL PhosSTOP和1 μL Binding Enhancer),混匀后加入50 pmol CTGFP-biotin探针,室温下孵育30 min,加入100 μL链亲和素包被微珠,混匀后室温下孵育10 min,用100 μL Washing Buffer-LS洗涤3次,再用100 μL Washing Buffer-HS洗涤3次,最后用50 μL Native Eluting Buffer洗脱磁珠上的结合蛋白,-80 ℃保存备用。
2.2.5DNA pull-down产物的凝胶电泳分析 3组DNA pull-down产物行12% SDS-PAGE,电泳后按蛋白质银染试剂盒说明书进行凝胶染色:用1∶4∶5体积比的冰醋酸、无水乙醇和去离子水在室温下固定120 min,用1×敏化液作用60 min,去离子水漂洗后用Ag溶液在室温下反应60 min,用去离子水漂洗后放入显色液中反应6 min,再放入终止液中40 min,去离子水漂洗30 s,后用Tanon 5200化学发光成像分析仪 (上海天能) 采集图像。
3 统计学分析
采用SPSS 11.0统计学软件进行数据分析,数据以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA)进行检验,两两间比较采用Bonferroni法。以P<0.05为差异有统计学意义。
结 果
1 THD对TGF-β1诱导的HELF细胞中CTGF基因启动子活性上调的影响
添加TGF-β1刺激组的相对萤光素酶活性明显高于不加TGF-β1的空白对照组(P<0.01);同时加入TGF-β1和不同浓度THD的各干预组,其相对萤光素酶活性均低于刺激组(P<0.01),其中以添加THD终浓度为50 μg/L干预组的相对萤光素酶活性最低,其相对萤光素酶活性仅为刺激组的0.54倍。这一结果表明,TGF-β1能显著上调HELF细胞中CTGF基因启动子的活性,而THD能以剂量依赖方式抑制TGF-β1诱导的CTGF基因启动子的激活,见图1。
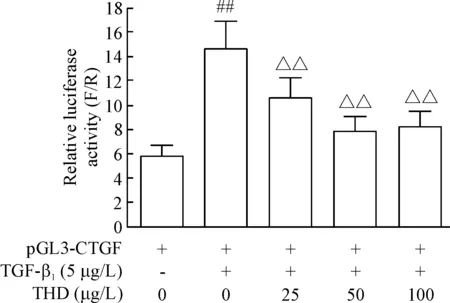
Figure 1. Effect of thalidomide (THD) on TGF-β1-induced activation ofCTGFgene promoter in HELF cell line. Mean±SD.n=3.##P<0.01vscontrol group (without TGF-β1or THD);△△P<0.01vsstimulation group (with TGF-β1alone).
图1沙利度胺对TGF-β1诱导HELF细胞CTGF基因启动子激活的影响
2 CTGFP-biotin探针琼脂糖凝胶电泳结果
CTGFP-biotin探针的PCR扩增产物经1% 琼脂糖凝胶电泳后,在1 000 bp左右位置(1 026 bp)显示清晰条带,与预期的扩增片段大小相符,提示CTGFP-biotin探针扩增成功,见图2。
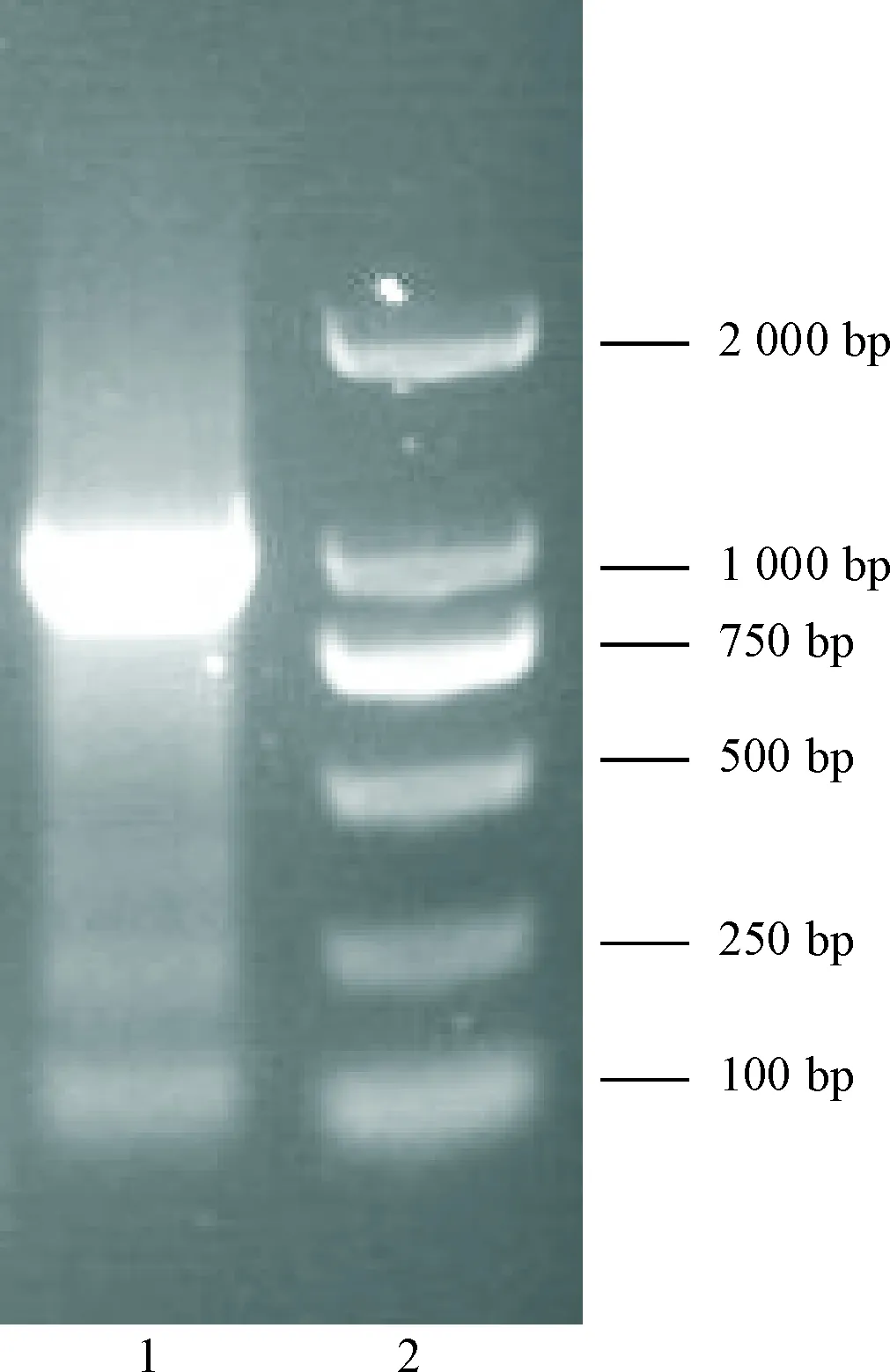
Figure 2. Gel electrophoresis of CTGFP-biotin probe amplified by PCR. Lane 1: PCR products; lane 2: DNA mar-ker.
图2PCR扩增的CTGFP-biotin探针的凝胶电泳
3 DNA pull-down产物的凝胶电泳结果
DNA pull-down产物凝胶电泳及银染结果共显示5条分子量不等的蛋白质条带(按分子量大小标记为①号~⑤号),其中,空白对照组的②号和③号条带呈现阳性,其余条带在不同批次实验中显示为弱阳性或阴性;与空白对照组相比较,刺激组的①号、②号、④号和⑤号条带灰度均有所增强(P<0.05),而③号条带减弱或阴性(P<0.05);与刺激组相比较,干预组的①号、②号、④号和⑤号条带灰度减弱或阴性(P<0.05),而③号条带则明显增强(P<0.05),见图3。此结果表明TGF-β1能改变CTGF启动子DNA上结合的蛋白质,而THD一定程度上能抑制该变化。
讨 论
TGF-β 是肺纤维化启动和发展中的关键性调控分子[6-7],制约着肺纤维化的整个发展过程。人类的肺泡巨噬细胞、上皮细胞、内皮细胞和成纤维细胞等多种肺内的细胞都能分泌TGF-β,其中肺泡巨噬细胞和上皮细胞是分泌TGF-β的主要细胞,TGF-β主要通过自分泌和旁分泌机制发挥功能[8];哺乳动物中存在TGF-β1、TGF-β2、TGF-β3和TGF-β1β24种亚型,它们的结构具有高度同源性,生物学特性也基本相同,其中TGF-β1所占比例最高、活性最强、功能最多,也是致纤维化作用最突出的成分。研究表明,在肺纤维化动物模型及肺纤维化病人,肺组织或支气管肺泡灌洗液中TGF-β均明显增多[9];作为强效的致纤维化细胞因子,TGF-β具有剌激肺成纤维细胞增殖及向肌成纤维细胞的转分化,加速细胞外基质(extracellular matrix,ECM)过度分泌,抑制基质金属蛋白酶活性从而减少ECM的降解,促进炎症细胞产生释放炎症介质及促纤维化细胞因子,增加ECM受体的表达以促进ECM与细胞黏附等多方面作用[10-12]。因此,TGF-β一直被作为肺纤维化干预的重要靶标而开展了广泛的研究,但TGF-β是一种多功能细胞因子,在胚胎发育、细胞外基质形成、骨骼重构、免疫调节以及神经系统的发育等多个方面发挥着重要的生理作用;有研究资料表明,敲除TGF-β1基因的小鼠因失去对炎症的限制作用而在出生后很快死于全身性炎症[13]。因此,直接阻断TGF-β的治疗策略可能会带来许多难以预料的不良后果。
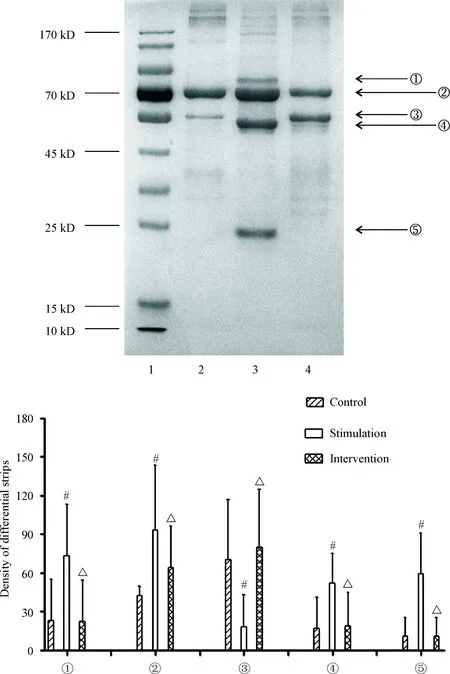
Figure 3. Influence of TGF-β1onCTGFpromoter-binding proteins and antagonistic effect of THD. Lane 1: marker of proteins; lane 2:control group; lane 3: stimulation group; lane 4: intervention group. Mean±SD.n=3.#P<0.05vscontrol group;△P<0.05vsstimulation group.
图3TGF-β1对CTGF基因启动子结合蛋白的影响及THD的干预作用
在寻找肺纤维化治疗新靶点中,作为TGF-β转导通路的下游信号分子,CTGF日益受到重视;CTGF是一种富含半胱氨酸、分子量为36~38 kD的分泌性多肽;正常情况下CTGF表达水平很低,CTGF的过度表达与肺纤维化的发病有密切关系。Allen等[14]和Pan等[15]发现,在特发性肺纤维化患者的肺泡灌洗液和纤维化肺组织中,CTGF的 mRNA和蛋白表达明显上调,并且与反映纤维化程度的纤维连接蛋白表达水平呈正相关关系[16];Xu等[17]报道,转染含CTGF基因序列的表达质粒后,过表达CTGF能激活成纤维细胞中Ⅰ型胶原启动子驱动的萤光素酶报告基因,表明CTGF与胶原合成密切相关。体外实验表明, TGF-β1能够诱导培养的肺成纤维细胞的CTGF表达增加[18];而应用CTGF-siRNA能有效抑制TGF-β诱导的肺成纤维细胞增殖、表型转化及ECM合成[19]。因此,目前认为在肺纤维化发病过程中,CTGF是介导TGF-β1促纤维化作用的重要下游介质;通常CTGF只介导TGF-β1的负面效应,TGF-β1的正面效应则由非CTGF途径所介导[20],拮抗CTGF不会出现阻断TGF-β1后可能产生的负面临床效应。因此,相比TGF-β1来说,通过阻断CTGF达到的抗纤维化作用会更加特异和安全。
沙利度胺是具有抗肺纤维化开发潜力的药物;Tabata等[21]报道,沙利度胺能明显抑制博莱霉素诱导的小鼠肺组织Ⅰ型胶原α1的表达,减轻肺纤维化;Choe等[22]的研究表明,沙利度胺可抑制博莱霉素诱导的小鼠肺纤维化模型支气管肺泡灌洗液中炎症细胞计数、TGF-β1和IL-6水平;临床研究也表明,沙利度胺可提高肺间质纤维化患者的临床治疗总有效率、胸部CT病变吸收率和肺功能指标[23]。体外实验显示,沙利度胺对TGF-β1诱导的人胚肺成纤维细胞系HFLF转分化为肌成纤维细胞的过程也有抑制作用,可抑制α-SMA和Ⅲ型胶原mRNA的表达[4]。我们曾报道,TGF-β1可上调HELF细胞CTGF基因启动子活性,而沙利度胺具有抑制CTGF基因启动子激活的作用[5]。基因的转录调控是一个复杂、多因素参与的过程,DNA-蛋白质、蛋白质-蛋白质互相作用是其中重要的环节,细胞内发生的某些生物学事件(包括某些药物的作用过程)有可能是通过各种具有转录激活或抑制作用的蛋白质相互作用,从而改变基因的表达状态而实现的。2003年Yaneva[24]等创立了DNA pull-down方法,它基于DNA-蛋白质相互作用的原理,利用生物素-链霉亲和素系统,采用磁珠分离技术,通过目的DNA调控序列探针与胞核蛋白反应而获得参与基因转录调控的蛋白质信息;该方法具有重复性好、结合效率高、多级放大作用、操作简便等优点。为进一步了解TGF-β1激活CTGF基因启动子的机制以及沙利度胺的干预效应,本研究尝试采用DNA pull-down方法,将带生物素标记的CTGF基因启动子探针分别与空白处理、单纯TGF-β1剌激和TGF-β1+THD作用下的HELF核蛋白提取物共同孵育,分离获取不同状态下与CTGF基因启动子发生相互作用的蛋白质;实验结果显示,在TGF-β1刺激作用及THD干预情况下,CTGF启动子的活性与CTGF基因启动子结合蛋白改变存在相对应关系;与空白对照组相比较,TGF-β1刺激组出现了4条蛋白质条带上调和1条蛋白质条带下调,而在TGF-β1作用的同时给予THD的干预组与TGF-β1刺激组相比,4条上调的蛋白质条带均减弱,而下调的蛋白质条带又有所增强。这些结果提示沙利度胺可能是通过影响CTGF基因启动子结合蛋白而达到拮抗TGF-β1诱导CTGF基因转录活性增强的作用。本实验利用DNA pull-down技术初步分析了CTGF转录调控的机制,但实验所发现的差异蛋白质尚需要作进一步的鉴定,各差异蛋白质在CTGF表达调控中所起的作用也有待今后深入的研究。这些研究或将有助于我们对沙利度胺抗肺纤维化作用机制的理解。

