糖皮质激素对体外中央记忆性CD8+ T淋巴细胞的诱导分化作用*
陈颖诗, 张 旭, 彭治林, 罗海华, 张 辉, 张译文
(中山大学中山医学院, 广东 广州 510080)
获得性免疫,包括体液免疫和细胞免疫,其重要特征之一是具有免疫记忆能力,即当再次遇到同一抗原时,可迅速产生强烈的二次免疫应答。在淋巴组织中,在外来抗原经抗原提呈细胞摄取加工后提呈给初始T细胞(naVve T cells, TN)的过程中,因T细胞受体(T-cell receptor,TCR)信号强度的差异,细胞分化发生变化[1]。在 T 细胞大量扩增的过程中,大部分细胞发生凋亡,剩余约5%~10%左右的细胞转变为记忆性 T细胞,区别于TN,其表型为CD45RA-CD45RO+[2]。根据自我更新能力及免疫应答能力的差异[3],记忆性 T 细胞可再细分为中央记忆型T细胞(central memory T cells,TCM;表型为CD62L+CCR7+)及效应记忆性 T细胞(effector memory T cells,TEM;表型为CD62L-CCR7-)。
当前有效疫苗的研发都以诱导机体产生免疫记忆为前提。在肿瘤研究中,科学家们开发出一种可以有效抑制肿瘤的新方法,即将患者自身的记忆性T淋巴细胞经扩增改造重新注入患者体内。这一疗法为肿瘤治疗带来了新的曙光。然而对记忆细胞的分化机制及关于这些记忆性 T 细胞的形成、分化及维持规律仍存在很大的争议[4]。这也是疫苗研制滞后的关键原因,解析其分化机制已成为疫苗研究的迫切需要解决的问题。目前已报道的记忆性T细胞扩增方法大多是围绕细胞因子的组合使用,在临床上使用具有安全性和治疗成本的限制[5]。
可的松是一类由肾上腺产生的糖皮质激素,由于是脂溶性的小分子化合物,可通过结合其胞质受体介导其生物效应功能,进而转位至胞核,直接或间接调节相关基因的转录[6]。传统的观念认为糖皮质激素通过抑制激活诱导基因的表达来对外周T细胞发挥免疫抑制作用。既往研究表明糖皮质激素参与T细胞谱系的分化(尤其是CD4+Th1和Th2细胞),并且能够下调Fas配体的表达和抑制激活诱导的细胞凋亡[6]。已有文献报道,糖皮质激素的吸入可调节哮喘患儿外周血CD4+调节性T细胞的比例,与治疗的效果相关[7]。基于糖皮质激素在CD4+T淋巴细胞亚群生长分化中发挥的强大作用,而在CD8+T淋巴细胞中的研究较为欠缺,本研究试图探索糖皮质激素对人CD8+T淋巴细胞的诱导作用,并观察糖皮质激素在CD8+TCM诱导分化中的作用。
材 料 和 方 法
1 材料
健康人的外周成分血由广州市血液中心提供。
2 主要试剂
人外周血淋巴细胞分离液 (天津市灏洋生物制品科技有限公司); Human CD8 T Lymphocyte Enrichment Set-DM (BD Biosciences);RPMI-1640培养基(Gibco);流式细胞术用抗体APC-anti-CD8和Alexa Fluor 700-anti-CCR7 (BD Pharmingen);PerCP-Cy5.5-anti-CD45RO和PE-Cy7-anti-CD62L (eBioscience); ECD-anti-CD45RA(Beckman Coulter)。
3 主要仪器
生物安全柜(Thermo Fisher Scientific, MSC-ADVANTAGE);细胞培养箱(Thermo Fisher Scientific, HERAcell 150i);离心机(Eppendorf, Centrifuge 5810R);光学倒置生物显微镜(Leica);细胞磁珠分选磁力架(BD Biosciences);分选型流式细胞仪(BD, FACSAria cell sorter);分析型流式细胞仪(BD, LSR Fortessa);血球计数板(上海市求精生化试剂仪器有限公司);20 mL注射器(北京颇赛科技发展有公司)。
4 主要方法
4.1人外周单个核细胞的分离 参考已报道的分离方法[5, 8-9],取10 mL 正常人外周血加入到40 mL PBS+2 mmol/L EDTA+0.5% BSA溶液中,混匀。再取50 mL 离心管,加入25 mL 人淋巴细胞分离液。用吸管向小心贴着淋巴细胞分离液界面加入25 mL 混匀的外周血,避免破坏液面分层,20 ℃、400×g离心40 min,小心吸出中间乳白色层于新离心管中,并加入3~5 倍体积 PBS+ 2 mmol/L EDTA+5% BSA溶液稀释,20 ℃、350×g离心15 min,弃上清液。PBS+2 mmol/L EDTA+5% BSA溶液重悬细胞,20 ℃、300×g离心7 min,弃上清液。用RPMI-1640培养基定容至15 mL,置于培养箱(37 ℃,5% CO2)中进行培养。
4.2CD8+T细胞的分离、培养和激活 向得到的外周单个核细胞中加入CD8+T细胞阴选试剂盒中的I抗,室温孵育15 min,让细胞与抗体充分结合,300×g离心10 min。加入CD8+T细胞阴选试剂盒中的磁珠 II 抗孵育30 min;随后进行过柱细胞分选,得到CD8+T细胞。用适量PBS+2 mmol/L EDTA+5% BSA溶液重悬细胞,20 ℃、300×g离心7 min,弃上清液。用PBS+2 mmol/L EDTA+5% BSA溶液将细胞重悬至(50~80)×109/L,每 1×106个细胞加入1 μL 流式抗体,混匀,室温孵育20 min。加入10倍体积的PBS,20 ℃、300×g离心7 min,弃上清液。加入PBS将细胞重悬至(8~10)×109/L,移入12×75 mm流式管,流式细胞仪分选出Na ïve CD8+T细胞(CD8+CD45RO-CD62L+)。
将获得的CD8+T细胞重悬于含10%胎牛血清的RPMI-1640培养基中,细胞计数后,按照每孔2×105的细胞数培养在anti-CD3和anti-CD28预处理的48孔板中,置于5% CO2、饱和湿度的37 ℃细胞培养箱中培养。
用人anti-CD3(0.5 mg/L)的抗体提前处理48孔细胞培养板4 ℃静置过夜,第 2天吸去细胞因子并用PBS清洗细胞培养板。随后将CD8+T细胞铺于孔板中。每孔加入anti-CD28(1 mg/L)和IL-2(10 μg/L)培养48 h,激活CD8+T细胞。
4.3糖皮质激素的添加 将已激活的CD8+T细胞分成实验组和对照(negative control,NC)组,实验组中氢化可的松(hydrocortisone, HC; 5 μmol/L和500 nmol/L)和醋酸可的松(cortisone acetate, CA; 1 μmol/L和100 nmol/L)各取2个浓度,对照组加入等体积的PBS。每隔2 d需要换1次液,同时补充加入1次细胞因子和可的松。
4.4细胞亚群的检测和分析 在细胞培养的第0、7和14天,分别收取细胞标记抗体(APC-anti-CD8、Alexa Fluor 700-anti-CCR7、PerCP-Cy5.5-anti-CD45RO、PE-Cy7-anti-CD62L和ECD-anti-CD45RA),通过流式细胞术分析CD8+TCM的比例。
4.5CFSE染色检测细胞增殖 CD8+T细胞以2×1010/L的密度重悬于PBS缓冲液中,并加入终浓度为 1 μmol/L的CFSE,37 ℃下避光孵育15 min,此后加入10倍体积冷冻的RMPI-1640完全培养基终止反应,300×g离心7 min后弃上清液。再加入10倍体积的RMPI-1640完全培养基,冰浴5 min后,300×g离心7 min,重悬于适当体积的RMPI-1640完全培养基备用。
4.6Annexin V检测细胞凋亡 将细胞悬液转移到离心管中,300×g离心7 min后弃上清液。加入PBS洗涤细胞,300×g离心7 min后弃上清液。加入1×Annexin V Binding Solution制备细胞终浓度为1×109/L的细胞悬液,取100 μL悬液到新管中,加入5 μL Annexin V-FITC结合物,室温下避光培养15 min。加入400 μL的1×Annexin V Binding Solution终止反应, 并在1 h内检测。
5 统计学处理
本设计所用的数据和图片处理分析软件为FlowJo 10.0 (Tree Star)、Adobe Photoshop CC (Adobe Systems Inc.)和GraphPad Prism 5.0 (GraphPad Software Inc.)。采用SPSS 13.0分析软件进行统计分析,计量资料用均数±标准差(mean±SD)表示。实验组与对照组的比较采用t检验,以P<0.05为差异有统计学显著性。
结 果
1流式细胞术分析检测CD8+TCM方法的构建
人外周血中CD4+和CD8+T 细胞均有稳定存在的TCM。首先,根据细胞形态特征圈定淋巴细胞群范围,通过表面标志确定CD8+T 细胞;然后,再圈定记忆细胞表型的表面分子为CD45RA-;最后,圈定TCM记忆表型的表面分子CCR7和CD62L。由于本次实验采用的是健康人的样本,所以未经诱导的CD8+TCM占整群细胞的比例基本接近,总体来说比例较少,约占CD8+T 细胞的1%~3%,见图1。
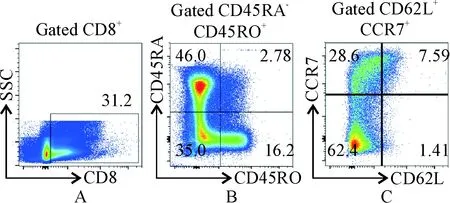
Figure 1. The gating strategy of human CD8+TCMand the natural proportion of CD8+TCMfrom healthy human peripheral blood sample. Human peripheral blood mononuclear cells (PBMCs) were isolated by density gra-dient centrifugation. The PBMCs were labeled with indicated antibody and the proportion of CD8+TCMwas examined by flow cytometery. Firstly, CD8+T cells were gated (A), and then the CD45RO+CD45RA-subset of all CD8+T cells were gated (B). After that, the CD62L+CCR7+cells were gated (C).
图1人CD8+TCM分析策略及健康人外周血中CD8+TCM的比例分析
本研究首先采用密度梯度离心的方法分选出人外周血单个核细胞,接着用磁珠法将这些细胞中的CD8+T细胞分选出来,再通过分选型流式细胞仪获得na ïve CD8+T 细胞(CD8+CD45RO-CD62L+)。为了保证后续实验的准确性,将分选所得的CD8+T细胞通过分析型流式细胞仪检测纯度,检测结果如图2所示,磁珠法分离出来的CD8+T细胞的比例为96.4%,满足本研究后续实验的需求。
2 糖皮质激素对CD8+ TCM比例的影响
为了探究糖皮质激素对人CD8+TCM的诱导作用,将分离的naVve CD8+T细胞进行为期 14 d的体外诱导培养,用流式细胞术对糖皮质激素诱导CD8+TCM的扩增效率进行检测。从流式图中明显观察到实验组中,醋酸可的松在0.1 μmol/L浓度处理后诱导产生的CD8+TCM比例为16.4%,在1 μmol/L浓度处理后产生的CD8+TCM比例为41.3%;而氢化可的松在0.5 μmol/L浓度处理后诱导产生的CD8+TCM比例为41.6%,在5 μmol/L浓度处理后产生的CD8+TCM比例为20.3%,相对于对照组 (6.39%)的扩增比例明显抬高,见图3A。本实验一共重复了6个健康人的细胞样本,对每一例样本检测后,具体的统计结果如图3B所示。通过6组样品数据的统计分析发现,氢化可的松化合物进行诱导时随浓度增大扩增效率反而降低,相反醋酸可的松则表现出浓度依赖关系。

Figure 2. The purity of human naVve CD8+T cells. Among the isolated PBMCs, na ïve CD8+T cells were further isolated with MACS microbeads and flow cytometry. The naVve CD8+T cells were labeled with indicated antibody and the purity was examined by flow cytometery. Na ïve CD8+T cells were defined as CD8+CD45RA+CD45RO-CD62L+CCR7+.
图2人naVveCD8+T细胞纯度的检测
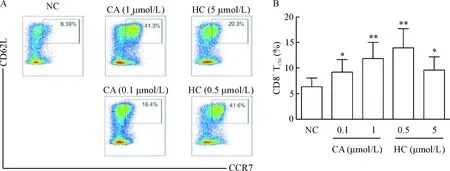
Figure 3. Glucocorticoids induced the formation of CD8+TCMfrom naVve precursors. The representative flow cytometry results from single experiment (A) and the quantitative analysis of the proportions (B) were showed. NC: negative control; CA: cortisone acetate; HC: hydrocortisone. Mean±SD.n=6.*P<0.05,**P<0.01vsNC group.
图3糖皮质激素对CD8+TCM扩增的影响
3 糖皮质激素对CD8+ TCM增殖的影响
为了进一步确定糖皮质激素是否对CD8+T细胞的增殖有影响,本实验采用低毒性的细胞追踪染料CFSE来初步探究相关的增殖状况。本实验中将分选得到的naVve CD8+T细胞进行CFSE染色,然后将染色后细胞置于细胞培养箱(37 ℃,5% CO2)中培养,加入对应浓度的糖皮质激素,培养至第3和第6天时用流式细胞技术检测CD8+T细胞的增殖情况。结果显示实验组和对照组细胞在第3天和第6天增殖情况的差异无统计学显著性,见图4。第3天各组内约40%~50%的细胞处于分裂增殖状态,第6天约60%的细胞处于分裂增殖状态,表明这2种药物并不抑制CD8+T淋巴细胞的增殖。
4 糖皮质激素对CD8+ T细胞的凋亡作用
为了探究糖皮质激素对CD8+T细胞是否具有药物毒性而引起细胞凋亡,我们将分选得到的naVve CD8+T细胞用anti-CD3和anti-CD28双信号完全模拟体内的激活,将不同浓度的糖皮质激素加入到每个样本孔内,培养14 d后取1×105细胞经Annexin V染色,流式细胞技术检测淋巴细胞的凋亡情况。结果显示,细胞经糖皮质激素诱导14 d后,与对照组相比,凋亡细胞所占的比例差异没有统计学显著性,表明糖皮质激素不影响CD8+T细胞的凋亡,见图5。综合上述结果,糖皮质激素(包括醋酸可的松和氢化可的松)可在体外诱导CD8+TCM的形成,并且不影响细胞的增殖与凋亡,是可用于临床诱导扩增CD8+TCM的低毒小分子化合物。
讨 论
细胞过继治疗是目前肿瘤治疗的有效手段之一,通过将具有靶向特定杀伤性能的淋巴细胞回输到患者体内,达到特异性治疗的效果。然而,从目的细胞筛选、扩增到输入体内,耗时较长;再者,这些细胞在体内存活时间短,容易向下游分化而失去治疗有效性。为解决这些局限,以下几点亟待解决:(1)获得靶向性及杀伤能力更强的淋巴细胞;(2)优化细胞的体外扩增方案,在短时间内达到一定数量的细胞数;(3)改善回输细胞的体内环境,维持细胞的自稳定状态。自TCM亚群发现以来,科学工作者发现其在肿瘤的过继性免疫疗法中占绝对优势,在小鼠和灵长类动物肿瘤模型中取得了良好的抗瘤活性。同时也有证据表明相对于效应记忆性T淋巴细胞,TCM不但具有更强的抗肿瘤能力[10-11],而且还具有更强的增殖和自我更新能力,被认为是未来 T 细胞过继治疗的新方向。
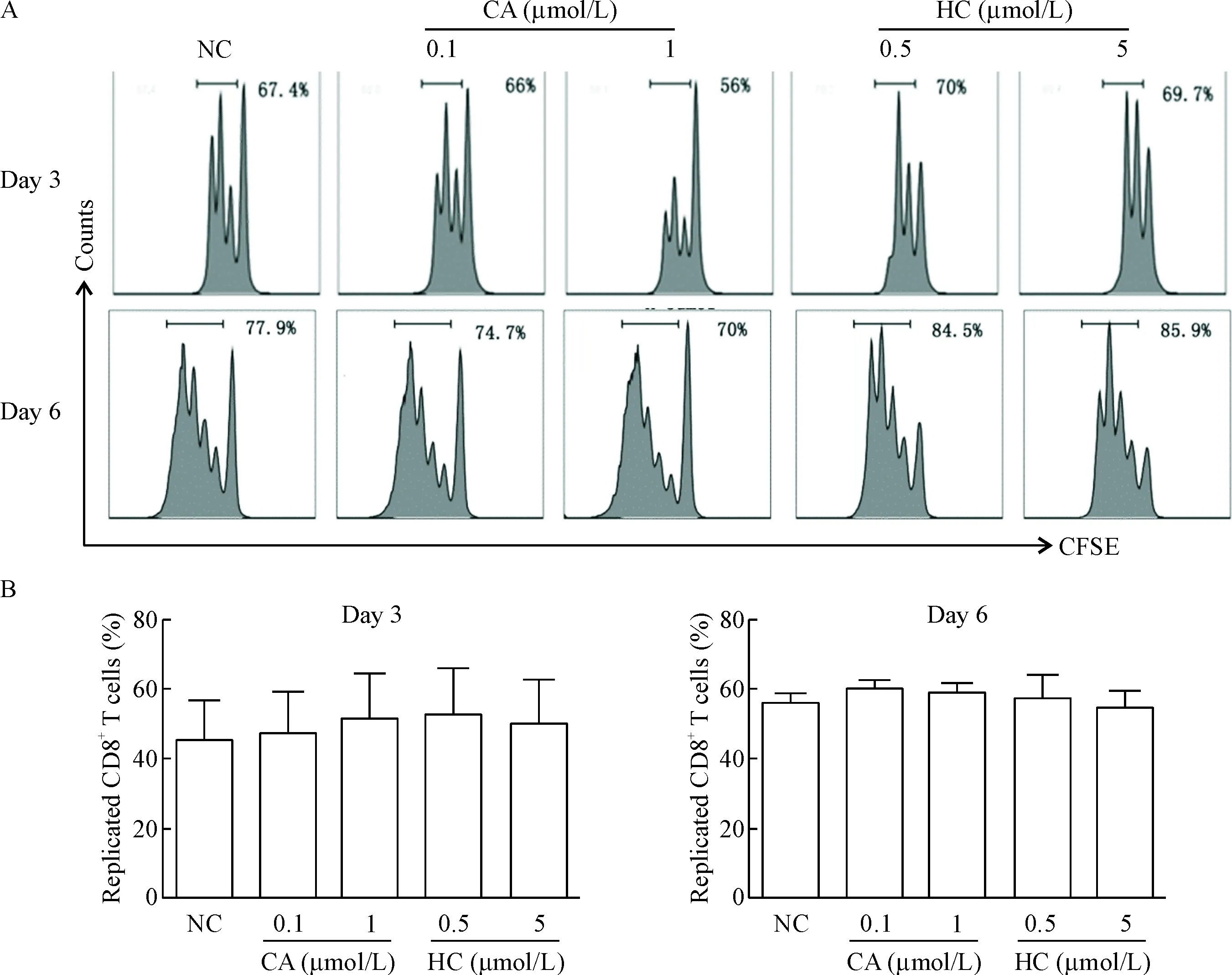
Figure 4. Glucocorticoids maintained the proliferation of CD8+T cells. The representative flow cytometry results from single experiment (A) and the quantitative analysis of the proportions (B) were showed. NC: negative control; CA: cortisone acetate; HC: hydrocortisone. Mean±SD.n=3.
图4糖皮质激素对CD8+T细胞增殖的影响
对于糖皮质激素,此前的研究都聚焦于其对免疫系统的抑制作用,提出其在生理浓度就足以诱导CD4+或CD8+T细胞和DC细胞的凋亡。但由于外周T细胞表达一定量的抗凋亡分子Bcl-2,故对糖皮质激素的耐受相对较高。本实验前期通过高通量药物筛选,发现糖皮质激素在一定程度上可以促进CD8+TCM的分化,这使得我们对其认识不断完善。之前的也有类似的研究发现,在小鼠模型中证实糖皮质激素有助于诱导分泌IL-4的T细胞(即Th2细胞)分化,然而由于物种差异,人与小鼠则截然不同,糖皮质激素抑制Th2细胞因子的产生,可能由于人和小鼠细胞对糖皮质激素的易感性差异所致。
本研究初步探索了体外扩增CD8+TCM的新方法,主要从淋巴细胞表型、化合物作用下的细胞增殖和凋亡作用3个层面进行研究,首次发现一定浓度的糖皮质激素类药物在体外可以有效扩增人CD8+TCM。通过设置不同的浓度梯度发现,适中浓度的糖皮质激素,如醋酸可的松在1 μmol/L、氢化可的松在0.5 μmol/L可表现出对CD8+TCM的良好扩增效果;同时,糖皮质激素对来源于人外周血的CD8+T细胞具有维持增殖的作用,细胞毒性极低,不会引起淋巴细胞体外培养的凋亡。
综上所述,作为已广泛用于临床的药物,糖皮质激素是一类安全有效的小分子化合物。利用糖皮质激素在体外扩增CD8+TCM的方法安全性较高,扩增效果明显,不仅革新了人们对于糖皮质激素的传统认识,而且还推动了免疫细胞的体外扩增技术,为后续抗病毒和抗肿瘤的细胞过继免疫治疗的广泛开展提供了一个全新的参考方案。

Figure 5. Glucocorticoids prevented the apoptosis of activated naVve CD8+T cells. The representative flow cytometry results from single experiment (A) and the quantitative analysis of the proportions (B) were showed. NC: negative control; CA: cortisone acetate; HC: hydrocortisone. Mean±SD.n=3.
图5糖皮质激素对CD8+T细胞凋亡的影响

