紫草素对HGF诱导的人肺癌细胞上皮-间充质转化的逆转作用
沈 东, 王 维
(1浙江大学医学院附属邵逸夫医院药学部, 浙江 杭州 310018; 2杭州市第三人民医院药学部, 浙江 杭州 310009)
近年来随着环境污染的日益严重,我国肺癌患者的死亡率呈逐年上升趋势,并且低龄化趋势也越来越明显,统计显示肺癌发病率和死亡率均居于10大恶性肿瘤的首位[1]。肿瘤的复发和转移是肺癌治疗中最为棘手的问题,而上皮-间充质转化(epithe-lial-mesenchymal transition,EMT)是肿瘤转移的关键步骤[2]。目前研究报道证实,EMT在乳腺癌、肺癌、结肠癌、卵巢癌和肝癌等多种肿瘤的原发性浸润和继发性转移中起着重要的作用,且EMT的程度与细胞侵袭和迁移能力呈正相关[3]。因此,研究EMT的发生,对于寻找治疗肿瘤细胞转移的目标靶点有重要意义。
紫草素(shikonin)是草本植物紫草根部提取的一种萘醌类单体化合物,具有抗癌、抗菌、抗炎和促进伤口愈合等多种药理作用[4]。近年来,紫草素的抗肿瘤作用引起人们的广泛关注。文献报道的紫草素抗肿瘤作用主要通过抑制肿瘤细胞增殖,诱导细胞凋亡,并抑制肿瘤侵袭和转移[5]。然而,紫草素是否可通过抑制肿瘤细胞的EMT发挥抗肿瘤作用,目前还没有文献报道。本实验探讨紫草素对肝细胞生长因子(hepatocyte growth factor,HGF)诱导的肺癌PC9细胞EMT的逆转作用及对细胞侵袭和迁移的影响。
材 料 和 方 法
1 材料
人非小细胞肺癌PC9细胞购自中国科学院上海细胞所。紫草素、肝细胞生长因子和DMSO购自Sigma;胎牛血清购自Gibco;RPMI-1640培养基购自吉诺生物医药技术有限公司; MTT 和RIPA细胞裂解液购自碧云天生物公司;抗上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)和GAPDH抗体购自Cell Signaling Technology;BCA蛋白定量试剂盒购自Thermo;ECL超敏发光液购自Millipore。
2 主要方法
2.1细胞培养 肺癌PC9细胞用含有10%小牛血清的RPMI-1640培养液置于37 ℃、5% CO2、饱和湿度培养箱中培养。当细胞融合达到80%之后,每3 d 用0.25%胰蛋白酶消化传代并进行相关实验。
2.2MTT法检测细胞活力 取对数生长期细胞以5.0×107/L的浓度接种于96孔细胞培养板中,每孔100 μL,置于37 ℃、5% CO2、饱和湿度培养箱中培养24 h,待细胞贴壁后,加入不同浓度(0.5、1、2、4和8 μmol/L)shikonin,以DMSO溶剂组为对照组。于培养箱中培养24 h后,每孔加入20 μL MTT(2 g/L),继续孵育4 h后,终止培养。最后,吸去培养液,每孔加DMSO 150 μL,用酶标仪在490 nm波长处测定各孔吸光度(A)值。每个浓度设平行重复6孔,重复实验3次。
2.3划痕愈合实验 将PC9细胞接种于6孔板中,待细胞铺满孔底,用10 μL枪头小心在孔底划痕,PBS清洗3次,加入含有2.5%低血清的新鲜培养基,在倒置显微镜下拍照,沿划痕边缘等间距取3处测量划痕宽度,取平均值。然后加入HGF(50 μg/L)或HGF(50 μg/L)+shikonin(1 μmol/L)作用,24 h后继续拍照,在相同观察点测量划痕宽度。划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
2.4Transwell小室实验 将HGF诱导前后的细胞用无血清的培养基制成8×107/L细胞悬液,在Transwell小室的上室中加入含有HGF(50 μg/L)或HGF(50 μg/L)+shikonin(1 μmol/L)的细胞悬液200 μL,下室中加入600 μL含10%胎牛血清的培养基,每组设置3个复孔,置于37 ℃、5% CO2条件下培养24 h。取出Transwell小室,吸弃小室内液体,用棉签轻轻擦去基质胶和上室未穿膜细胞,PBS漂洗后,甲醇固定30 min,0.1%结晶紫染色20 min,再用PBS漂洗后,倒置显微镜下观察拍照,镜下随机选取5个视野计数穿膜细胞数目,取平均值。
2.5细胞形态的观察 取对数生长期的肺癌PC9细胞接种于6孔板中,待细胞贴壁后,实验分为4组,分别为对照(control)组、HGF(50 μg/L)组、HGF(50 μg/L)+shikonin (1 μmol/L)组和HGF(50 μg/L)+shikonin(2 μmol/L)组,作用24 h后,于显微镜下观察细胞形态并照相。
2.6Western blot法检测EMT相关蛋白水平变化 采用50 μg/L的HGF作用肺癌PC9细胞24 h,然后加入shikonin(1 μmol/L)处理细胞24 h,各组细胞用RIPA裂解液裂解提取各组细胞的总蛋白,用BCA蛋白定量法测定蛋白浓度定量。每个泳道蛋白样品10 μg,经10% SDS-PAGE分离后,利用湿法将蛋白转移至PVDF膜上,用现配的脱脂牛奶温室封闭1 h后,分别加入抗E-cadherin、N-cadherin、vimentin和GAPDH抗体,4 ℃孵育过夜,TBST洗膜3次,每次5 min,加入对应II 抗室温摇床孵育2 h,TBST洗膜3次 每次5min, ECL加入电化学发光法发光液,凝胶成像系统拍照,分析条带灰度值。
3 统计学处理
应用SPSS 17.0统计软件进行数据分析。所有实验均重复3次,实验数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较应用SNK-q检验,以P<0.05表示差异有统计学显著性。
结 果
1 紫草素抑制肺癌PC9细胞的活力
MTT法检测shikonin对PC9细胞活力的影响,结果显示,随着给药剂量的增加,shikonin对肺癌PC9细胞的生长抑制率显著上升(P<0.01),见图1。在给药24 h后,shikonin的IC50为9.364 μmol/L。
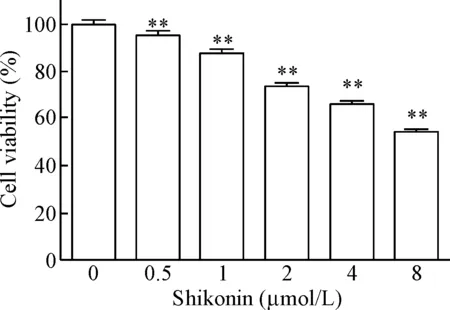
Figure 1. The effects of shikonin on the viability of PC9 cells. Mean±SD.n=3.**P<0.01vs0 μmol/L.
图1不同浓度的紫草素对肺癌PC9细胞活力的影响
2 紫草素抑制HGF诱导的PC9细胞迁移
划痕实验的结果显示,HGF可诱导PC9细胞迁移(P<0.01);在HGF存在的条件下,用shikonin处后,HGF对PC9细胞迁移的促进作用减弱,与HGF作用组相比,在用shikonin作用24 h后,划痕愈合率呈现明显降低(P<0.01),说明shikonin可明显抑制由HGF诱导的PC9细胞迁移,见图2。
3 紫草素抑制 HGF 诱导的 PC9细胞侵袭
Transwell小室实验结果显示,HGF作用组穿透细胞的数量要比未经HGF作用组处理的细胞明显增多(P<0.01);而加入shikonin(1 μmol/L)作用肺癌PC9细胞后,细胞的侵袭能力明显下降(P<0.01),表明shikonin可明显抑制由HGF诱导的PC9细胞侵袭,见图3。
4 紫草素对肺癌细胞形态的影响
与对照组细胞形态比较,加入50 μg/L HGF刺激后,PC9细胞形态失去了上皮细胞所特有的多边、排列较为规则、紧密的形态,变成了更为细长的形态;然而,加入shikonin作用后则逐渐逆转了这一变化,见图4。

Figure 2. The effect of shikonin on migration of PC9 cells. The cell migration ability was examined by wound healing assay. The scale bar=200 μm. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsHGF group.
图2划痕愈合实验检测紫草素对肺癌PC9细胞迁移能力的影响
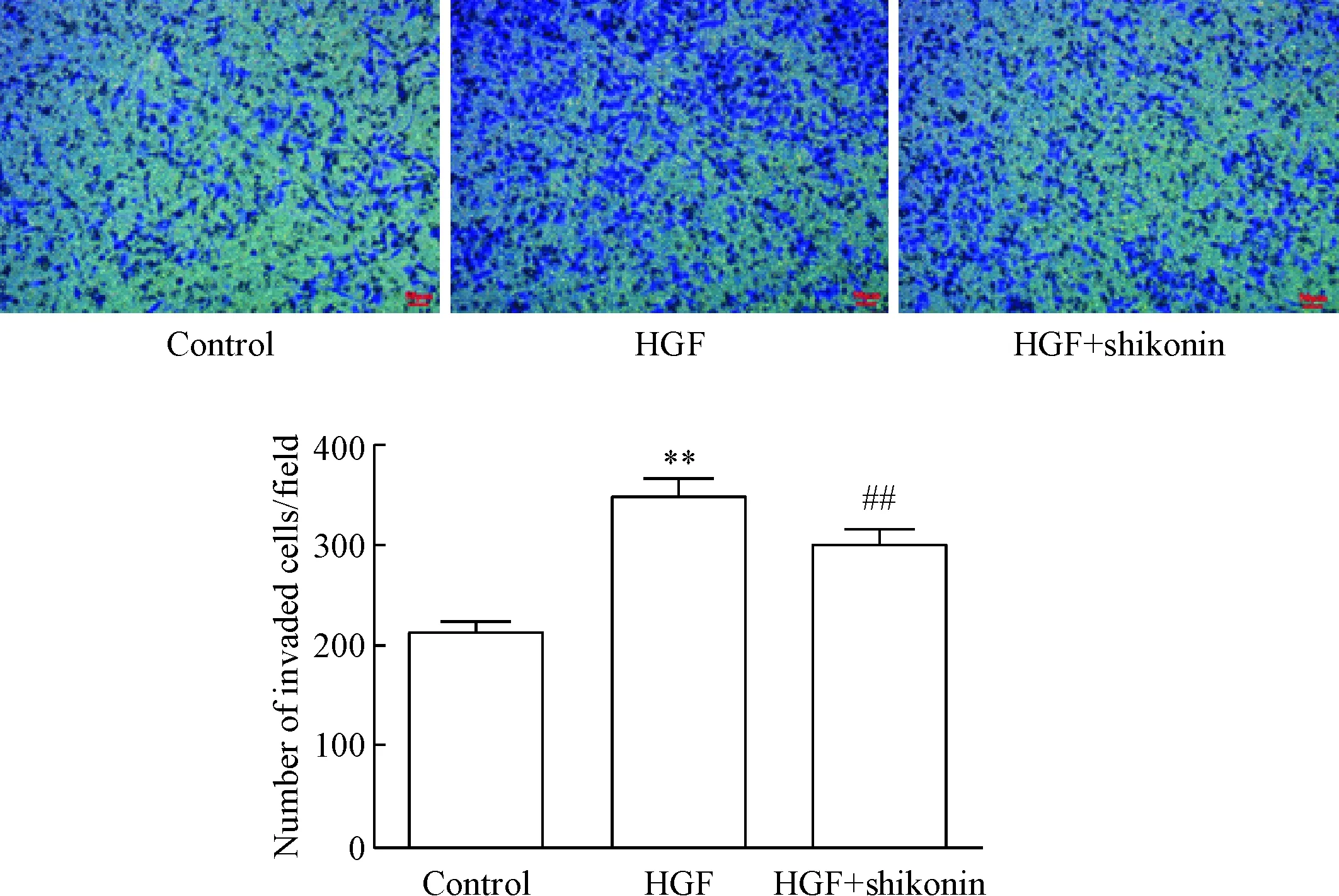
Figure 3. The effect of shikonin on invasion ability of PC9 cells. The cell invasion ability was examined by Transwell assay. The sale bar=50 μm. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsHGF group.
图3Transwell小室法检测紫草素对肺癌PC9细胞侵袭能力的影响
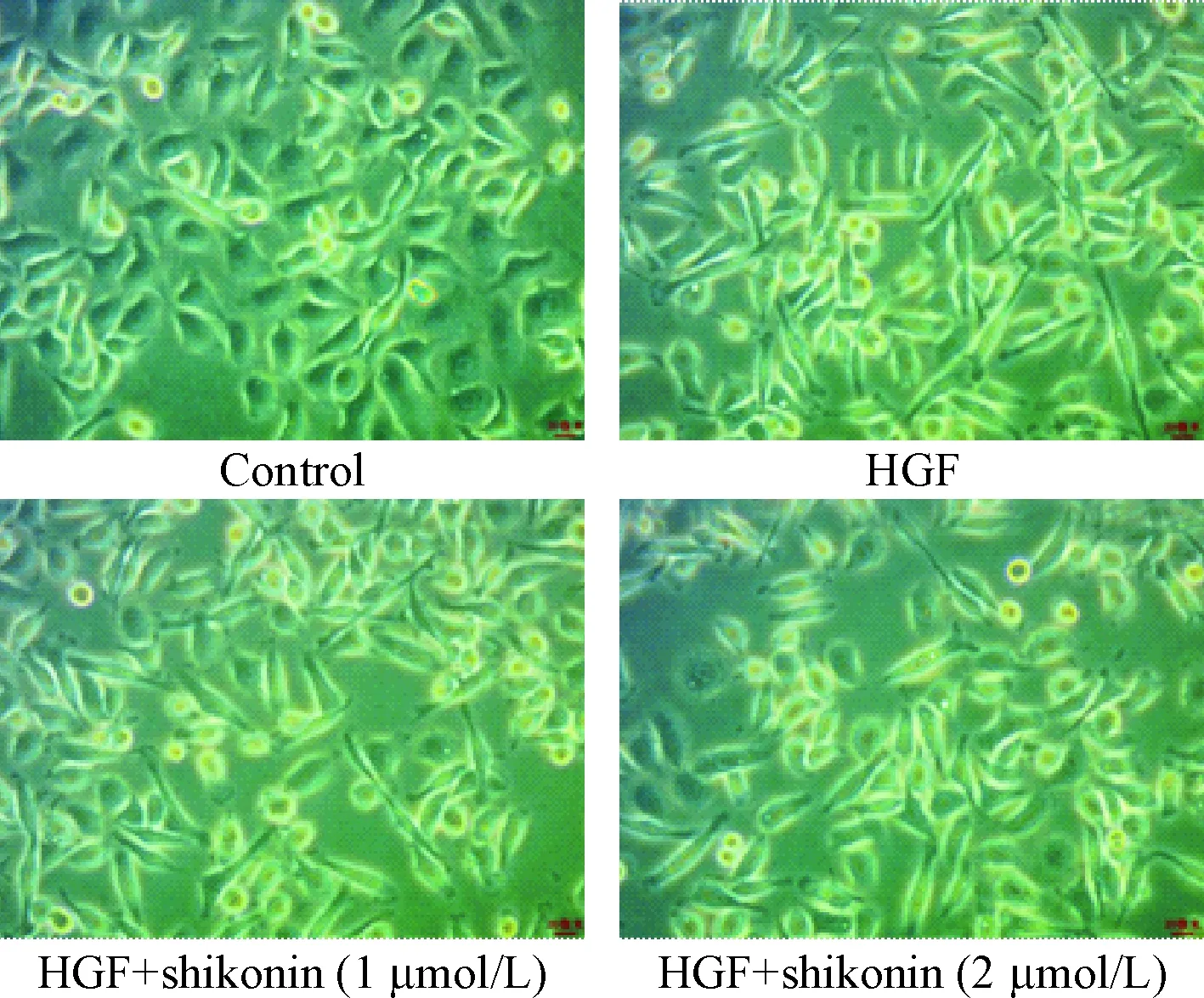
Figure 4. The morphological changes of PC9 cells after HGF and shikonin treatment (×200).
图4HGF和紫草素处理前后细胞形态的变化
5 紫草素逆转HGF诱导的PC9细胞EMT
用Western blot 检测shikonin对EMT标志物E-cadherin、N-cadherin和vimentin的影响,发现HGF可显著下调PC9细胞E-cadherin 的蛋白表达,而上调N-cadherin和vimentin的蛋白表达(P<0.01),加入shikonin(1 μmol/L)作用后则可逆转由HGF 诱导的PC9 细胞E-cadherin 蛋白表达下调和N-cadherin、vimentin蛋白表达上调(P<0.01),见图5。
讨 论
肺癌是当今全球危害性最大的恶性肿瘤之一,其发病率和病死率在世界范围内呈持续上升趋势,转移是导致肺癌临床治疗失败和患者死亡的主要原因[2]。尽管治疗肿瘤的方法不断发展与更新,新的抗肿瘤药物也是层出不穷,但肺癌患者长期生存率并没有明显提高。因此,寻找一种抑制肿瘤侵袭和转移的新方法和策略已成为医药界的一个重要课题。
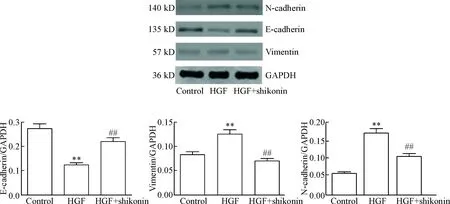
Figure 5. The protein levels of E-cadherin, N-cadherin and vimentin in HGF-induced PC9 cells treated with shikonin. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsHGF group.
图5紫草素对HGF诱导的PC9细胞中EMT相关蛋白E-cadherin、N-cadherin和vimentin表达水平的影响
EMT是肿瘤侵袭和转移过程中的关键环节。典型的EMT是指上皮细胞失去上皮特性,获得间质细胞特性的一种生物现象,表现为迁移及侵袭能力增强、细胞播散能力增强、细胞形态延伸以及抗调亡能力增强。E-cadherin用于维持正常上皮细胞间的稳定性,抑制肿瘤细胞的迁移和侵袭,是EMT的关键分子;间充质细胞标志物N-cadherin和vimentin则具有促进肿瘤细胞运动和转移的作用。EMT的发生可受环境刺激或胞外基质因子调节[6]。HGF是肝细胞分泌的多功能细胞因子,在一些肿瘤模型中[7],HGF可诱导EMT,从而降低肿瘤细胞间的黏附并增强细胞的侵袭能力。如詹建伟等[8]报道姜黄素逆转HGF诱导PC9细胞对吉非替尼的耐药中HGF可诱导肺癌发生EMT;莫翠菊等[9]报道HGF可诱导肝癌Huh7细胞发生EMT。在本实验中,我们通过HGF诱导,成功建立了肺癌PC9细胞EMT模型,加入HGF 刺激后,PC9细胞形态变得更为细长,且细胞迁移侵和袭能力比诱导前明显增强;上皮细胞的E-cadherin标志物表达下调,而间充质标志物N-cadherin和vimentin表达上调。
紫草素是从我国传统中药紫草根部提取出来的萘醌色素,具有抗炎、抑制脂肪形成、抗肿瘤和调节免疫等广泛的药理作用及生物学效应[5],其中抗肿瘤作用是目前研究的热点。紫草素类化合物的抗肿瘤机制涉及多个靶点,文献报道的紫草素类化合物的抗肿瘤作用机制包括诱导细胞凋亡[10]、抑制蛋白酪氨酸激酶[11]、抗肿瘤血管生成[12]及影响肿瘤细胞信号传递[13]等。本文将在文献报道的基础上,重点阐述紫草素对HGF诱导肺癌PC9细胞迁移、侵袭及EMT的影响。
综上所述,我们观察到HGF诱导使肺癌细胞发生EMT的形态变化,并通过EMT标志性蛋白分子进一步证明了EMT的发生。在加入紫草素干预后,细胞迁移和侵袭能力明显降低;同时检测EMT标志性蛋白分子的变化,细胞中E-cadherin蛋白表达相对于EMT模型明显上调,N-cadherin和vimentin 蛋白表达则明显下调。本实验初步研究表明紫草素作为一种天然存在的化合物能明显能逆转由HGF诱导的肺癌PC9细胞EMT,为紫草素应用于肺癌的临床治疗提供实验依据。

