抑制NFBD1表达对喉癌放化疗敏感度影响的研究△
邱志利 蒋晓平 袁小东 谭嘉萌
喉癌是头颈部常见的恶性肿瘤,约占全身恶性肿瘤的5.7%~7.6%,40%的患者确诊时已经属于Ⅲ~Ⅳ期[1]。目前,对于喉癌的治疗已拓展为手术切除联合放化疗的综合性治疗方案。尽管如此,喉癌尤其是晚期喉癌的治疗效果依然不尽如人意:治疗后发音效果差,吞咽功能受影响,以及复发、转移、对放化疗不敏感等问题。因此,进一步探索喉癌的预防和诊治方法(包括治疗靶点探索)具有重要的理论和现实意义,也是摆在每一位医务工作者和科研人员面前的一个重要而迫切的课题。
NFBD1(nuclear factor with BRCT domain 1),也称MDC1(mediator of DNA damage checkpoint protein 1),是一个参与细胞内DNA损伤后细胞应答的重要分子[2]。NFBD1基因最早由日本的Kazusa DNA研究所在超长cDNA库大规模克隆测序中发现,编号为KIAA0170,cDNA全长约为6 940 bp[3]。NFBD1蛋白由2 089个氨基酸组成,相对分子质量高达227×103,包含1个位于氨基端的FHA(forkhead homology-associated)结构域、2个位于羧基端的BRCT(BRCA1 C-terminal motifs)结构域和中间的多个重复P/ST结构域,隶属于BRCT蛋白超家族[4]。NFBD1作为DNA损伤与应答研究领域的一个新的热点分子,得到国外多个研究小组的关注,成为国际上一个新的研究热点,但仍处于起始阶段。有研究[5-6]表明,小干扰RNA抑制NFBD1基因后,鼻咽癌细胞对化疗药物顺铂的敏感度及放疗的敏感度显著提高。我们率先通过RNA干扰技术下调NFBD1基因在喉癌细胞系Hep-2中的表达,观察其对Hep-2细胞放疗、化疗后凋亡率、周期阻滞及存活率的影响,探讨抑制NFBD1基因表达对喉癌细胞系Hep-2放化疗敏感度的影响,为寻觅新的治疗靶点找到理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞系 本课题所用喉癌细胞系Hep-2购于中国科学院上海生命科学研究院细胞库,采用含10% 胎牛血清的1640 培养基培养,于5%CO2、37 ℃培养箱中培养。
1.1.2 试剂 1640 培养基及胎牛血清购自Hyclone公司,NFBD1siRNA、control siRNA 均购自上海吉凯公司。针对NFBD1基因siRNA特异序列NFBD1-siRNA:5′-GAGGCAGACUG-UGGAUAAATT-3′;无意义序列control siRNA:TTCTCCGAACGTGTCACGT。RNA提取试剂盒及实时定量聚合酶链反应技术(quantitative real time polymerase chain reaction,QRT-PCR)试剂盒购自Takra公司,NFBD1一抗购自Abcam公司,actin抗体及HRP二抗购自Cell Signaling公司,PVDF膜购自Millipore公司,MTS一步法细胞活力检测试剂盒购自Promega公司。
1.2 方法
1.2.1 细胞转染与稳定筛选 喉癌细胞系Hep-2培养于含10%胎牛血清的Hyclone 1640培养液中,在37 ℃、5% CO2孵箱中培养至对数生长期,常规接种于96孔板,每孔密度2×104细胞。细胞融合率为50%左右时,按感染复数(MOI=10)将慢病毒液加入培养液中,24 h后换正常培养基,72 h后加入嘌呤霉素(1 μg/mL)。采用无限稀释法筛选阳性克隆,然后再扩大培养,得到稳定表达NFBD1 siRNA的细胞株(NFBD1 siRNA组,实验组)和阴性对照细胞株(control siRNA组,对照组)。
1.2.2 QRT-PCR检测NFBD1 mRNA表达 TRIZOL提取NFBD1 siRNA和control siRNA细胞的总mRNA(按说明书步骤进行),然后反转录成cDNA,进行目的序列及内参β-actin的QRT-PCR扩增。用于QRT-PCR的试剂为Takara公司的SYBR Premix Ex Taq 试剂盒(荧光为SYBR Green 1),PCR 仪为iCycler iQ 实时PCR 检测系统(美国Bio-Rad 公司),NFBD1引物由宝生物工程(大连)有限公司合成,β-actin的引物由上海生工生物工程技术服务有限公司合成。参照PCR试剂盒使用说明书进行。GAPDH 和NFBD1 的上下游引物序列见表1。

表1 QRT-PCR所用引物序列
1.2.3 Western 印迹技术检测NFBD1蛋白的表达 细胞裂解液裂解control siRNA和NFBD1 siRNA细胞,加入SDS 上样缓冲液(62.5 mmol/L,Tril-HCl,pH=8.0,2%β-巯基乙醇,0.01% 溴酚蓝) 于100 ℃ 加热变性处理5 min。6%SDS-PAGE 分离样品中的蛋白质。用封阻液(含5%牛奶的TBST) 将转印后的蛋白膜于室温封阻2 h。用TBST 洗膜3 次,每次10 min,加入适量稀释后的一抗,4 ℃避光过夜;TBST洗膜3次,每次5 min;加入1∶5 000稀释的耦联辣根过氧化物酶二抗,室温1 h,TBST 洗膜3 次。将结果采用化学发光法进行检测。
1.2.4 细胞周期检测 指数生长期细胞经0 Gy假照射和4 Gy照射后48 h收集,收集细胞加入70%冰乙醇中4 ℃过夜,磷盐酸缓冲液(phosphate buffered saline, PBS)洗涤2遍后,避光加入含有50 μg/mL的RNA酶和50 μL/mL PI的染色液中,室温染色30 min后,流式细胞仪检测细胞周期各时相所占百分比。
1.2.5 细胞凋亡率检测 采用碧云天公司Annexin-FITC 细胞凋亡检测试剂盒检测细胞凋亡。指数生长期细胞经0 Gy假照射和4 Gy照射后48 h收集,用PBS洗涤,离心,收集10×104个细胞,再加入结合缓冲液,Annexin V-FITC,PI 混匀。由FACS Calibur 流式细胞仪检测(Ex=488 nm;Em=530 nm)细胞凋亡的情况(绿色荧光通过FITC 通道FL1 检测,红色荧光通过PI通道FL2检测)。
1.2.6 放疗后细胞存活率分析 采用Promega公司的MTS一步法细胞活力检测试剂盒,具体参照试剂盒说明书。将各组生长良好的细胞以5×103个/孔的密度接种于96孔板中(只加培养液孔设为空白对照),待细胞贴壁适应环境后,给予0、4、8 Gy照射48 h后,每孔加入MTS试剂10 μL,置于细胞培养箱中培养2 h,然后用酶标仪测定波长490 nm处的吸光度值,计算活细胞率。
1.2.7 化疗后细胞成活率分析 将细胞分为control siRNA+CDDP组、NFBD1 siRNA+CDDP组,采用MTT方法,具体参照试剂盒说明书。将各组生长良好的细胞以5×103个/孔的密度接种于96孔板中(只加血清孔设为空白对照组),待细胞贴壁适应环境后,给予顺铂处理48 h后,每孔加入MTT试剂(0.5 μmol/L)20 μL,置于细胞培养箱中培养1~4 h;然后用酶标仪测定波长490 nm处的吸光度值,重复3次,计算细胞成活率。
1.3 统计学处理 采用SPSS 19.0 统计学软件分析,计量资料采用单因素方差分析方法,计数资料采用卡方检验,组间比较采用SNK-q 检验,P<0.05 认为差异有统计学意义。
2 结果
2.1 siRNA对喉癌Hep-2细胞NFBD1 mRNA水平的抑制效果 如图1所示,QRT-PCR结果显示,实验组的mRNA表达水平明显低于对照组,差异有统计学意义(P<0.05),表明构建的NFBD1 siRNA特异性干扰序列慢病毒载体能有效抑制喉癌Hep-2细胞NFBD1基因的表达。
2.2 siRNA对喉癌Hep-2细胞 NFBD1 蛋白表达水平的抑制效果 如图2所示,实验组的蛋白表达水平明显低于对照组(P<0.05),表明构建的NFBD1 siRNA特异性干扰序列慢病毒载体能有效抑制喉癌Hep-2细胞NFBD1基因的蛋白表达。
2.3 TUNEL荧光染色法检测抑制NFBD1表达对喉癌细胞凋亡的影响 细胞经TUNEL染色后,在荧光显微镜下观察,凋亡细胞会发出绿色荧光,而未发生凋亡的细胞不会带荧光。如图3所示,实验组中呈绿色荧光的凋亡细胞明显多于对照组(P<0.05)。再次证明抑制NFBD1的表达可以促进喉癌细胞Hep-2的凋亡。

图1. siRNA转染后NFBD1 mRNA表达水平
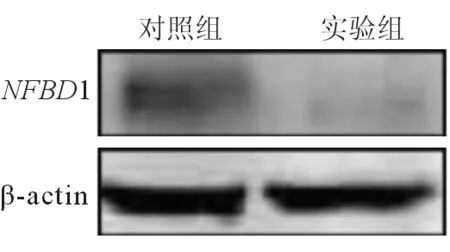
图2. siRNA转染后 NFBD1 蛋白表达水平

图3. TUNEL荧光染色实验(×100 ) A.对照组; B.实验组
2.4 抑制NFBD1表达对喉癌Hep-2细胞放疗后凋亡率的影响 如图4、5所示,喉癌Hep-2细胞经4 Gy照射后,凋亡率(早期凋亡+晚期凋亡)明显增加,实验组增加了17.92%,对照组增加了7.47%(P<0.05),表明放疗增加喉癌Hep-2细胞的凋亡率,且抑制NFBD1基因的表达能促进喉癌Hep-2细胞的凋亡率,同时提高细胞对放射线的敏感度。
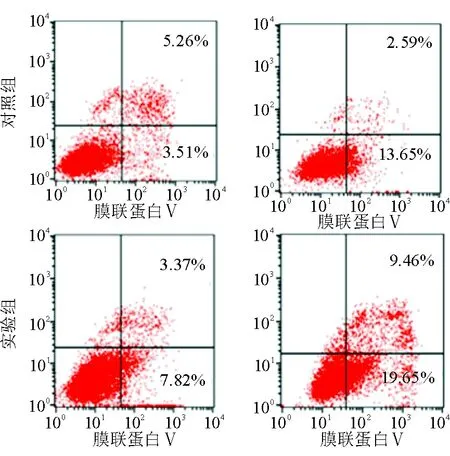
图4. 流式细胞仪检测2组细胞照射前、后细胞凋亡的变化
2.5 抑制NFBD1表达对喉癌Hep-2细胞放疗后周期的影响 如图6、7所示,喉癌Hep-2细胞经4 Gy照射后,G2/M期细胞比例明显增加,实验组增加了35.58%,对照组增加了18.70%(P<0.05),表明放疗可引起喉癌Hep-2细胞的G2/M期阻滞,且抑制NFBD1基因的表达能促进喉癌Hep-2细胞放疗后的G2/M期阻滞。

图5. 定量分析2组细胞照射前、后凋亡的变化
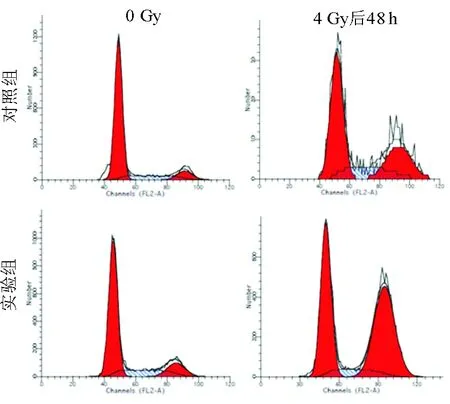
图6. 流式细胞仪检测2组细胞照射前、后细胞周期的变化

图7. 定量分析2组细胞照射前、后细胞周期变化
2.6 抑制NFBD1表达对喉癌Hep-2细胞放疗后细胞存活率的影响 如表2及图8所示,随着照射剂量的增加,各组细胞存活率均明显下降,且实验组较对照组细胞下降更明显,差异有统计学意义(P<0.05)。
2.7 抑制NFBD1表达后对Hep2细胞化疗敏感度的影响NFBD1 siRNA 转染 24 h,给予顺铂处理 48 h 后分析各组细胞存活率。与对照组(97.0%±1.6%),实验组(92.6%±2.1%),control siRNA+CDDP 组(63.2%±2.1%)相比,Hep2细胞株中NFBD1 siRNA+CDDP 组细胞存活率(37.2%±1.7%)最低(P<0.05),表明 siRNA 介导的NFBD1 表达抑制能显著增强Hep2细胞对化疗药物的敏感度。
表2 MTT法检测2组细胞放疗前、后细胞存活率的影响
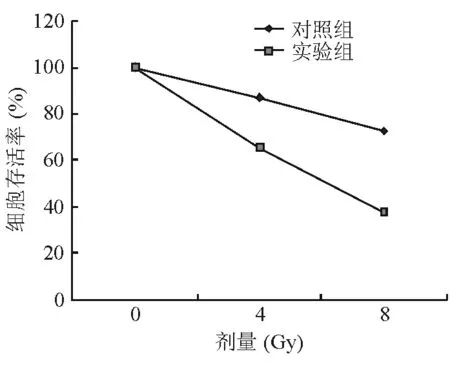
图8. 2组细胞在0、4、8 Gy照射后48 h的细胞存活百分数,0 Gy组的细胞存活率为100%
3 讨论
喉癌是耳鼻咽喉科常见恶性肿瘤之一 ,发病率高,严重影响人们的生活质量。肿瘤的发生、发展是一个涉及多重因素改变的复杂过程 ,细胞周期紊乱是其主要发病机制之一, 是由于细胞周期失调后导致的细胞无限制增殖[7]。喉癌初期症状隐匿,常被忽视,待到发现并确诊时多已进入终末期,错过了最佳治疗时间。放疗作为喉鳞状细胞癌及其他颈部鳞状细胞癌的主要治疗手段,往往存在放疗不敏感、放疗抵抗以及放疗后易复发等治疗障碍,因此,增强喉癌放疗敏感度,降低放疗抵抗就成为广大学者争相追逐的研究热点之一。基因治疗是通过基因转移技术,用正常基因原位置换缺陷基因,对单基因病进行治疗。随着喉癌相关基因研究不断深入,基因治疗喉癌已经成功地从实验室走向临床[8]。
NFBD1是一个参与DNA损伤后细胞应答通路的重要分子[9]。关于NFBD1的研究是国际生物医学领域一个非常活跃的热点。目前研究主要集中于NFBD1在DNA双链损伤应答通路中的分子功能等基础理论研究[10],但对于NFBD1和肿瘤的关系以及以NFBD1为靶点的分子治疗应用研究才刚刚起步。研究表明,外源转染NFBD1使之过表达,可使细胞更好地抵御DNA双链损伤;而通过siRNA抑制NFBD1的表达,则导致细胞对DNA损伤放射线更加敏感,并出现细胞周期检测点缺陷和细胞凋亡增加[11]。Lou等进而成功建立了NFBD1基因敲除动物模型,通过体内实验发现NFBD1基因敲除鼠具有生长抑制、雄性不孕、免疫缺陷、染色体不稳定、DNA修复缺陷、放疗增敏[12]等特性。这些研究表明NFBD1是一个有效用于鼻咽癌靶向治疗的新分子靶点,为将NFBD1 siRNA用于临床喉癌的治疗奠定了良好的基础。
目前,喉癌的治疗主要采取以手术为主,联合放化疗的综合治疗,均有较大破坏性及不良反应。尤其是对于喉癌放化疗增敏剂的研究甚少。本课题组以NFBD1为切入点,探讨NFBD1在喉癌放化疗敏感度中的作用和地位,结果表明,下调NFBD1表达后,喉癌细胞的放化疗敏感度显著提高。
NFBD1下调后喉癌细胞放疗敏感度提高的可能原因包括:①NFBD1下调致细胞周期检测点缺陷,机体不能识别及修复DNA损伤的细胞[13-14];②NFBD1下调后,DNA损伤信号不能被扩大并传导出去, DNA损伤修复蛋白不能聚集于DNA损伤位点,细胞凋亡增加[15-17];③肿瘤细胞放疗敏感度提高也源于DNA损伤的叠加效应[18],抑制NFBD1表达后,可降低DNA 损伤的修复能力[19]。
NFBD1表达下调后,Hep-2细胞化疗敏感度提高,其可能原因包括:①NFBD1表达下调后,促使细胞周期停留于 M 期,从而提高其化疗敏感度,因为处于 M 期的细胞对化疗敏感度最高;②细胞凋亡增加。Nakanishi 等[20]研究表明,DNA损伤后,NFBD1通过与p53相互作用而调节细胞凋亡。NFBD1作为DNA损伤应答系统的一个新成员,其相关功能研究正成为国内外学者关注的热点。目前研究发现:在DNA损伤后NFBD1发生磷酸化,并和DNA损伤应答通路中的多个蛋白相互作用,从而介导DNA损伤修复或者促进细胞发生凋亡。具体的机制可以概括为:在DNA损伤初期,NFBD1表达增加,与p53结合,抑制p53磷酸化,从而抑制p53促凋亡的作用并同时启动NFBD1介导的DNA修复机制,细胞DNA得以修复,从而使细胞尽量存活下来。如果损伤难以修复,NFBD1表达就会下降,p53与NFBD1分离,从而发挥p53促凋亡的作用。所以NFBD1是p53介导的与凋亡密切相关的重要分子。
后续实验,我们将进一步阐明NFBD1下调增加放化疗敏感度的分子基础,以及检测NFBD1在喉癌组织中的表达情况及临床相关性,并通过裸鼠体内实验进一步证实本实验的结论。
本实验研究表明,通过慢病毒包装的siRNA干扰技术能有效抑制NFBD1的表达,并显著提高喉癌细胞系Hep-2对放化疗的敏感度,其机制可能为NFBD1表达抑制后导致细胞周期检测点缺陷及DNA损伤修复能力降低而产生的放疗增敏效应。这为下一步开展以NFBD1为靶基因,提高肿瘤细胞放化疗敏感度,从而将基因治疗与放疗相结合的研究奠定了良好的基础。

