低氧预适应期TrkB-FL在HT22神经细胞中的表达变化研究
吴晓东,白春英
低氧/缺血(Hypoxia/ischemia,H/I)目前临床上常见的病症,是航天、深水、高原等极端环境中面临的重要难题[1-2],也是基础科研有待攻克的研究领域.而低氧预适应(Hypoxic preconditioning,HPC)是机体抵抗H/I的一种由多因素、多信号共同参与和相互作用的内源性保护机制[3],但是详细机制还尚未明确.全长型酪氨酸激酶受体B(TrkB-FL)是脑衍化的向神经因子特异性受体,其具有酪氨酸激酶结构域,常在机体压力下产生[4].TrkB-FL受体与脑源性神经营养因子结合后,能够使靶点细胞区域内TrkB受体上的酪氨酸残基部位自身磷酸化程度加强,继而激活下游一系列的连锁反应,这些改变对大脑的正常发育、突触可塑性、迁移和定位、神经元板层结构的形成方面发挥重要的作用[5-6].
1 资料与方法
1.1 一般资料
本研究使用的是小鼠海马神经元细胞系HT22细胞株.
1.2 仪器与试剂
细胞培养箱(FORMA,Thermo);超净台(1300SERIES,Thermo);显微镜(DSZ2000,Thermo);培养皿;CO2 孵育箱;非接触式超声仪(Bioruptor UCD-300,北京德泉兴业公司);酶标仪(MULJZSKAN FC);蛋白电泳仪及转膜设备(Trans-Blot);化学发光成像分析系统(fusion pulse 6,北京五洲东方科技);小型台式冷冻离心机(5424R,Thermo).PBS缓冲液;蛋白酶抑制剂;丙烯酰胺凝胶;Tris.Hcl液;胎牛血清;新生牛血清;青链霉素;DMEM培养基;胰酶;鼠源一抗体及HRP标记羊抗鼠二抗体(生工生物公司);显影发光液(北京普利赖基因公司).
1.3 方法
1.3.1 细胞培养及传代
显微镜下观察,当细胞密度将要达到90%且细胞状态较好时,可进行传代,即弃掉旧培养基,加入2ml的PBS液,轻摇并清洗细胞.共洗两次;洗最后一次时,加1ml胰酶于培养皿中,片刻后弃掉胰酶;把培养皿放入培养箱内,进行消化;片刻后,取出培养皿,加入3ml的完全培养基,慢慢地吹打细胞,将细胞吹打均匀;最后把混匀好的细胞悬液分装到若干的培养皿中(一般取细胞吸打液加6ml培养基);放置在培养箱中进行低氧处理.
1.3.2 细胞低氧模型的构建
当细胞的密度度达到70%左右时,慢慢的弃掉旧的培养基,并补加3ml的新培养基;当细胞孵育7~8个小时后,立刻进行低氧处理.本实验的低氧预适应处理组的方法为:低氧20min、常氧20min、低氧20min、常氧20min、低氧20min、常氧 20min、低氧 20min、常氧 20min,循环次数为 5次,实验条件为是99%的即为低氧;低氧预适应处理完毕后,立即把低氧预适应组以及低氧组的实验细胞均放入CO2培养箱中进行低氧处理;低氧预适、低氧、常氧完毕后,将细胞进行提取,用于后续蛋白检测实验.
1.3.3 Western bolt
蛋白提取,将取收集好的细胞,放入高压过的1.5mL EP管中,加入300μL细胞裂解液和1%蛋白酶抑制剂;50赫兹,50%的工作/间歇超声破碎细胞,每换一管细胞都洗净探头;4℃ 15000g 离心15min;离心后继续超声破碎;4℃15000g离心25min;取上清液放入新1.5mLEP管中,-80℃保存.
蛋白浓度测定,设计A-I标准液孔、待样品孔、空白对照孔,均做两个复孔;取96孔板,在孔板中分别加入100μL工作液和5μL蛋白稀释液、100μL工作液和5μL蛋白标准液;
盖上板盖,放入摇床中摇30min;放入酶标仪检测吸光度,计算样品浓度(C终).
蛋白混合液配制,将测得的蛋白进行定量,见表1.V(蛋白所需体积)=m/C终,V1(抗氧化剂体积)=V/10,V2(Loading buffer体积)=(V1+V2)/3,V3上样体积 =V+V1+V2;点样或-20℃保存.

表1 蛋白混合液的配制
电泳,制备5%的浓缩胶和6%的分离胶,浓缩胶恒压105V、分离胶恒压65V,10μg蛋白质加样量;转膜,恒流400mA、电压80V 4小时;闭,用5%脱脂奶粉封2小时,用洗膜液洗3次;孵育一抗4℃摇床过夜(1;100)、再孵育二抗室温摇床2小时.
显影和曝片,用等体积的显影A液、B液混合液浸泡膜并曝片.
1.4 统计学处理
采用GraphPad Prism 5统计软件,运用的统计学方法为方差分析(ANOVA)和T-Test检验,比较了低氧不同天数组与细胞低氧次数之间的差异,即实验中P<0.05有统计学意义.
2 结果
2.1 低氧预适应后能对细胞产生耐受作用

图1 细胞低氧后镜下观察结果(镜下,×200)
由图1所示,空白对照(图1A)的细胞状态良好.低氧组(图1B)细胞形态明显发生变化,有大量的小圆泡,可能是固缩的细胞,折光率增强.低氧预适应组(图1C)圆泡数量介于对照与低氧组之间,大部分细胞形态完好,核质清晰可见,说明低氧模型和低氧预适应模型构建成功.
2.2 蛋白浓度和纯度的测定
如图2所示,根据标准曲线求得公式y=ax+bK=c(K越接近1越好),蛋白浓度R2(R平方值)在0.9~1之间,表明蛋白浓度较纯,可用于本实验.

图2 蛋白浓度标准曲线
2.3 低氧预适应HT22细胞中TrkB-FL的表达上调
如图3所示,与对照组相比,急性低氧(0d)组HT22细胞中TrkB-FL蛋白表达有降低的趋势,而低氧预适应(4d)组HT22细胞中TrkB-FL蛋白表达有增加的趋势;低氧预适应组较低氧损伤组,其TrkB-FL蛋白表达明显升高,有统计学意义(*P<0.05).因此,TrkB-FL 可能在低氧预适应中通过表达上调发挥神经保护作用.
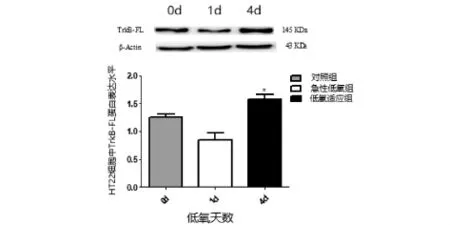
图3 TrkB-FL的Western blot结果
3 讨论
目前研究发现低氧预适应是机体在非致死性缺氧状态下产生的内源性保护机制[7].低氧预适应可能是通过上调保护性因子表达或下调损伤性因子表达,从而达到内源性保护作用.如在神经系统,低氧预适应可通过下调HESC、NR2B等因子产生神经保护[8-9],HPC通过高表达PKC、CaveOLI-3、Caspase-3、Bcl-2 等因子产生保护作用[10-11].但是目前分子机制仍未明确.而我们通过构建低氧和低氧预适应细胞模型,也是为了探索其中发挥作用的保护性因子及相关机制,以上实验也证实了细胞低氧耐受随着低氧次数的增加有上升的趋势,表明模型构建成功,一些因子表达可能发生变化,从而增加机体低氧耐受.
研究表明,当机体处于H/I时TrkB-FL受体及其配体表达会发生改变[12],不同程度的低氧都可以通过调控TrkB-FL的表达来影响脑部的生理功能,这种调控主要分为两个方面.当机体急性缺氧时,TrkB-FL在调控和维持中枢神经系统生存和修复的方面起着很重要的作用[11].前人在急性缺氧对TrkB-FL表达影响的研究中发现急性低氧刺激是通过调控BDNF和TrkB-FL在神经元中的表达来实现的,这表明二者在神经系统中起着重要调节作用[13-14].此外,研究发现将神经细胞分别放入急性低氧和常氧环境下培养,BDNF及TrkB-FL受体在急性低氧状态下的结合明显下降[15],本实验也证实了急性低氧(0d)组HT22细胞中TrkB-FL蛋白表达降低,由此可见急性低氧对TrkB-FL调节具有负性作用.小鼠经多次低氧后,即低氧预适应,TrkB通过与配体BDNF结合对神经元损伤的修复和存活发挥着重要调节作用[16].本实验也证实了低氧预适应(4d)组HT22细胞中TrkB-FL蛋白表达增加,因此TrkB-FL可能在低氧预适应中通过表达上调来发挥神经保护作用.除此之外,低氧预适应组与低氧损伤组相比,其TrkB-FL蛋白表达明显升高,有统计学意义(*P<0.05),由此可见,低氧预适应时TrkB-FL在神经元的损伤修复中起到重要作用.

