胎盘葡萄糖转运蛋白3在胎儿生长受限胎盘中的表达和意义
李金艳,胡荣静,曾 敏
(重庆市中医院:1.妇产科;2.病理科 400021)
胎儿生长受限(fetal growth restriction,FGR)增加新生儿的病死率,并且新生儿在成年后糖耐量异常及心血管疾病的发病率也随之增高。FGR的发病机制目前尚不清楚。母胎间葡萄糖转运出现异常可能与FGR的发生有着密切关系。葡萄糖是生长发育的胎儿和胎盘中有氧代谢的必需物质[1]。葡萄糖从母体血液中通过葡萄糖转运蛋白(glucose transporter,GLUT)介导转运到胎儿体内。GLUT是一个蛋白家族,目前发现共有14个异构体,主要负责葡萄糖通过细胞膜的双脂质层进入细胞内。人类胎盘滋养层上皮细胞中GLUT的主要成员包括GLUT1、GLUT3和GLUT4[2]。GLUT1主要分布在哺乳动物胎盘的合体滋养层,在整个妊娠期间呈高表达[3-4]。GLUT3通常在代谢率高的组织如受精卵植入前胚胎中的神经元和滋养外胚层中有表达[5]。GLUT3对葡萄糖有着较高的亲和力,比GLUT1和GLUT4具有更高的葡萄糖转运能力[6]。GLUT4是对胰岛素敏感的异构体,GLUT4主要负责妊娠早期在胰岛素存在条件下能够促进葡萄糖母胎间转运。研究表明FGR与先兆子痫有着相同的胎盘病因学,即胎盘滋养细胞不充分生长,导致子宫胎盘血流灌注减少使胎盘长期处于慢性缺氧状态从而引起FGR的发生。本文研究FGR胎盘中GLUT3的表达情况,以明确其作用。
1 资料与方法
1.1一般资料 选取2016年1-11月在本院住院分娩的FGR孕妇15例作为研究对象,年龄(27.3±2.4)岁,孕周(38.8±1.6)周,无其他产科的合并症及并发症。FGR的诊断标准参照谢幸主编《妇产科学》第8版。同期住院分娩的正常孕妇15例作为对照,无任何妊娠期合并症和并发症,年龄(26.8±1.6)岁,孕周(39.6±1.8)周。
1.2药品和试剂 兔抗人GLUT3多克隆抗体、SABC免疫组化试剂盒、DAB显示剂购自武汉博士德生物公司;RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶试剂盒、PVDF膜、ECL发光液购自上海碧云天生物公司;RNA提取试剂盒、逆转录试剂盒购自北京百泰克生物技术有限公司;GLUT3引物由上海生工设计引物序列并合成引物。
1.3方法
1.3.1测定新生儿、胎盘质量及标本采集 经阴道或剖宫产分娩的新生儿,娩出后擦干全身的羊水及血液称取体质量并记录。胎盘娩出后称取质量并记录。在胎盘中央靠近脐带处取大小为2.0 cm×2.0 cm×2.0 cm三角形的胎盘组织,测定胎盘组织厚度,将剪下胎盘分为两个水平片段,底蜕膜为胎盘母体面,顶部绒毛膜表面为胎儿面,分别用于以下研究。
1.3.2免疫组化检测GLUT3的表达 胎盘母体面和胎儿面常温固定于4%多聚甲醛中24 h后,常规石蜡包埋并连续切片。具体操作步骤如下:胎盘切片用二甲苯脱蜡至水,用柠檬酸缓冲液高温进行抗原修复,3%双氧水灭活内源性酶,山羊血清封闭后加入一抗GLUT3,工作液浓度为1∶50,4 ℃过夜。加入SABC免疫组化试剂盒中生物素标记的羊抗兔IgG,加入HRP标记链亲和素,DAB显色后,苏木素复染,中性树脂封片。结果判定:以胞浆出现棕黄色颗粒为阳性反应,阴性反应为除细胞核染成蓝色外,胞核和胞浆内无棕黄色反应物。采用Image-Pro Plus 6.0软件系统对GLUT3在胎盘组织的表达进行定量分析,每张切片随机选取10个完整不重叠的高倍镜视野(×400)下阳性反应面积和阳性积分光密度,计算出平均光密度值(AOD),以每例10个视野AOD的平均值作为该例的测量值。
1.3.3RT-qPCR 按照RNA提取试剂盒说明书分别提取胎盘母体面和胎儿面总RNA,cDNA的合成按照逆转录试剂盒说明操作。人GLUT3基因引物由上海生物工程合成,上游引物5′-CAG GCA CAC GGT GCA GAT AG-3′,下游引物5′-GCA GGC TCG ATG CTG TTC AT-3′。反应体系20 μL。退火温度为65 ℃,38次循环。用GAPDH作为内参照。每个样品复孔3次,最后分析溶解曲线,用GLUT3与内参基因GAPDH基因表达量的比值来表示相对表达量。
1.3.4Western blot 胎盘组织称重后剪细,加入含蛋白酶抑制剂的RIPA裂解液,用匀浆机匀浆后,BCA蛋白浓度测定试剂盒测定蛋白浓度。采用细胞裂解液配平各组之间蛋白浓度。加热使蛋白变性。蛋白样品上样量为12 μL,行SDS-PAGE胶电泳分离,然后通过电转至PVDF膜,用5%脱脂奶粉室温封闭PVDF膜30 min后,放入GLUT3抗体(1∶1 000)4 ℃过夜。PVDF转至二抗羊抗兔IgG抗体(1∶6 000)室温孵育2 h。β-actin作为内参。ECL发光液发光显影检测目的蛋白条带的变化情况。采用Bio-Rad凝胶成像系统软件分析目的条带和内参条带的灰度值。
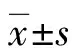
2 结 果
2.1两组新生儿出生体质量、胎盘质量、胎盘厚度 FGR组新生儿出生体质量、胎盘质量、胎盘厚度明显低于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组新生儿出生体质量、胎盘质量、胎盘厚度比较
2.2GLUT3在胎盘组织表达情况 GLUT3在胎盘细胞滋养细胞和合体滋养细胞上均有表达,主要表达于细胞膜和细胞质内。与对照组比较,FGR组胎盘组织母体面GLUT3表达呈强阳性。FGR组胎盘组织母体面GLUT3的AOD值(0.451±0.121)明显高于对照组(0.277±0.093),差异有统计学意义(P<0.05)。GLUT3在FGR胎盘组织胎儿面AOD值(0.252±0.102)与对照组(0.246±0.086)比较,差异无统计学意义(P<0.05),见图1。
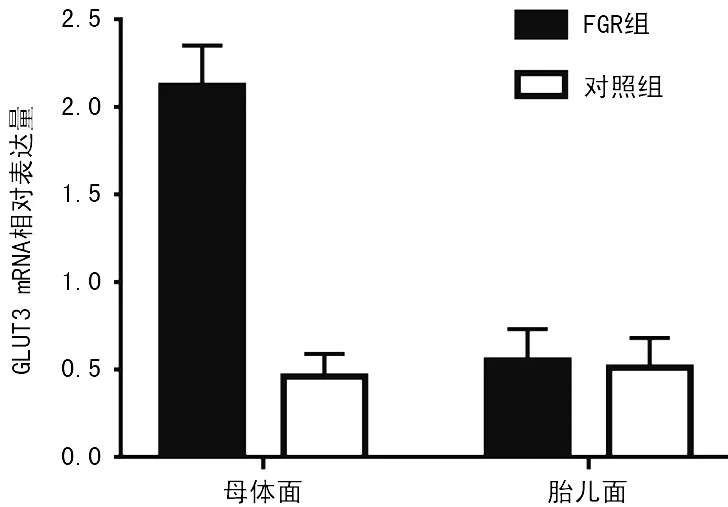
图2 RT-qPCR检测两组胎盘组织GLUT3 mRNA表达变化
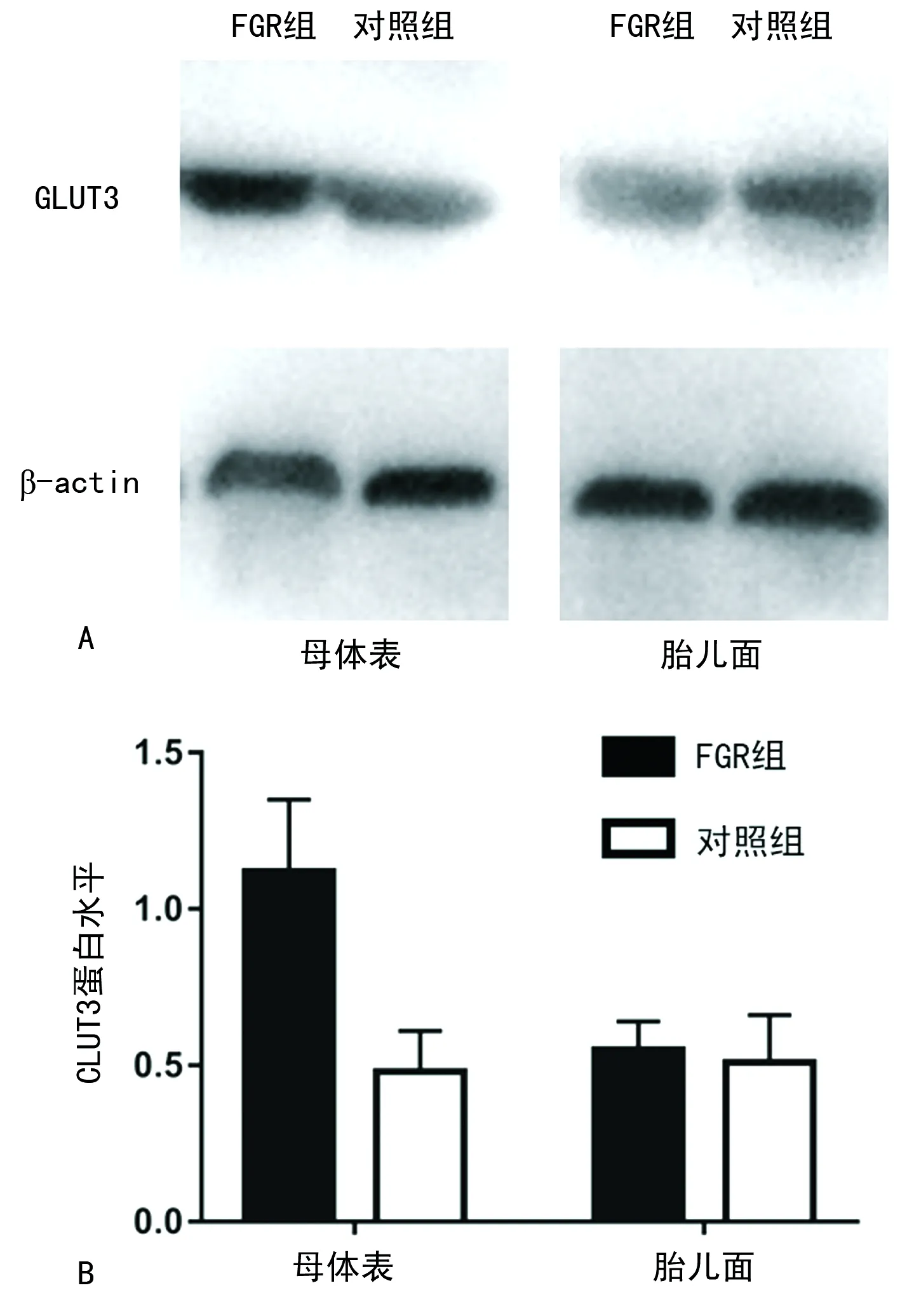
A:Western blot蛋白条带;B:两组GLUT3灰度值与β-actin灰度值的比值柱形图
2.3两组胎盘组织GLUT3 mRNA的表达 FGR组胎盘组织母体面GLUT3 mRNA的表达水平(2.12±0.23)明显高于对照组(0.46±0.13),差异有统计学意义(P<0.05)。FGR组胎盘组织胎儿面GLUT3 mRNA的表达水平(0.55±0.18)与对照组(0.51±0.14)比较,差异无统计学意义(P>0.05),见图2。
2.4两组胎盘组织GLUT3蛋白的表达 与对照组比较,FGR组胎盘组织母体面GLUT3蛋白的表达(1.12±0.23)明显高于对照组(0.48±0.13),差异有统计学意义(P<0.05)。FGR组胎盘组织胎儿面GLUT3蛋白(0.55±0.09)与对照组(0.51±0.15)比较,差异无统计学意义(P>0.05),见图3。
3 讨 论
FGR在我国发病率为3%~7%,是一种严重的妊娠并发症,围产儿的病死率是正常胎儿的4~6倍,其新生儿远期和近期并发症均明显升高[7]。葡萄糖是胎儿和胎盘主要的能量来源,是维持胎儿正常的代谢和生长的必需物质。葡萄糖转运受到复杂的机制调控。葡萄糖通过胎盘组织从母体转运到胎儿体内,而胎盘本身也会消耗葡萄糖[8],当胎盘处于缺氧状态时会过度消耗葡萄糖。胎儿组织摄取葡萄糖受葡萄糖转运体的调控。GLUT3的分布有组织特异性,主要表达在代谢活跃的组织中如胎盘、大脑、视网膜的神经元。GLUT3对葡萄糖具有较低的Km,当底物的活性降低时GLUT3仍然可以保持活性。随着妊娠增加,GLUT3在胎盘葡萄糖转运中起着更重要的作用,影响胎盘滋养细胞的植入、分化[9],参与妊娠早期和妊娠晚期胚胎发育的调控[10-11],在妊娠晚期GLUT3逐渐代替GLUT1,随着妊娠进展GLUT3在胎盘转运葡萄糖方面起着更重要的作用。FGR时葡萄糖转运体随胎儿血糖浓度急性或慢性改变而出现相应的增加或降低。当胎盘中GLUT表达异常时,葡萄糖的转运或利用受损,使胎儿葡萄糖摄取不足,通过研究发现FGR胎盘的GLUT3表达出现明显改变。
本研究显示,GLUT3主要表达于细胞滋养层细胞,部分表达于合体滋养层细胞。这与许多学者发现妊娠早期GLUT3在合体滋养层细胞中表达相一致[12]。GLUT3在FGR胎盘组织母体面表达呈强阳性,FGR胎盘组织母体面GLUT3 mRNA和蛋白明显高于对照组,两组间胎盘组织胎儿面差异无统计学意义(P>0.05)。以上研究结果表明,FGR胎盘的母体面和胎儿面对葡萄糖的转运能力不同。既往研究表明从足月胎盘分离培养的滋养细胞处于缺氧状态时GLUT3 mRNA表达增加[11]。来源于绒毛膜癌的滋养叶细胞随着供氧压力降低,GLUT3表达呈剂量依赖性增高,同时伴随着上皮细胞的葡萄糖转运增加[13]。因为FGR的胎盘绒毛血管发育异常,胎盘血流处于低灌注状态,使胎盘绒毛间气体交换下降,胎盘处于缺氧状态,故推测因为FGR胎盘处在缺氧状态导致胎盘组织母体面GLUT3表达增加,从而提高了葡萄糖从母体到胎盘的转运,增加胎盘组织内葡萄糖以提供更多能量来适应胎盘缺氧状态,但胎盘因缺氧过度消耗葡萄糖,导致转运到胎儿体内的葡萄糖减少,从而FGR。另一方面,FGR胎盘组织母体面GLUT3表达增加可能与糖皮质激素增高有关系[14]。FGR发生时胎儿处于高水平的糖皮质激素环境中,胎盘组织母体面GLUT3表达增高是提高胎盘对葡萄糖的供应,以减轻胎儿暴露于糖皮质激素引起的胎儿低血糖[15],但是胎盘过度消耗葡萄糖损害了葡萄糖向胎儿转运,从而导致生长受限。
FGR严重程度与胎盘缺氧受损程度密切相关。FGR胎盘组织母体面GLUT3表达增高提示胎盘发生缺氧程度。胎盘因缺氧而过度消耗了葡萄糖,最终可能导致转运到胎儿的葡萄糖降低,影响胎儿的生长发育。

