甜菜红素的提取及纯化研究
吕思润,吴玉梅,代翠红,罗成飞,刘天骄
(1.哈尔滨工业大学化学与化工学院,黑龙江 哈尔滨 150086;2.黑龙江大学农作物研究院/中国农业科学院甜菜研究所/农业部糖料产品质量安全风险评估实验室(哈尔滨),黑龙江 哈尔滨 150080)
0 前言
甜菜红素具有促进免疫系统、抗氧化、清除自由基和预防心血管疾病、神经变性疾病及化学治疗癌症的作用[1]。因此,广泛应用于食品、制药和化妆品行业。然而,目前高纯度的甜菜红素提取工艺方面还存在成本高、效率低下等问题。因此,开展利用红甜菜提取甜菜红素,然后利用大孔树脂结合葡聚糖凝胶色谱来纯化目标物质,使甜菜红素与甜菜黄素、糖类等分离。优化甜菜红素提取、纯化的工艺,实现既保证了甜菜红素的生物活性又能进行工业化大生产的目标,这样得到的甜菜红素就具有实用价值。
1 材料与方法
1.1 实验材料及仪器设备
1.1.1 实验材料
本实验中采用的原料为哈尔滨工业大学自育的食用红甜菜块根,实验中所用的主要化学试剂主要为化学纯试剂。
1.1.2 实验仪器设备
本实验中使用的主要仪器设备紫外可见分光光度计,北京普析通用仪器有限公司;酶标仪(Eon)基因有限公司;荧光酶标仪(Infinite M200PRO)帝肯贸易有限公司;台式高速冷冻离心机(3K15)北京五洲东方科技发展有限公司;台式离心机(TGL-16G)上海安亭科学仪器厂;冷冻干燥机(Zirbus)嘉盛(香港)科技有限公司。
1.2 方法
1.2.1 甜菜红素的提取
挑选新鲜的红甜菜根,洗净表面,削除腐烂的部分,将甜菜块根切成长条,利用原汁机进行压榨,分离得到红甜菜汁和红甜菜渣,分开称量甜菜渣和甜菜汁。密封袋装好后,冻存在-20℃的冰箱中,留下部分红甜菜渣,提取甜菜红素;进一步处理红甜菜汁后,将红甜菜汁冻存在-20℃的冰箱中。红甜菜汁用200目滤布过滤红甜菜汁,然后用普通滤纸对滤液进行抽滤,初步除去甜菜汁中残留的膳食纤维。灌装密封,保存在4℃的冰箱中。
1.2.2 全波长扫描分析
称取1.00 g红甜菜渣于100 mL比色管中,以料液比为1∶30,加入蒸馏水,盖上玻璃塞,常温浸提1 h。用200目纱布粗滤,然后利用滤纸抽滤,最后以4 000 r/min的速度离心20 min。取上清液,分别在190~650 nm和340~650 nm的波长范围内进行全波长扫描,确定甜菜红素的最大吸收波长。
1.2.3 甜菜红素提取的单因素试验
a.提取剂的选择:取1.00 g红甜菜渣于100 mL比色管中,以料液比为1∶30,分别加入浓度为0%、20%、30%、40%、50%、60%、80%和100%的乙醇以及0.1 M的pH为2、4、6、8、10的草酸—碳酸钠的缓冲溶液,盖上玻璃塞,常温下浸提1 h。用2.2.2中的方法粗滤、抽滤和离心,在535 nm处测定吸光度。根据朗博比尔定律A(λ)=εbC,甜菜红素的含量与它的吸光度成正比,因此可以采用公式(1)计算提取率。
(1)
其中:Bp: betanin percentage(mg/g);A: 吸光度(535 nm);DF: 稀释倍数;Mw: betanin的相对摩尔质量(550 g/mol);v: 溶液的总体积(L);ε: betanin的摩尔消光系数(65 000 L·mol-1·cm-1);L:光程长(1 cm);m:红甜菜渣的质量(g)
b.液料比的选择:分别称取10.00 g、5.00 g、3.33 g、2.50 g、2.00 g红甜菜渣于100 mL比色管中,加入50 mL蒸馏水,盖上玻璃塞,在20℃的条件下,浸提1 h。粗滤、抽滤、离心和稀释。在535 nm处测定吸光度,利用公式(1)计算提取率。
c.提取时间的选择:称取3.33 g红甜菜渣于100 mL比色管中,加入50 mL蒸馏水,在20℃的条件下浸提,浸提时间为20 min,30 min,40 min,50 min,60 min和70 min。粗滤、抽滤、离心和稀释。在535 nm处测定吸光度,利用公式(1)计算提取率。
d.提取温度的影响:称取3.33 g红甜菜渣于100 mL的比色管中,加入50 mL蒸馏水,在20℃,30℃,40℃,50℃,60℃和70℃的水浴温度下,浸提50 min。粗滤、抽滤、离心和稀释。在535 nm处测定吸光度,利用公式(1)计算提取率。
1.2.4 响应面试验优化甜菜红素的提取条件
从以上四组单因素实验中,选出对甜菜红素提取率影响较明显的三个因素,通过Design-expert设计出三因素三水平的17组实验,按照2.2.2中的操作流程实验,依次将实验结果带入,通过所得响应面结果及优化值确定最佳提取工艺。
1.2.5 提取液的处理
称取2 kg红甜菜渣,以1∶20的料液比,在38℃下浸提48.3 min,粗滤、抽滤。取1 L的解冻红甜菜汁与提取液混合,旋蒸。设定初始温度为50℃,转速采用20 r/min,旋蒸1 h后,水浴温度调到60℃,转速为50 r/min,总共旋蒸3 h。根据此旋蒸条件,可以得到500 mL红甜菜汁浓缩液,冻存在-20℃的冰箱中。
1.3 甜菜红素纯化
1.3.1 大孔树脂的处理
树脂的预处理方法为:将各种型号大孔树脂置于95%的医用乙醇中浸泡24 h,液面高于树脂表面5 cm。充分溶胀后,将树脂倒在200目的标准检验筛中,用自来水冲洗至无白色浑浊物出现,无醇味儿。静置沉淀,倒掉上层清水。然后加入5%盐酸,搅拌,使树脂与酸混合均匀,浸泡8 h,倒入检验筛中,用自来水冲洗至中性,沉淀,倒掉上层清水。加入5%氢氧化钠溶液,搅拌混匀,浸泡8 h,倒入检验筛中用自来水冲洗至中性,沉淀,倒掉上层清水。最后用蒸馏水冲洗,浸泡备用。
树脂再生的方法为:每次上样洗脱完毕后,先用2%盐酸浸泡至色素溶出,倒入检验筛中用自来水冲洗至中性,沉淀,倒掉上层清水;再用2%氢氧化钠溶液浸泡至树脂呈现原来的颜色,倒入检验筛中用自来水冲洗至中性,沉淀,倒掉上层清水;最后,用蒸馏水冲洗,浸泡备用。
大孔树脂采用湿法装柱,用3倍体积蒸馏水平衡大孔树脂,使树脂接触液面处平整且树脂高度不变,树脂的平衡时间一般是12 h以上。
1.3.2 不同大孔树脂对甜菜红素吸附性能的影响
取经过预处理的树脂,用200目纱布过滤,取下包裹树脂的纱布,置于干燥的滤纸上,静置15 min。准确称量干燥处理后的10种树脂3.00 g(湿态重量),置于100 mL的三角瓶中,利用甜菜汁浓缩液制备吸光值为A的甜菜红素溶液,向三角瓶中加入50 mL甜菜色素提取液。将三角瓶置于恒温振荡器中,在20℃、120 r/min的条件下震荡吸附24 h。200目纱布过滤,取滤液,12 000 r/min离心10 min,在535 nm下测定上清液吸光值A1。按照公式(2)计算吸附率,比较各树脂对甜菜红素的静态吸附效果。
M(%)=(A-A1)/A*100%
(2)
其中:M:吸附率(%);A:吸附前样品溶液的吸光度值;A1:吸附后样品溶液的吸光度值。
1.3.3 不同大孔树脂对甜菜红素解析性能的影响
静态吸附后,用200目纱布过滤,取下纱布置于干燥的滤纸上,静置15 min。将吸附饱和的各种型号树脂转移至另外的100 mL三角瓶中,加入50 mL 60%的乙醇,在20℃、120 r/min条件下振荡解析24 h,离心收集滤液,在12 000 r/min的条件下离心10 min,在535 nm下测定吸光值,按照公式(3)计算解析率。
D(%)=A2/(A-A1)*100%
(3)
其中:D: 解析率(%);A: 吸附前样品溶液的吸光度值;A1: 吸附后样品溶液的吸光度值;A2: 解析后样品溶液的吸光度值。
1.3.4 X-5大孔树脂对甜菜红素的静态吸附曲线
准确称取X-5大孔树脂3.00 g,置于100 mL的三角瓶中,加入吸光度值为A的甜菜红素粗提液50 mL,在20℃、120 r/min条件下振荡吸附,分别在0.5 h,1h,1.5 h,2 h,2.5 h,3 h,3.5 h,4 h,4.5 h和5 h后过滤,取滤液,12 000 r/min的条件下离心10 min,在535 nm下测定吸光度值,按照公式(2)计算吸附率,绘制X-5大孔树脂对甜菜红素的静态吸附曲线。
1.3.5 洗脱液浓度对X-5大孔树脂解析效果的影响
准确称取吸附饱和的X-5大孔树脂2.00 g,置于100 mL的三角瓶中,分别加入50 mL蒸馏水、5%乙醇、10%乙醇、15%乙醇、20%乙醇、40%乙醇、60%乙醇、80%乙醇和无水乙醇,在20 ℃、120 r/min条件下振荡解析24 h,用200目纱布过滤,取滤液,12 000 r/min离心10 min,在535 nm下测定上清液的吸光度值,按照公式(3)计算解析率。
1.3.6 进样速度对X-5大孔树脂吸附能力的影响
量取200 mL X-5大孔树脂,以湿法装柱,装柱量为柱身体积的1/2。柱子的参数为:径长比为3 cm×45 cm,顶端球体的体积为500 mL。利用旋蒸后的红甜菜浓缩汁,制备吸光值为A0的甜菜红素粗提液,以1 mL/min、2 mL/min、3 mL/min和4 mL/min的流速上样,每隔5 min测定流出液的吸光值A,以A/A0为纵坐标,时间为横坐标作图,考察进样速度对X-5大孔树脂吸附能力的影响。
1.3.7 洗脱速度对X-5大孔树脂解析能力的影响
称取一定量的X-5大孔树脂,以湿法装柱。利用甜菜浓缩汁制备吸光值为A0的甜菜红素粗提液,以2 mL/min 的流速上样,上样量为柱体积的1/100。吸附平衡后,用4 BV的60%的乙醇溶液以不同的流速来洗脱,收集流出液。在535 nm处测定吸光值,根据公式3计算解析率。因为上样量远远低于树脂当量,甜菜红素全部被吸附,所以A1的值为0。
1.3.8 洗脱剂体积对X-5大孔树脂解析能力的影响
称取一定量的X-5大孔树脂,以湿法装柱。制备吸光值为A0的甜菜红素粗提液,以1 mL/min的流速上样,吸附平衡后,分别以1 BV、2 BV、3 BV和4 BV的60%乙醇溶液洗脱,洗脱液的流速为1 mL/min,测定目标流出液的吸光度,利用公式3计算解析率,比较不同洗脱剂体积对X-5大孔树脂解析能力的影响。
1.3.9 X-5大孔树脂洗脱曲线的测定
为了确定目标物质洗脱出来的具体时间,测定了X-5大孔树脂的洗脱曲线。样液为旋蒸后的浓缩液,上样量为1/100,上样速度为2 mL/min,洗脱液的体积为4 BV,洗脱速度为1 mL/min的条件下,每隔5 min收集一次流出液,在535 nm处测定流出液的吸光度,做出洗脱曲线。
1.3.10 甜菜红素纯度的确定
为了确定甜菜红素的纯度,对目标提取物进行全波长扫描,波谱范围是340~600 nm。比较粗提液和纯化液的波谱图,作三种物质的全波长扫描图谱。
1.3.11 甜菜红素的冻干处理
收集经过树脂处理的甜菜色素溶液,在40℃、50 r/min的条件下旋蒸1 h,处理时间为半小时,为了除去其中的乙醇。然后将浓缩液放在平皿中,覆上保鲜膜,置于-80℃的冰箱中预冻12 h。利用冻干机冻干后,刮取冻干粉,保存在干燥器中。
1.3.12 Sephadex LH-20进一步纯化甜菜红素1.3.13 Sephadex LH-20的预处理及装柱
称取10.00 g葡聚糖凝胶于250 mL烧杯中,加入10%甲醇,在室温条件下放置3 h,进行溶胀。
选取的层析柱规格为:半径为1 cm,长度为25 cm。装柱的流程为:先加入1/3柱体积的10%甲醇,然后将溶胀好的胶连续装入,自然沉降。待凝胶沉积到柱床已经超过1 cm时,打开下口螺旋夹,继续装柱。装柱须均匀,不能有气泡或明显裂纹。
1.3.14 Sephadex LH-20的上样与洗脱
葡聚糖凝胶柱的上样体积为低于柱体积的1/10。上样体积为0.5 mL,上样浓度为100 mg/mL,上样速度为0.5 mL/min。
采用反相梯度洗脱,洗脱液为甲醇溶液,浓度梯度是10%,20%,30%,40%,50%,60%,70%,80%,90%和100%,每个梯度甲醇溶液的加入体积为4 mL。
1.3.15 Sephadex LH-20洗脱曲线的测定
上样洗脱,每隔一分钟收集一次样品,取200 uL加入到96孔板中,利用酶标仪在535 nm处测定每孔的吸光度,制作甜菜红素的洗脱曲线。
1.3.16 样品纯度分析1.3.17 HPLC分析纯化物的纯度
收集2.4.3中洗脱出来的甜菜红素溶液,从吸光度上升到0.4开始收集,每隔5 min收集一个样品,取1.5 mL进行高效液相分析。稍微修改王玉平[2]的色谱分析方法。
1.3.18 纯化后样品含量的测定
准备烘干至恒重的平皿,吸光度在0以上初步纯化液和得到的不含甜菜黄素的甜菜红素纯化液,混合,稀释,测定吸光度,利用公式(1)计算1 mL溶液中甜菜红素的重量。取上述混合溶液,在每个平皿中加入20 mL,冻干,准确称量1 mL样液的重量三次平行。利用公式(4)计算得到的甜菜色素的纯度。
(4)
其中:m1:20 mL纯化液中甜菜色素的重量(g);m:平皿和纯化液的总重量(g);m0:平皿的重量(g)。
1.4 甜菜红素的稳定性研究
收集经过大孔树脂纯化后的甜菜红素溶液,将色素溶液稀释成吸光值为A的溶液。量取该溶液50 mL置于用滤纸和锡箔纸包裹的比色管中,加入5 mL液体石蜡密封,放在20℃恒温箱中编号;量取该溶液50 mL置于比色管中,加入5 mL液体石蜡密封,放在20℃恒温箱中编号;量取该溶液50 mL置于用滤纸和锡箔纸包裹的比色管中,放在20℃恒温箱中编号;量取该溶液50 mL置于用滤纸和锡箔纸包裹的比色管中,置于恒温振荡器中,调节转速为100 r/min,温度为20℃编号;量取该溶液50 mL置于用滤纸和锡箔纸包裹的比色管中,放在4℃冰箱中编号;量取该溶液50 mL置于用滤纸和锡箔纸包裹的比色管中,放在40℃水浴锅中编号;量取该溶液50 mL置于用滤纸和锡箔纸包裹的比色管中,放在80℃冰箱中编号。每个编号三个重复,每隔一段时间,取出样品,12 000 r/min离心10 min,测定吸光度。经对比分析即可得出光照对于色素稳定性的影响、氧气对于色素稳定性的影响、温度对于色素稳定性的影响。
2 结果与分析
2.1 甜菜红素的全波长扫描图
根据2.2.2中描述的方法,在190~650 nm和340~650 nm之间进行全波长扫描,扫描结果如图1所示。

图1 提取液的全波长扫描图A:波长范围在190~650 nm;B:波长范围在340~650 nm
由图1结合扫描数据可知,提取液在可见光区的最大吸收波长为484 nm和535 nm,分别是甜菜黄素和甜菜红素[3]的特征吸收波长。紫外区的最大吸收波长为210 nm,此处应该是甜菜醛酸的特征吸收波长[4],甜菜醛酸是甜菜红素(betacyanin)和甜菜黄素(betaxanthin)的结构组成部分。
2.2 四种单因素对甜菜红素提取率的影响
2.2.1 提取剂的种类对甜菜红素提取率的影响
不同的提取剂对甜菜红素提取率较大。甜菜红素在乙醇溶液中的溶解度大于酸性溶液中的溶解度,但是在无水乙醇中的溶解度很低,利用方差分析,比较提取剂为蒸馏水、20%~60%乙醇溶液的甜菜红素的提取率,标准差为0.003 04,离散度低,数据差异较小。
2.2.2 液料比对甜菜红素提取率的影响
实验结果表明,液料比从5∶1上升到15∶1时,提取率上升明显,随着液料比的进一步增加,提取率上升速度降低。提取剂用量增加,后续旋蒸时间加长,使得生产成本提高,不利于实际应用,因此最佳的液料比是15∶1。
2.2.3 提取时间对甜菜红素提取率的影响
随着提取时间的延长对甜菜红素的提取率升高。20 min~50 min这个时间段,是色素溶出的集中阶段,所以甜菜红素的提取率上升速度较快。50 min后,提取率上升的速度趋于平缓,应该是溶质中的甜菜红素几乎完全析出。综合分析,50 min是提取的最佳时间。在20℃(无法灭活酶的温度)的条件下,随着提取时间的增加,甜菜红素提取率增加,表明酶对于甜菜红素的降解作用不强。
2.2.4 提取温度对甜菜红素提取率的影响
提取率随着温度先升高后降低,在40℃时,提取率最高。温度在50-60℃,70-80℃和60-75℃之间,甜菜色素(betalain)会发生显著的降解[6]。在85℃条件下加热,甜菜苷配基(betanidin)会裂解生成一些脱羧和脱氢产物[41]。综上分析,40℃是提取甜菜红素的最适温度。
2.3 响应面试验优化甜菜红素的提取条件
2.3.1 贝克曼设计(Box-Behnken)实验设计
根据贝克曼设计(Box-Behnken)的中心组合设计原理,采用三因素三水平的响应面分析,设计实验因素与水平,如表1所示。

表1 响应面实验因素水平设计表
利用Design-Expert共设计了17组实验,中心点有5个,根据实验设计进行实验,所得结果如表2所示。

表2 响应面分析结果
2.3.2 回归方程模型的构建及显著性检验
通过Design-Expert7.0数据分析软件对表2中数据进行处理,得到回归方程如下:
式中X1、X2、X3分别为液料比、时间和温度的编码值。
对此回归方程及系数进行显著性分析结果如表3所示。
分析表3可知,本试验所选用模型具有显著性(P=0.023 5);模型中,二次项X1X2、X3X2在P<0.01水平上极显著。方差分析和显著性检验表明,F值为4.93,表明该模型是显著的,同时失拟项是不显著的,而且相关系数R2为0.863 8,数值较高,因此拟合有效,变量与响应值之间线性关系显著,因此该试验方法可以用来分析甜菜红素的提取效果。变异系数CV=3.14%,说明模型能很好地反映真实的试验值,即试验的可靠性较高。
自均方值MSX1=1.07×10-4、MSX2=2.24×10-6、MSX3=1.26×10-4,因此得到影响甜菜红素提取率的大小顺序为X3>X1>X2,即温度>液料比>时间。

表3 回归模型方差分析表
2.3.3 响应面和等高线分析
为了进一步研究相关变量之间的交互作用和确定最优点,通过Design-Expert软件做了三个关键影响因素对提取率交互影响的等高线图及其曲面图,从等高线图可以直观地反映出两变量交互作用的显著程度。

图2-1 液料比与时间对提取率影响的响应曲面图和等高线
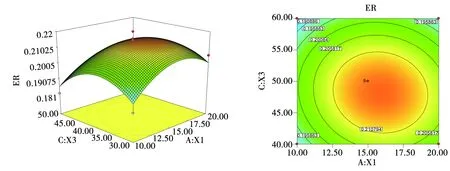
图2-2 液料比与温度对提取率影响的响应曲面图和等高线

图2-3 时间与温度对提取率影响的响应曲面图和等高线
等高线图2-1(b)、2-2(b)和2-3(b)较为直观地看出各因素对甜菜红素提取率的影响,曲线越陡峭,表明该因素对响应值的影响越大。等高线表示同一等高线上,甜菜红素的提取率相同,并且随着提取率的上升,等高线向中心移动,形象地说明了在中心区域存在甜菜红素提取量的极大值。圆中椭圆排列越密集,表明该因素变动对甜菜红素提取率的影响越大。
从图2-1(a)、2-2(a)和2-3(a)可以看出某2个影响因素与响应值之间的关系,交互作用分析三维空间的曲面图,可反映各因素对响应值的影响。
2.3.4 验证实验
结合回归模型分析,由回归方程可以计算出提取的最优工艺条件为:料液比为19.41∶1,提取时间为48.37 min,提取温度为38.17℃。在此最优工艺条件下,预测甜菜红素提取率为0.210 3 mg/g。。
为验证模型预测的准确性和可靠性,按照优化后的条件,根据实际情况,修改模拟出来的最优工艺条件,修改后实验方案为:料液比为20∶1,提取时间为48.3 min,提取温度为38℃。在此条件下,重复验证实验3次,平均提取率为0.209 9 mg/g,与测算值0.210 3 mg/g相近,表明预测值与试验值之间具有较好的拟合性,证实了该模型的有效性。
2.4 甜菜红素的纯化
2.4.1 不同大孔树脂对甜菜红素吸附解析性能的影响
影响大孔树脂的主要因素有吸附剂的性质(比表面积、粒度大小和极性)、目标物质的性质(溶解度、极性和相对分子量)、温度、溶液浓度和pH,因此需要考察不同吸附剂的吸附效果。本实验采用的10种树脂,性能如表4所示。

表4 吸附树脂的物理结构参数
其中ADS-7、NKA-2和NKA-9都属于极性树脂,其吸附机理可能包含范德华力、静电力、氢键等多种吸附力,都属于物理吸附的范畴。ADS-7对皂苷、黄酮、生物碱均有吸附能力,选择性较高,对植物色素有特殊的亲和力,这赋予其优良的脱色功能。其他的7种树脂属于非极性吸附树脂,吸附机理为疏水性吸附。树脂优点是:比表面积和孔径较大,吸附量较大,洗脱容易,吸附动力学性能良好,对糖类、无机盐、碱、盐、小分子亲水性有机物均不吸附。
实验结果如表4-2所示。
功能成分的吸附率和解析率能够直接反映树脂的性能,吸附率和解析率较高,表明此树脂的对目标物质的纯化效果良好。根据表5所示,根据吸附率的数据,吸附作用较强的是ADS-7和S-8树脂,但这两种树脂均属于强极性树脂,ADS-7树脂兼具吸附和脱色双重功能,因此不考虑该两种树脂。比较其余树脂,发现X-5大孔树脂的吸附率最高,D4020的解析率最高。但是比较最终解析出来的甜菜红素的吸光值,X-5解析出来的甜菜红素浓度高于D4020。综合考虑,选择X-5大孔树脂作为分离纯化甜菜红素的最佳树脂。

表5 大孔树脂对betacyanin的静态吸附、解析性能的影响
2.4.2 X-5大孔树脂对甜菜红素的静态吸附曲线
由图3可知,在0.5 h时,吸附率已经达到较高的水平,说明X-5大孔树脂能够较快地吸附甜菜红素。在0~1 h内,吸附率随着时间的增加而显著上升;在1~2 h内,吸附率随时间缓慢上升,表明树脂的吸附达到了饱和;2~5 h内,吸附率随时间变化不大,趋于平衡。因此,X-5达到吸附平衡所需最短时间为2 h。

图3 X-5大孔树脂的静态吸附曲线
2.4.3 洗脱液浓度对X-5大孔树脂解析效果的影响
如图4可知,在乙醇浓度为20%时,解析率达到最大水平,因此采用20%的乙醇作为洗脱液。可能因为甜菜红素是由甜菜苷配基被糖基或者有机酸修饰得到,甜菜红素的分子结构中既包含亲水性的羟基和羧基,也包含疏水性的苯环,这样的结构使甜菜红素更易溶于乙醇的水溶液中。

图4 洗脱液浓度对X-5大孔树脂的解析性能的影响
2.4.4 进样速度对X-5大孔树脂吸附能力的影响
按照2.3.6中描述的方法,考察进样速度对X-5大孔树脂吸附能力的影响,结果如图5所示。

图5 进样速度对X-5大孔树脂吸附能力的影响
由图5可以看出,随着时间的延长,树脂的吸附量逐渐达到饱和,洗出液的甜菜红素浓度逐渐增加。洗脱速度越大,最终流出液的浓度越大,吸附效果越差。同时,在实验操作过程中,洗脱速度大于2 mL/min时,样液容易冲起树脂,破坏层析柱的完整性。2 mL/min的进样速度与1 mL/min进样速度相比,流出液的最终浓度相差不大,但是在1 mL/min进样速度下,流出液的流出速度过慢,等待时间过长,影响实验效率。因此选择2 mL/min为最终的进样速度。
2.4.5洗脱速度对X-5大孔树脂解析能力的影响
由图6可知,在1 mL/min处解析率最高,而且在此流速下,层析柱不被冲散,保持了柱体的完整性,因此选择1 mL/min为最佳的洗脱速度。

图6 洗脱速度对解析率的影响
2.4.6 洗脱剂体积对X-5大孔树脂解析能力的影响
按照2.3.8中的方法,进行了洗脱液体积对于树脂吸附能力的影响实验,结果表明。洗脱液体积过小,甜菜红素解析不够完全,过大时的液压也影响了甜菜红素的分配。综合分析,采用3 BV为最终的洗脱液体积。
2.4.7 X-5大孔树脂洗脱曲线的测定
按照2.3.9中描述的方法测定X-5大孔树脂的洗脱曲线,结果如图7所示。
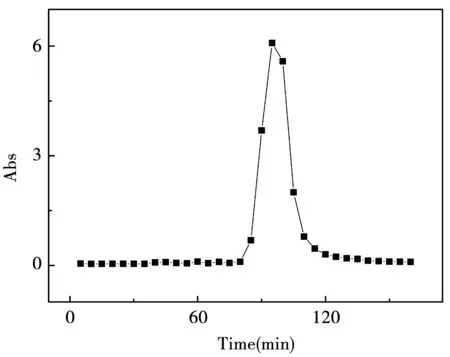
图7 X-5洗脱曲线
由图4-6可知,90~105 min时,测得流出液的吸光值大于零,表明色素在此条件下被洗脱下来,因此收集90~105 min时流出的液体。在95 min时,吸光值达到最高水平。
2.4.8 甜菜红素纯度的确定
取粗提液和纯化液,作三种物质的全波长扫描图谱,如图8所示
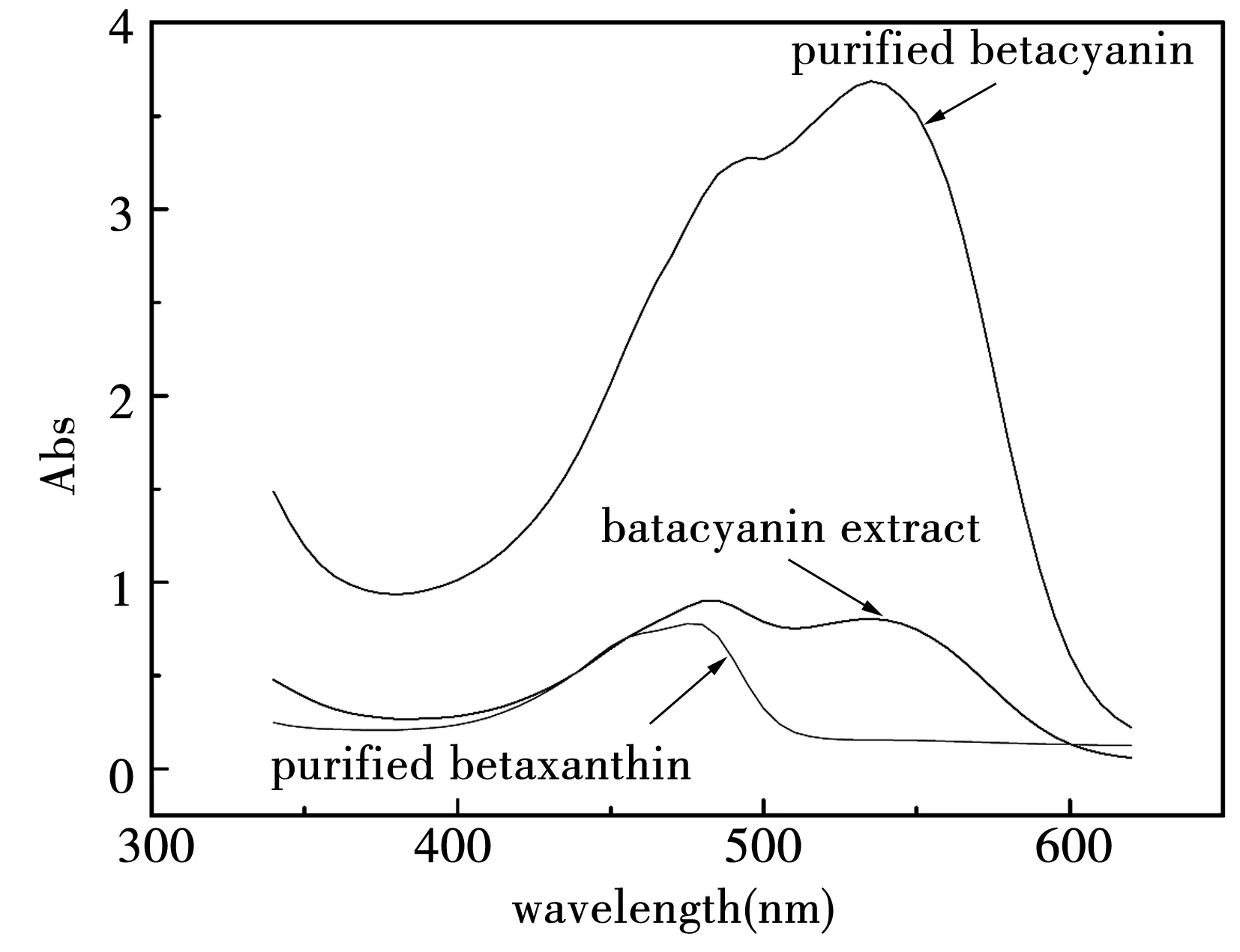
图8 提取液和纯化液的全波长扫描图谱
全波长扫描的波谱范围是340~600 nm,由图可知,原提取液中,484 nm处的吸收峰高于535 nm处的吸收峰;纯化后的色素溶液中甜菜黄素(betaxanthin)相对含量大大降低,484 nm处吸收峰的高度低于535 nm处吸收峰的高度,大大降低了甜菜黄素的比例;纯化得到的甜菜黄素,只在484 nm处有吸收峰。因此,通过以上纯化条件,甜菜红素得到了很好的纯化。
2.5 Sephadex LH-20进一步纯化甜菜红素
2.5.1 Sephadex LH-20洗脱曲线的测定
甜菜红素从20 min开始被洗脱出来,在30 min时,甜菜红素的析出达到最高水平,25~40 min是甜菜红素析出的集中阶段。在40~50 min的时间段内,出现的峰应该是甜菜黄素(betaxanthin)[7],因为此时洗脱出来的溶液呈现黄色。这表明Sephadex LH-20能够对甜菜红素进行很好的分离,进一步将甜菜红素和甜菜黄素分开。
2.5.2 HPLC分析洗脱液的纯度
图9中9(a)~9(e)对应Sephadex LH-20纯化出的甜菜红素,对应的时间段为:25~30 min、30~35 min、35~40 min、40~45 min和45~50 min阶段洗脱出来的色素;图9(f)为经过一次纯化后的甜菜红素。
功能成分的吸附率和解析率能够直接反映树脂的性能,吸附率和解析率较高,表明此树脂的对目标物质的纯化效果良好。根据表5所示,根据吸附率的数据,吸附作用较强的是ADS-7和S-8树脂,但这两种树脂均属于强极性树脂,ADS-7树脂兼具吸附和脱色双重功能,因此不考虑该两种树脂。比较其余树脂,发现X-5大孔树脂的吸附率最高,D4020的解析率最高。但是比较最终解析出来的甜菜红素的吸光值,X-5解析出来的甜菜红素浓度高于D4020。综合考虑,选择X-5大孔树脂作为分离纯化甜菜红素的最佳树脂。

图9 甜菜色素高效液相色谱图(检测波长535 nm)
因为在甜菜红素中,甜菜苷是主要成分,含量在甜菜红素的75%左右[8],根据图11可知,25 min对应的物质应该是甜菜苷,30 min对应的物质应该是异甜菜苷。25~40 min是甜菜红素流出的集中阶段,这与Sephadex LH-20的研究结果一致,而且此时流出峰中没有甜菜黄素的特征峰,表明不含甜菜黄素。

图10 峰面积变化趋势
根据HPLC的结果分析表明,一次纯化能够大大减少甜菜黄素的含量,二次纯化能够除去甜菜黄素。
2.5.3 纯化样品中甜菜红素的含量
按照2.5.2中描述的方法,研究纯化后甜菜红素的纯度,一次甜菜红素的纯度为11.636±0.764 8 mg/g,二次甜菜红素的纯度为61.108 ±0.916 mg/g。结果表明,可能是其他成分取代了甜菜苷的羟基,生成了甜菜红素以外的物质,或者是纯化后的物质中包含一些未被除净的成分。
2.6 甜菜红素的稳定性研究
按照2.5中描述的方法,研究光照、温度、时间和氧对甜菜红素稳定性的影响,实验结果如图12所示。
根据图11所示,随着时间的延长,甜菜红素的含量呈下降趋势,说明溶解在水中的甜菜红素不太稳定。分析1号和2号实验组可知,光照对甜菜红素的影响不大。
摇晃可以增大色素溶液中的溶氧量,石蜡可以隔绝氧气,降低色素溶液中的溶氧量。隔绝氧气的条件下,甜菜红素降解速度慢,正常暴露于空气的条件下,甜菜红素的降解速度慢于摇晃条件下的降解速度。这样的实验结果和Attoe E等人[9]的研究结果一致。
3号、5号、6号和7号实验组中,除了温度不同,其他条件都保持一致。温度对甜菜红素的影响很大,在80℃条件下3 h内甜菜红素的含量就会下降到10%以下;40 ℃的条件下,5天就会下降到10%;低温(4℃)保存能够极大地提高甜菜红素的稳定性,20天内甜菜红素的含量才下降了30%。因此低温有利于甜菜红素的保存。
3 结论
3.1 通过单因素实验得出四个因素的最佳水平为:最佳提取剂是蒸馏水,最佳液料比是15∶1,最佳提取时间是50 min,最佳提取温度是40℃。然后以提取率为响应值,液料比、提取时间和提取温度为变量,设计响应面实验,修改优化值,结果为:料液比为20∶1,提取时间为48.3 min,提取温度为38℃,平均提取率为0.209 9 mg/g。
3.2 采用X-5大孔树脂对提取出来的甜菜红素进行初步纯化表明,在0.5 h时,吸附率达到了较高的水平;在2 h时达到吸附平衡;甜菜红素的最佳洗脱液为20%的乙醇。动态吸附解析实验表明:最佳上样速度为2 mL/min,最佳洗脱速度为1 mL/min,洗脱液体积为3 BV。洗脱到95 min时,甜菜红素的吸光值达到最高水平,集中收集甜菜红素的时间段为85~110 min。纯化后的样品在535 nm的吸收峰明显提高,表明X-5的纯化极大提高了甜菜红素在纯化液中的比例。
3.3 采用反相洗脱的方法利用Sephadex LH-20对甜菜红素进行进一步的纯化。测定甜菜红素的洗脱曲线,洗脱曲线出现了两个波峰,分别是甜菜红素和甜菜黄素。收集不同时间段(每隔5 min)下,洗脱出来的甜菜色素,利用高效液相色谱分析洗脱液的纯度。最后,测定洗脱液中甜菜红素的含量,结果为61.108 mg/g。
3.4 甜菜红素的稳定性实验探究了光、温度、氧气和时间对甜菜红素稳定性的影响,在80℃条件下3 h内甜菜红素的含量就会下降到10%以下,而低温(4℃)能够极大地提高甜菜红素的稳定性,20天内甜菜红素的含量只下降了30%。氧气对甜菜红素的稳定性会有影响,甜菜红素在隔绝氧气的条件下稳定最高,摇晃条件下稳定性最低。

