葡萄酒泥酵母β-葡聚糖及其羧甲基化衍生物体外抗氧化
王 婧 , 程 超 , 盛文军 , 李 敏 , 祝 霞 , 韩舜愈 *
(1.甘肃农业大学 食品科学与工程学院,甘肃 兰州730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州730070;3.甘肃省平凉市食品检验检测中心,甘肃 平凉 744000)
随着我国葡萄酒产业的迅速发展,葡萄酒酿造过程中产生的葡萄酒泥酵母等副产物已成为一种新资源引起人们的高度关注[1-2]。据统计,每生产100 kL葡萄酒约形成2.5~4.0 t的酒泥酵母[3],而位于酵母细胞壁最内层,属于细胞壁结构多糖的酵母β-葡聚糖是目前生物活性较强的一类免疫多糖,具有诸多生物活性功能[4-7]。因此开展葡萄酒泥酵母β-葡聚糖产品的深加工,不仅具有良好的市场前景和潜在利益,而且对于废弃资源循化利用和生态环保也具有十分重要的现实意义。
抗氧化性是评价多糖生物活性的重要指标之一,具有抗氧化活性的多糖在抑制肿瘤、免疫调节、抑制食品腐败变质等方面均有积极贡献[8]。近年来,对自由基及自由基清除剂的研究日趋活跃,开发和利用能够清除自由基的纯天然抗氧化剂也成为科研工作者的研究热点,微生物多糖作为食用自由基清除剂在防止生物氧化损伤方面发挥着重要作用[9]。但由于酵母β-葡聚糖水溶性差,其应用受到限制,羧甲基化修饰改性具有制备过程简单、试剂成本低及生成物无毒等优点,被广泛应用于多糖改性[10]。多项研究表明,酵母β-葡聚糖及其衍生物具有潜在的抗氧化作用,因其具有天然高效无毒等特点,备受国内外学者的关注。
目前研究多集中于酵母β-葡聚糖羧甲基化改性工艺研究,而对改性前后的生物性能(如抗氧化等)对比研究较少。因此,作者以葡萄酒泥酵母为原料,采用诱导自溶、细胞壁破碎、复合酶解等生物技术手段,制备高纯度酵母β-葡聚糖,并对所得产品性质进行分析,而后通过β-葡聚糖及其羧甲基化衍生物(CMP)体外抗氧化活性的对比实验,揭示两者之间抗氧化性能的差异性,以期获得一种高附加值的β-葡聚糖产品,实现经济效益和环保效益的双丰收,并为中国葡萄酒产业升级和循环农业经济发展提供技术支撑。
1 材料与方法
1.1 材料与仪器
葡萄酒废酵母泥:甘肃紫轩酒业有限公司;甘露糖标准品、葡萄糖标准品、ABTS、菲洛嗪:上海源叶生物科技有限公司;DPPH:上海展云化工有限公司;其它试剂,均为分析纯。
Genesis10s紫外可见分光光度计:美国Thermo Scientific公司;FTIR-650傅里叶变换红外光谱仪:中国天津港东科技发展股份有限公司;HH-6数显恒温水浴锅:国华电器有限公司;RE52CS-1旋转蒸发器,上海亚荣生化仪器厂;YDF真空冷冻干燥机:深圳市源洲科技有限公司。
1.2 实验方法
1.2.1 葡萄酒泥酵母β-葡聚糖的制备 收集废葡萄酒泥,加蒸馏水混匀、过筛、洗涤,得到湿酵母细胞,通过诱导酵母自溶、高温浸提去除甘露糖蛋白、高压均质结合冻融法破碎酵母细胞壁、复合酶解技术去除蛋白质和残留脂肪,最终经冷冻干燥得水不溶性β-葡聚糖。
1.2.2 产品β-葡聚糖理化性质分析
1)产品纯度鉴定—紫外光谱分析:取适量样品溶于二甲基亚砜,并以二甲基亚砜为空白对照,在200~400 nm范围内进行紫外吸收光谱扫描[11]。
2)溶解性分析:称取0.2 g样品数份,分别加入到 蒸 馏 水 、1 mol/L HCl、2 mol/L H2SO4、1 mol/L NaOH、无水乙醚、无水乙醇、二甲基亚砜和丙酮中,分别于室温和高温环境下观察其溶解性[12]。
3)颜色反应检测:称取0.2 g样品数份,分别进行苯酚-硫酸反应、菲林反应和碘反应,观察其颜色[13]。
4)产品成分分析:以 V氯仿∶V甲醇=60∶40 为展开剂,将酵母β-葡聚糖样品的水解产物与标准品(葡萄糖和甘露糖)对照进行薄板层析,喷洒苯胺-邻苯二甲酸显色剂后,105℃加热10 min,观察层析效果[13]。
5)产品结构分析:分别取酵母β-葡聚糖样品和标准品各1 mg,加入100~200 mg磨细的干燥KBr,混合均匀后压片,在傅里叶红外光谱仪中进行分析[13]。
1.2.3 葡萄酒泥酵母β-葡聚糖及其羧甲基化衍生物体外抗氧化活性测定
1)羧甲基化酵母 β-葡聚糖(CMP)的制备[14]:称取10 g酵母β-葡聚糖悬浮于有机溶剂异丙醇中,并加入20 mL 1%的NaOH溶液进行碱化反应,在此过程中不断搅拌,而后缓慢加入3.6 g氯乙酸,于50℃搅拌3.5 h。将得到的反应产物用5%HCl中和至pH 7.0,将反应液进行透析,浓缩沉淀,并用95%乙醇洗涤,冷冻干燥,得到羧甲基β-葡聚糖固体。
2)抗氧化测定样品的制备[15]:将分离得到的β-葡聚糖和制备所得CMP采用活性炭脱色法去除色素,经蒸发浓缩、冷冻干燥后配制成质量浓度分别为 0.5、1、1.5、2、2.5、3、3.5 mg/mL 的测定液,并配制与其质量浓度相对应的阳性对照VC和EDTA溶液。
3)·OH清除能力的测定[16]:将 1 mL不同浓度的多糖溶液添加到1 mL 1.5 mmol/L硫酸亚铁、0.7mL 6 mmol/L过氧化氢和0.3 mL 20 mmol/L水杨酸钠混合液中,37℃反应1 h,测定510 nm处吸光度值。按下式计算多糖对·OH清除能力,用VC做阳性对照,实验重复3次。
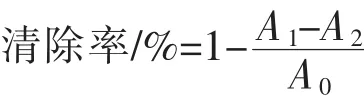
式中,A0为自由基本身的吸光值;A1为多糖存在下的吸光值;A2为只含多糖的吸光值。
4)O2-·清除能力的测定[17]:将 2.98 mL 50 mmol/L Tris-HCl缓冲液 (pH 8.2)、0.01 mL 10 mmol/L HCl和预热的0.01 mL 50 mmol/L邻苯三酚 (10 mmol/L HCl配制)混合并立即摇匀,每隔30秒测定420 nm处吸光度值,计算线性范围内每分钟吸光度值的增加。空白管用10 mmol/L HCl替代邻苯三酚,样品管用0.01 mL样液替代10 mmol/L HCl。按下式计算多糖对O2-·清除率,用VC做阳性对照,实验重复3次。
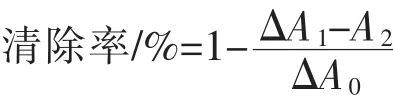
式中,ΔA0为邻苯三酚自氧化速率;ΔA1为加入多糖后邻苯三酚的氧化速率;A2为只含多糖的吸光值。
5)DPPH·清除能力的测定[16]:将 1.5 mL 多糖溶液加至1.5 mL 0.069 mmol/L DPPH溶液(用甲醇配制)中摇匀,室温避光静置1 h,测定517 nm处吸光度值。按下式计算多糖对DPPH·清除率,用VC做阳性对照,实验重复3次。
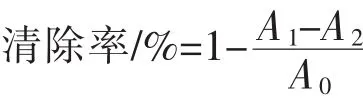
式中,A0为DPPH·和乙醇的吸光值;A1为DPPH·和多糖的吸光值;A2为只含多糖的吸光值。
6)ABTS+·清除能力的测定[18]:将 0.2 mL 7.0 mmol/L ABTS与0.2 mL 2.45 mmol/L过硫酸钾混合,室温避光反应12~16 h,用pH 7.4磷酸缓冲液稀释至 OD734=0.7±0.02,30 ℃下平衡 30 min, 制成ABTS+·工作液。取2.4 mL ABTS+·工作液,加入0.6 mL多糖溶液摇匀,室温静置6 min,测定734 nm处吸光度值。按下式计算多糖ABTS+·清除率,用VC做阳性对照,实验重复3次。
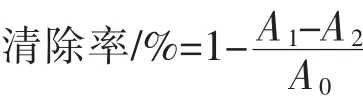
式中,A0为 ABTS+工作液和乙醇的吸光值;A1为ABTS+工作液和多糖的吸光值;A2为只含多糖的吸光值。
7)Fe2+螯合能力的测定[16]:在 0.05 mL 2 mmol/L氯化亚铁中添0.4 mL不同浓度的多糖溶液,并加0.2 mL 5 mmol/L菲洛嗪和3.35 mL乙醇启动反应,保温10 min后,测定562 nm处吸光度值。按下式计算多糖对Fe2+螯合能力,用EDTA做阳性对照,实验重复3次。

式中,A0为不含多糖的吸光值;A1为多糖存在下的吸光值。
8)IC50的计算:IC50表示半数有效浓度,是指清除率达到50%时β-葡聚糖、CMP、VC或EDTA的质量浓度,并采用SPSS软件中Logit回归计算。IC50可以作为评价某物质抗氧化能力的重要参数,如果IC50低于10 mg/mL,表明其抗氧化活性较好[19]。
1.2.4 数据分析 实验所得数据均采用SPSS 18.0软件进行方差分析,并用Excel 2007软件进行相关图表的绘制。
2 结果与分析
2.1 产品β-葡聚糖理化性质分析
2.1.1 产品纯度鉴定—紫外光谱分析 将产品β-葡聚糖溶于二甲基亚砜中,并在200~400 nm波长范围内进行扫描。如图1所示,产品在260 nm和280 nm处均无特征吸收峰出现,说明蛋白质和核酸脱除完全。
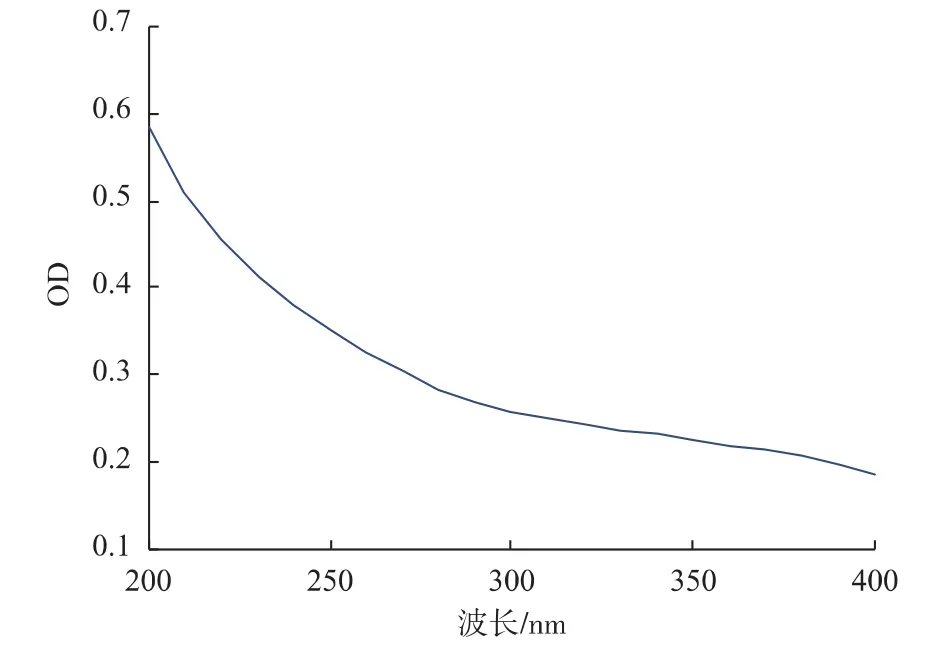
图1 产品的紫外光谱扫描曲线Fig.1 Ultraviolet spectrum scan curve of product
2.1.2 溶解性分析 产品的溶解性分析结果见表1。本实验所得产品是一种耐酸耐碱、不溶于蒸馏水和有机溶剂、但完全溶于二甲基亚砜的物质,上述这些性质与酸不溶碱不溶酵母β-葡聚糖十分吻合。
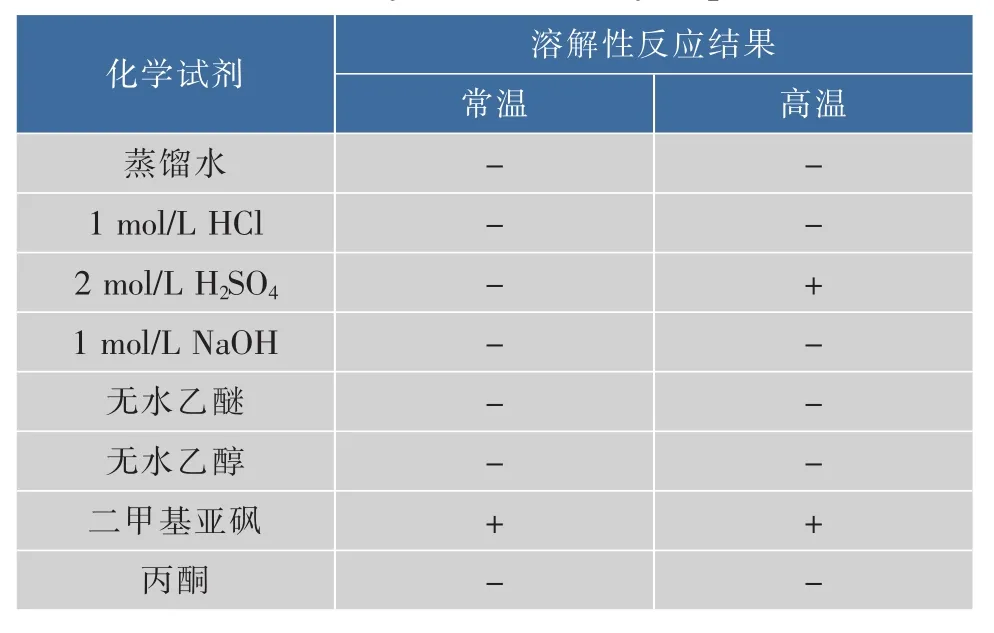
表1 产品溶解性分析Table 1 Analysis on solubility of product
2.1.3 颜色反应检测 产品颜色反应检测在某种程度上可以证明产品中是否存在非目的产物,产品的颜色反应结果见表2。与苯酚-硫酸反应呈阳性,这说明产品是一种多糖物质;与菲林反应呈阴性,说明产品不含还原性糖;与碘反应呈阴性,说明产品不含糖元。
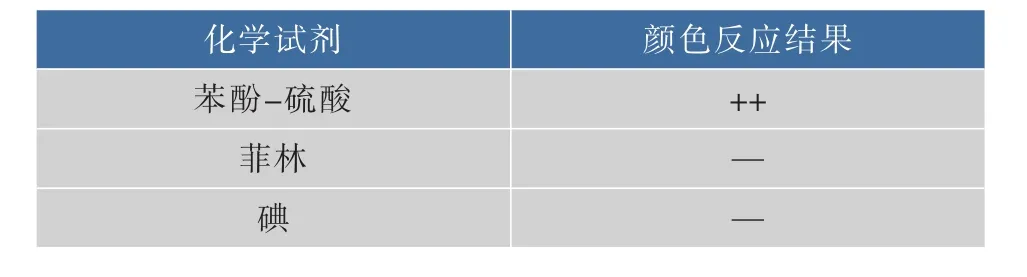
表2 产品颜色反应检测Table 2 Product color reaction test
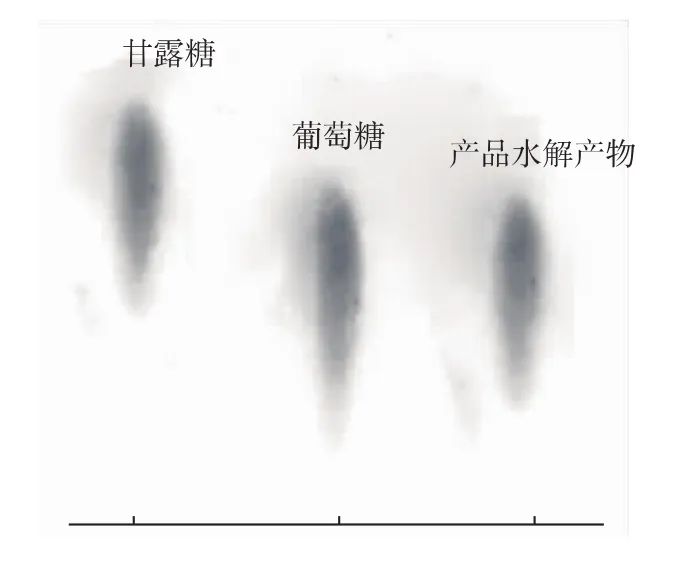
图2 产品的薄层层析图Fig.2 Thin layer chromatography result of product
2.1.4 薄层层析分析 产品β-葡聚糖的薄层层析结果见图2。A和B分别代表标准品甘露糖和葡萄糖的层析斑点,C代表的产品β-葡聚糖水解产物只在与葡萄糖对应的位置显示出相同的层析斑点,表明产品的水解产物为葡萄糖,不含甘露糖,说明产品β-葡聚糖中不含甘露聚糖。
2.1.5 红外光谱分析 在红外光谱图中,每一个吸收峰的出现都能够反映出分子中原子或官能团振动的情况,因此利用红外光谱可以对一些复杂化合物进行定性及定量分析,并且能够检验分子中部分氢键和官能团的存在。
将提取所得β-葡聚糖产品与β-葡聚糖标准品进行红外光谱扫描,扫描结果见图3。β-葡聚糖产品与β-葡聚糖标准品图谱基本相似。在3 600~3 200cm-1处出现糖类化合物C-OH中O-H的伸缩振动带;在3 000~2 800 cm-1处出现的最大吸收峰是发生了C-H的伸缩振动,属于糖类的特征吸收峰;1 400~1 200 cm-1处存在5个特征吸收峰,出现C-H的变角振动,也属于糖类特征吸收峰;1 200~1 000 cm-1处存在2个吸收峰,属于C-O伸缩振动;上述特征峰的出现说明提取所得产品为多糖类化合物。在890 cm-1处特征峰的出现表明产品的糖苷键属于β-构型,是具有β-差向异构构型的吡喃糖聚合物。在1 256、1 374、2 887 cm-1处出现的特征峰与β-葡聚糖标准品基本一致,表明产品是具有β-1,3-糖苷键的葡聚糖。而在810 cm-1附近没有出现吸收峰,证明β-葡聚糖产品中不含甘露糖。
综上,提取所得β-葡聚糖产品的一级结构与β-葡聚糖标准品一致,属于纯度较高的β-1,3-D-葡聚糖。
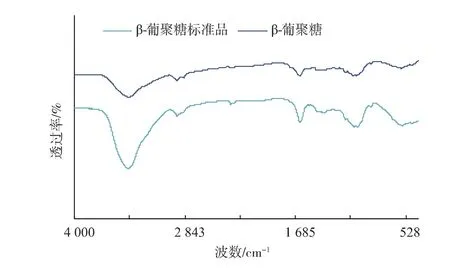
图3 β-葡聚糖产品和标准品的红外光谱图比较Fig.3 Infrared spectrum comparison ofβ-glucan product and standard
2.2 β-葡聚糖及其羧甲基化衍生物体外抗氧化活性测定结果
2.2.1 ·OH清除能力的测定 由图4可以看出,在0~3.5 mg/mL 质量浓度范围内,β-葡聚糖、CMP 和VC对·OH均具有清除能力,并且随着β-葡聚糖、CMP和VC质量浓度的增大,对·OH的清除能力逐渐增强。其中,VC对·OH清除能力最强,1.0 mg/mL VC对·OH清除率已达到98.4%,之后随着质量浓度的增大,对·OH 清除率无显著性差异(p>0.05);而β-葡聚糖和CMP质量浓度与·OH清除率均存在相关性,但CMP对·OH清除率明显高于β-葡聚糖,3.5 mg/mL CMP对·OH清除率达到46.64%,是β-葡聚糖(11.73%)的4倍,两者差异较大。
2.2.2 O2-·清除能力的测定 由图5可以看出,在0~3.5 mg/mL质量浓度范围内,CMP和 VC对 O2-·的清除率呈现先增大后逐渐平稳的趋势,尤其CMP对O2-·清除能力与样品质量浓度存在明显的量效关系,而β-葡聚糖对O2-·的清除率逐渐增加且不同质量浓度之间均存在显著性差异 (p<0.05)。其中,3.0 mg/mL VC对O2-·清除率达到100%,随后无显著性变化 (p>0.05);CMP 在 3.0~3.5 mg/mL 质量浓度范围内无显著性差异(p>0.05),但对 O2-·清除率始终优于β-葡聚糖,3.0 mg/mL CMP对O2-·清除率达到47.22%,是β-葡聚糖(6.98%)的6.7倍,两者差异达到最大,且两者对O2-·的清除率均劣于VC。
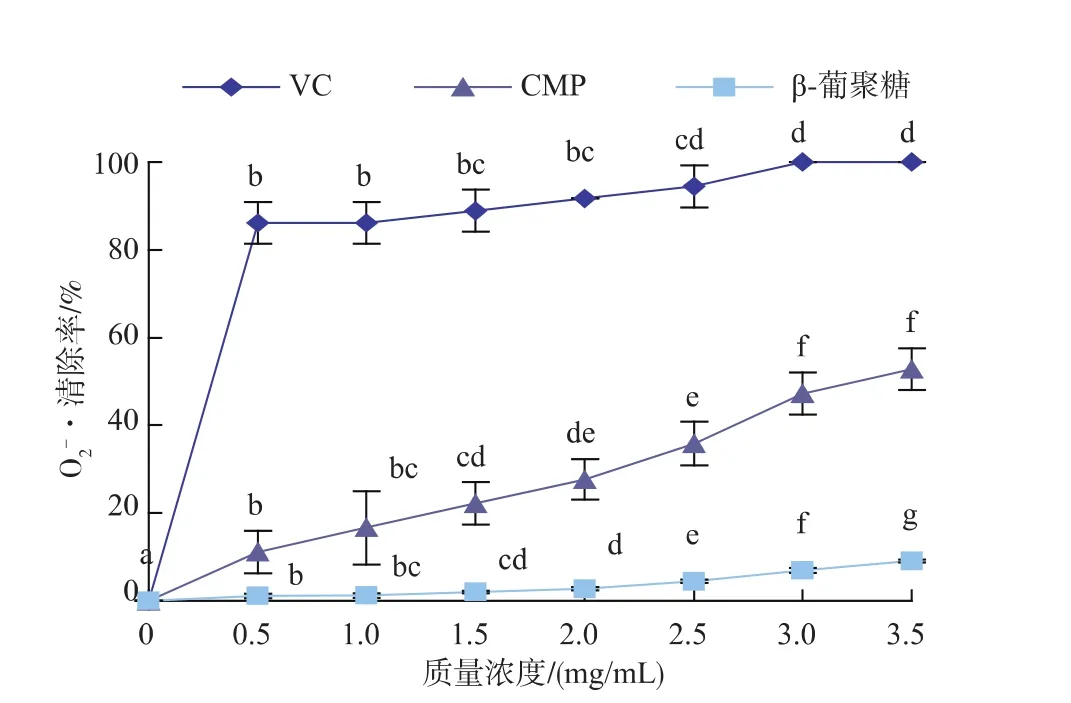
图5 β-葡聚糖、CMP和VC对O2-·清除能力Fig.5 Scavenging effects of β-glucan,CMP and VC on·
2.2.3 DPPH·清除能力的测定 由图6可以看出,β-葡聚糖、CMP和VC对DPPH·均具有清除能力。其中β-葡聚糖和VC对DPPH·的清除率呈现先显著增大后逐渐平稳的趋势,而CMP对DPPH·的清除率呈显著上升趋势,且不同质量浓度之间均存在显著性差异 (p<0.05)。 在 0~3.5 mg/mL范围内,VC对 DPPH·的清除率最优,2.5 mg/mL β-葡聚糖对DPPH·的清除效果较佳,清除率达到9.73%,随后无显著性变化(p>0.05);而 CMP质量浓度和 DPPH·的清除率呈明显的线性相关(R2=0.9975),3.5 mg/mL CMP对DPPH·的清除率为50.6%,是β-葡聚糖(10.5%)的 4.8倍。
2.2.4 ABTS+·清除能力的测定 由图7可以看出,在 0~3.5 mg/mL 范围内,CMP、β-葡聚糖和 VC 对ABTS+·的清除率均呈现先增大后逐渐平稳的趋势。当VC质量浓度为2.0 mg/mL时,对ABTS+·的清除率可达到100%,随后无显著性变化(p>0.05);而当CMP和β-葡聚糖质量浓度为3.0 mg/mL时,ABTS+·清除率分别为53.5%和9.6%,并在3.0~3.5mg/mL范围内无显著性差异(p>0.05),且当CMP和β-葡聚糖质量浓度为3.0 mg/mL时,对ABTS+·的清除率差异达到最大,CMP对ABTS+·的清除率是β-葡聚糖的5.6倍,但两者对ABTS+·的清除效果均劣于VC。
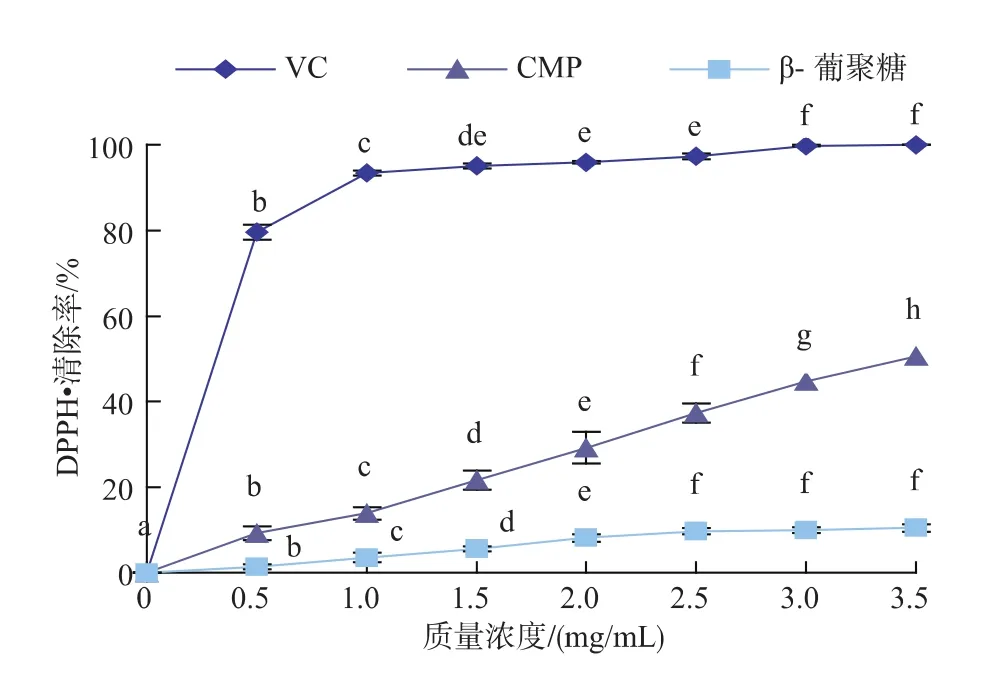
图6 β-葡聚糖、CMP和VC对DPPH·清除能力Fig.6 Scavenging effects of β-glucan,CMP and VC on DPPH·
2.2.5 Fe2+螯合能力的测定 由图8可以看出,在0~3.5 mg/mL范围内,β-葡聚糖和 EDTA对 Fe2+螯合能力呈现先增大后逐渐平稳的趋势,而CMP对Fe2+螯合能力呈显著上升趋势。当EDTA质量浓度为0.5 mg/mL时,对Fe2+螯合能力达到最大,三者中Fe2+螯合效果最佳;β-葡聚糖在质量浓度为2.5 mg/mL时,螯合Fe2+的效果达到最好,Fe2+螯合率为10.9%,随后无显著性变化(p>0.05);当 CMP 在 1.0~1.5 mg/mL范围内对 Fe2+螯合能力无显著影响(p>0.05),而在其它质量浓度下存在显著差异(p<0.05);其中,CMP质量浓度为3.5 mg/mL时,对Fe2+螯合能力达到最大,Fe2+螯合率为37.1%,且对Fe2+螯合能力明显优于β-葡聚糖。
2.2.6 IC50的测定结果 由表3可知,阳性对照VC清除·OH、O2-·、DPPH·、ABTS+·的 IC50 以及阳性对照 EDTA螯合Fe2+的IC50均低于0.5 mg/mL;β-葡聚糖清除·OH、O2-·、DPPH·、ABTS+·和螯合 Fe2+的 IC50均高于 10 mg/mL,其中螯合 Fe2+的IC50最高,达到21.399 mg/mL;CMP 清除·OH、O2-·、DPPH·、ABTS+·和螯合Fe2+的IC50均低于10 mg/mL,且IC50分别是β-葡聚糖的 36.7%、28.6%、27.4%、25.3%和 23.5%,说明CMP的抗氧化活性明显优于β-葡聚糖,但次于阳性对照VC/EDTA。
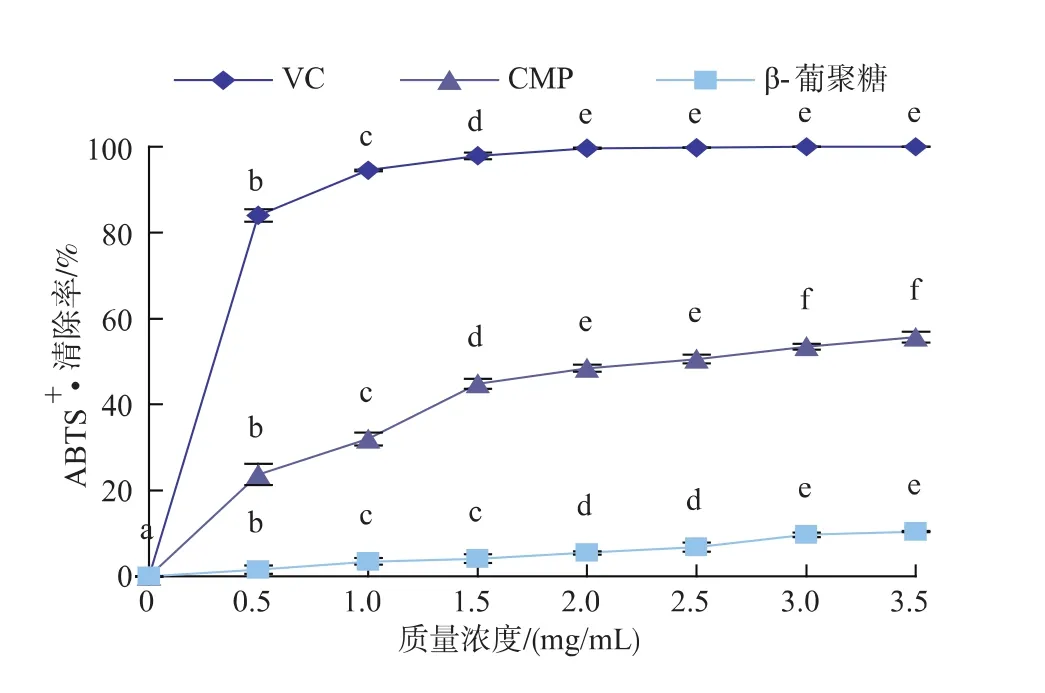
图7 β-葡聚糖、CMP和VC对ABTS+·清除能力Fig.7 Scavenging effects of β -glucan,CMP and VC on ABTS+·
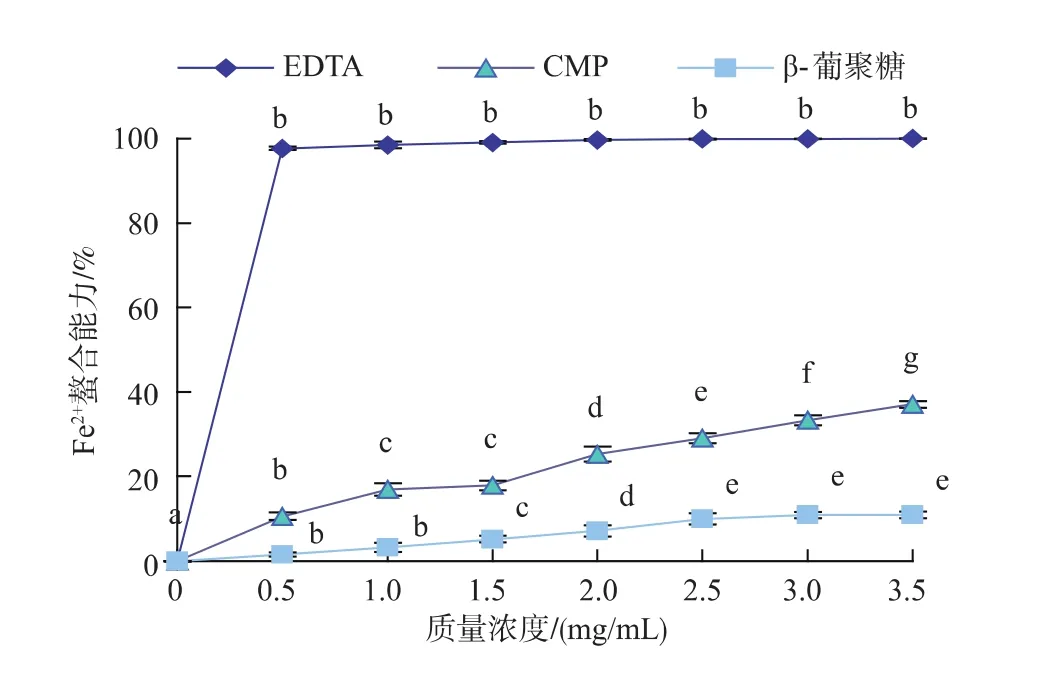
图8 β-葡聚糖、CMP和EDTA对Fe2+螯合能力Fig.8 Scavenging effects of β-glucan,CMP and EDTA on Fe2+
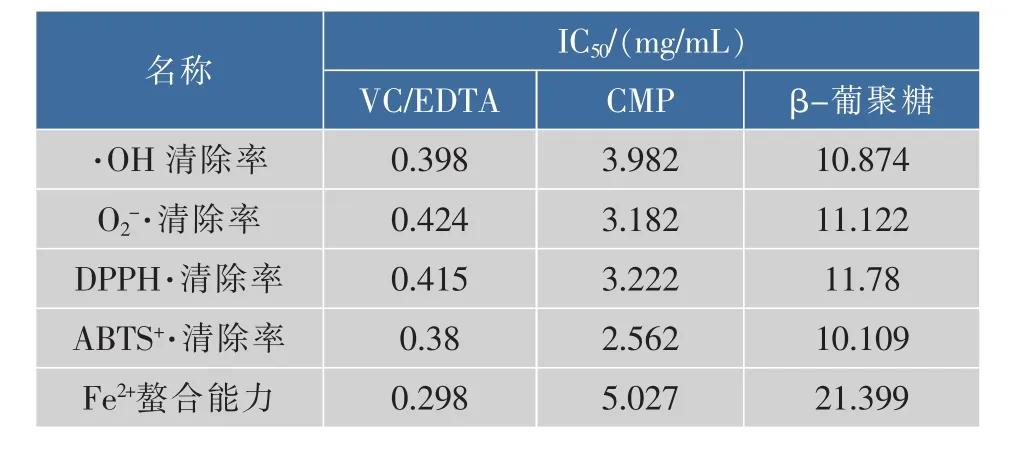
表3 β-葡聚糖、CMP和VC/EDTA的IC50Table 3 IC50of β-glucan,CMP and VC/EDTA
3 讨论
作者对葡萄酒泥酵母β-葡聚糖及CMP体外抗氧化性进行对比分析,分别从清除·OH、O2-·、DPPH·、ABTS+·和螯合Fe2+的能力来评估多糖的抗氧化活性。抗氧化实验结果说明,CMP可有效提高其抗氧化活性,原因可能在于增加了多糖溶解性或改变了多糖空间结构[20],对酵母β-葡聚糖进行羧甲基化修饰能够引入带负电荷的羧基,为多糖构建了一个带负电荷的亲水性表面结构,使其水溶性大大提高,进而增强了其抗氧化活性。Wang等[14]发现当羧甲基取代羟基后能够提供更多的电子,加强清除O2-·的能力,从而提高清除率。Machova等[21]研究发现羧甲基多糖具有较高亲核性,能螯合金属离子,并有降低氢质子产生的能力。Wang等[22]对CMP进行深入研究,发现其作为水溶性多糖能够增强抗肿瘤活性,对预防免疫系统氧化损伤效果显著。有关酵母β-葡聚糖及其羧甲基化衍生物抗氧化活性的研究,目前主要停留在体外实验中,由于体外和体内环境条件存在差异,在体外表现较强抗氧化活性的酵母β-葡聚糖及其衍生物未必在体内实验会表现出较强的活性[9]。因此,在后续的研究中应该同时进行体外和体内抗氧化实验,如此才能对酵母β-葡聚糖及其羧甲基化衍生物抗氧化活性进行全面客观的评估。
4 结 语
通过紫外光谱分析、溶解性分析、颜色反应检测、薄层层析分析和红外光谱分析,本研究制备所得产品为纯度较高的碱不溶性酵母β-葡聚糖;对β-葡聚糖和 CMP 清除·OH、O2-·、DPPH·、ABTS+·和螯合Fe2+能力进行测定,体外抗氧化活性研究结果显示,β-葡聚糖和CMP抗氧化活性均呈浓度相关性,但后者表现出更明显的量效关系,经过羧甲基化改性后的抗氧化能力较之改性前的酵母β-葡聚糖有了非常明显的改善,其抗氧化能力得到显著提升。

