碱催化苯甲酸酯类增塑剂合成研究
曹凌峰 傅罗平 季铭建 章悦康 姜国平
(浙江合糖科技有限公司,金华,321016)
脂肪族多元醇苯甲酸酯增塑剂是一个品种繁多,使用广泛,性能突出的增塑剂类型,在较多场合是DOP的理想替代品。关于苯甲酸酯增塑剂合成已有大量报道,其中最具工业化价值的是直接酯化法。直接酯化法通常以多元醇、苯甲酸为原料,在催化剂存在下,回流分水,推动平衡移动,促使反应进行完全。早期使用的催化剂主要为硫酸等质子酸。硫酸为催化剂具有反应温度低 、催化活性高等特点[1]。但是硫酸对设备腐蚀大,且聚合、分解等副反应严重、生成色素杂质较多。为克服上述缺点,采用固体酸代替质子酸为催化剂。所用的固体酸包括:固载磷钨酸催化剂[2];强酸型离子交换树脂催化剂[3];玻璃珠固载超强酸硫酸/二氧化钛催化剂[4];钛酸酯类催化剂包括固载钛酸四乙酯[5]、钛酸四丁酯[6]等。上述催化剂在设备腐蚀方面不同程度上克服了硫酸为催化剂的弊端。但固载催化剂需特殊制备,成本较高,不利于推广使用。且多元醇自身聚合、分解等副反应并无明显改善,后处理过程中仍需采取脱色、精馏、结晶等精制工序方可得到合格产品。
聚甘油与硬脂酸反应制聚甘油硬脂酸酯常采用碱性催化剂,效果良好[7]。山梨醇也可在碱催化下与油酸反应制备失水山梨醇油酸酯,结果符合碱性条件下醇易酯化难成醚的特性[8]。受此启发,将碱性催化剂用于多元醇苯甲酸酯增塑剂的合成,可以克服酸性催化剂带来的弊端。该方法的优点:催化剂来源广泛,价格低廉,无需特殊制备;多元醇自身聚合、分解等副反应少;产品纯度高、色度好;设备耐酸要求低;后处理过程简单易行;苯甲酸可回收套用等。是一种适合工业化生产多元醇苯甲酸酯的方法。
反应式见式(1)。

1 实验部分
1.1 试剂与仪器
二丙二醇、丙三醇、季戊四醇、氢氧化锂、氢氧化钾、氢氧化钠、氢氧化钙、氢氧化镁等均为化学纯;甲苯、二甲苯、正辛烷等均为工业级。
HPLC,Waters 515 HPLC Pump,Waters2414示差检测器,美国Waters公司;色谱柱TSKgel G2000H,日本TOSOH公司;NEX-US670型傅立叶变换红外光谱仪(KBr压片),美国NICOLET公司;AV600型核磁共振波谱仪 (DCCl3为溶剂,TMS为内标),德国BRUKER公司;液质联用LC-30A型UPLC仪,日本岛津公司;TripleTOF4600质谱仪,美国AB Sciex公司。
1.2 酯化反应
甘油三苯甲酸酯(GTB)合成:于装有回流分水器的250 mL三颈瓶中加入18.4 g丙三醇、76.8 g苯甲酸、100 mL二甲苯兼做溶剂与带水剂、0.76 g氢氧化钾,升温至210~220℃,通过体系中溶剂量来调节回流带水和反应的温度。约反应3 h,基本无水蒸出,取样以HPLC监测反应终点,中间产物在0.5%以下时停止反应。保温反应毕。冷却至100~110℃,加入200 mL溶剂,溶解澄清。用10%碳酸钠水溶液水洗3次,每次20 mL。再水洗至中性。减压蒸干溶剂后得浅黄色透明粘稠状液体,冷却后为白色固体。收率98.1%,HPLC含量99.6%,熔点 70.1~70.5℃。
采用类似方法,可制得其他多元醇苯甲酸酯。二丙二醇二苯甲酸酯(DPGDB):浅黄色透明粘稠状液体,收率97.7%,HPLC含量99.1%。季戊四醇四苯甲酸酯(PETB):白色固体,收率99.1%,HPLC含量99.3%,熔点99.1~99.6℃。
2 结果与讨论
2.1 催化剂种类的选择
首先对催化剂种类进行筛选,参照文献方法,分别采用硫酸、不加催化剂及碱为催化剂进行实验,考察不同催化剂对多元醇苯甲酸酯化反应的影响,初步选定催化剂类型。结果如表1所示。
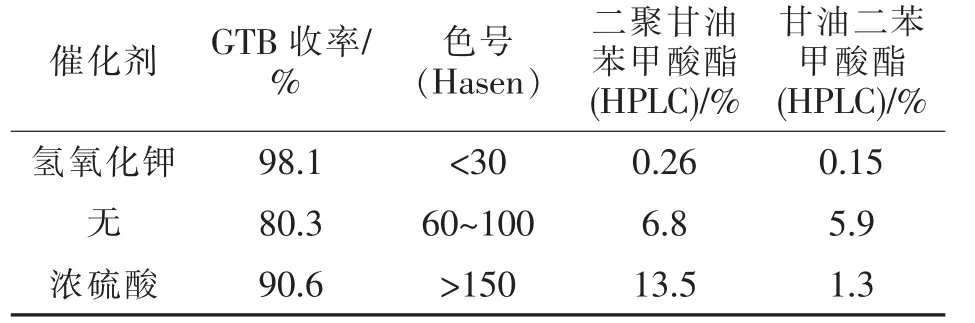
表1 催化剂种类对酯化反应的影响Tab.1 Effect of different kinds of catalysts on esterification
由表1可知,采用氢氧化钾为催化剂收率最高,反应进行完全,产品颜色较好,甘油自身聚合等副反应较少。在无催化剂条件下,反应也可进行,但残留较多甘油单苯甲酸酯,甘油自身聚合反应增加,产品颜色也明显加深。以硫酸为催化剂时,尽管反应温度较低,但甘油自身聚合明显,色素杂质较多,产品色度>150 Hasen。由以上实验事实推测,多元醇与苯甲酸可在碱催化条件下进行酯化反应且获得较好结果。
在初步选定碱性催化剂的基础上,进一步对各种碱的催化作用进行了考察。按1.2节进行实验,以0.2 mol多元醇为原料,苯甲酸量为多元醇羟基物质的量的1.05倍,催化剂的加入量为苯甲酸质量的1.0%,二甲苯为溶剂兼带水剂,210~220℃回流脱水反应至基本无水蒸出。各种碱的催化效果如表2所示。
由表2可知,采用碱性催化剂可取得较好收率,其中氢氧化钾为催化剂时收率最高。碱加入体系后,与苯甲酸反应生成苯甲酸盐溶于体系,在反应温度下呈均相。随反应进行,体系中多元醇逐步转变为多元醇苯甲酸酯,体系极性降低,反应后期有固体析出。与其他苯甲酸盐相比,苯甲酸钾在体系中相容性好,析出时间更晚,体系搅拌效果好,能更好起到催化效果。
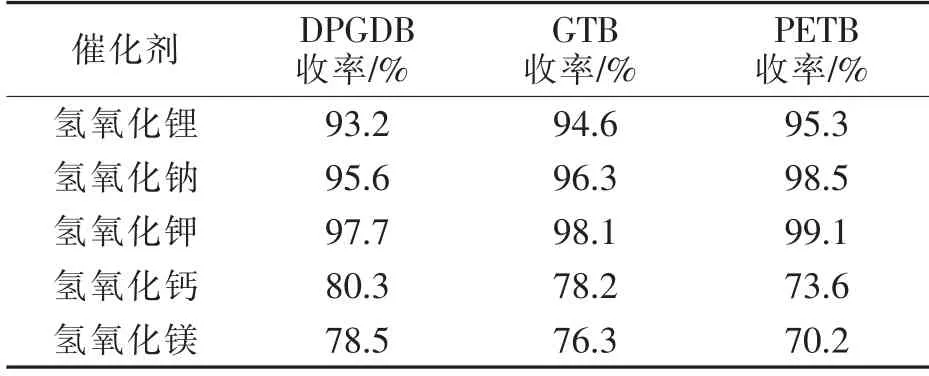
表2 不同碱催化剂对收率的影响Tab.2 Effect of different kinds of base catalysts on yields
2.2 氢氧化钾的用量
在选定氢氧化钾为催化剂的基础上,对催化剂用量(占苯甲酸质量分数)进行了考察,结果如表3所示。
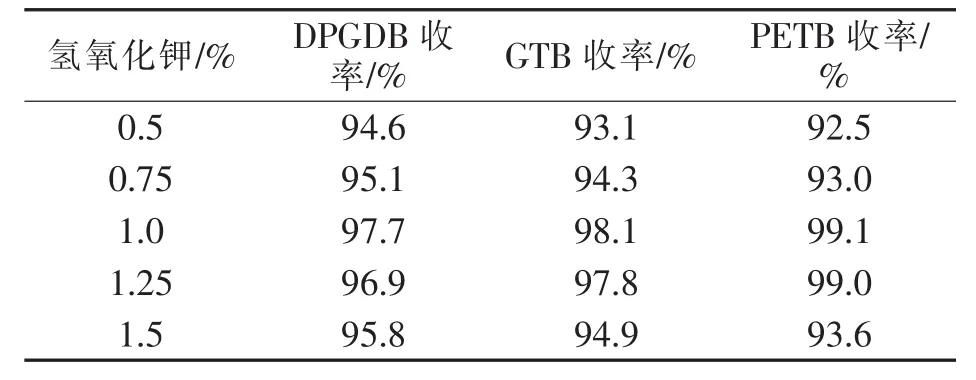
表3 氢氧化钾用量对收率影响Tab.3 Effect of amounts of potassium hydroxide(KOH)on yields
由表3可知,氢氧化钾用量为苯甲酸的1%时较为合适。偏低时,反应速度慢,且抑制多元醇聚合、分解副反应作用不明显。偏高时,虽然前期反应速度加快,但是固体析出提早,影响搅拌效果,最终导致收率降低。
2.3 溶剂兼带水剂的选择
按1.2节进行实验,以0.2 mol多元醇为原料,苯甲酸量为多元醇羟基物质的量的1.05倍,催化剂氢氧化钾的加入量为苯甲酸质量的1.0%,100 mL溶剂兼带水剂,210~220℃回流脱水反应至基本无水蒸出。考察不同带水剂对各多元醇苯甲酸酯化反应的影响,结果见表4。

表4 溶剂对收率的影响Tab.4 Effect of different solvents on yields
由表4可知,二甲苯为带水剂较为合适。在本反应中,带水剂将反应生成的水及时移出体系是推动平衡移动,使反应进行完全的关键之一。优良的带水剂应具有使体系溶解完全、反应温度适当、带水能力强等特点。二甲苯对多元醇、苯甲酸、苯甲酸钾溶解性能较好,反应前期体系澄清,固体析出阶段较晚;沸点较高,在反应温度下体系仍保一定量的二甲苯,有利于体系搅拌并有较大回流量,且共沸时水占比高达37.5%,有利于将反应生成的水及时带出体系。甲苯性能与二甲苯类似,但沸点稍低,共沸组分中水约含19.6%,反应温度下体系中溶剂偏少,不利于反应进行。正辛烷极性较小,对底物溶解能力低,反应过程中甚至可以观察到有苯甲酸升华后凝结在回流冷凝管的现象,最终收率明显降低。
2.4 反应温度的影响
按1.2节进行实验,以0.2 mol多元醇为原料,苯甲酸量为多元醇羟基物质的量的1.05倍,催化剂氢氧化钾的加入量为苯甲酸质量的1.0%,100 mL二甲苯为带水剂,回流脱水反应至基本无水蒸出,通过调节体系中二甲苯量来改变体系反应温度。考察温度对各多元醇苯甲酸酯化反应的影响,结果见表5。
多元醇苯甲酸酯化是分步进行的,一般反应活性最高的是伯羟基。随着反应进行,部分酯化后,剩余羟基的位阻增加、反应活性降低,须提高反应温度促使底物酯化完全。升温反应过程中可观察到,约170~180℃即有约1当量的水被回流带出,随后带水速度逐渐减慢。升高温度至210~220℃后,反应继续进行直至带出约理论水量。有文献报道[5],反应过程中易将多元醇等反应物料带出。采用分步升温反应的方式,170~180℃保温反应使其部分酯化后,可明显提高底物沸点,再升温至210~220℃继续保温反应,可较好解决带料问题。温度偏低时,酯化反应不完全;偏高后体系颜色加深,210~220℃较为适宜。

表5 反应温度对收率的影响Tab.5 Effect of reaction temperatures on yields
2.5 反应投料配比的影响
按1.2节进行实验,以0.2 mol多元醇为原料,调整苯甲酸与多元醇配比,催化剂氢氧化钾的加入量为苯甲酸质量的1.0%,100 mL二甲苯为带水剂,210~220℃回流脱水反应至基本无水蒸出。考察苯甲酸用量对酯化反应的影响,结果见表6。
由表6可知,提高苯甲酸用量可提高反应收率,但当 n(苯甲酸∶n(羟基)=1.05∶1.0 后,进一步提高物质的量之比,收率增加不明显。且过量的苯甲酸会加重后处理负担,因此n(苯甲酸)∶n(羟基)=1.05∶1.0 较为适宜。
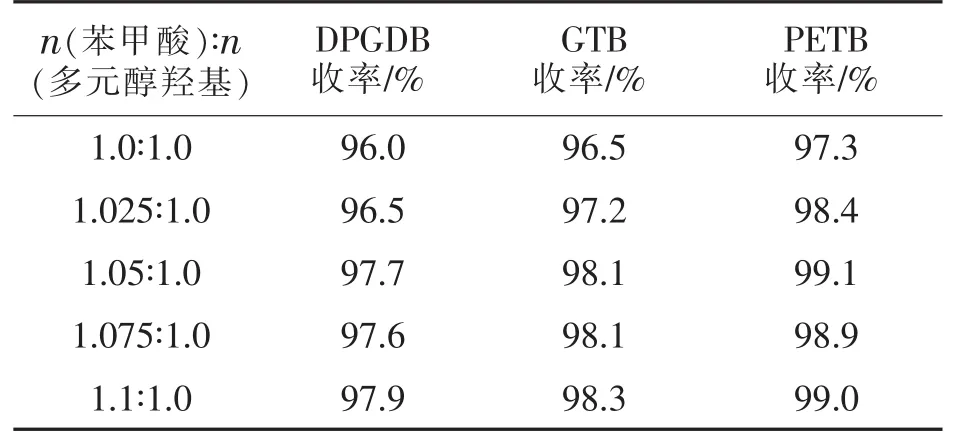
表6 反应配方对收率的影响Tab.6 Effect of ratios of benzoic acid to polyol on yields
2.6 反应机理分析
多元醇在碱性条件下也可发生醚化反应,得到自身失水聚合产物,反应温度通常较高。如甘油在氢氧化钾催化下自身缩合得到聚甘油酯需在240℃以上方可有效进行,在260℃左右反应较快。酯化反应温度则低得多,不改变催化剂,直接加入硬脂酸,在160℃即可进行酯化反应[9]。类似的,多元醇、苯甲酸、碱和带水剂体系中,也是多元醇自身缩合与多元醇苯甲酸酯化的竞争反应。因反应温度较低,且苯甲酸在反应初始即大量存在,故以酯化反应为主。
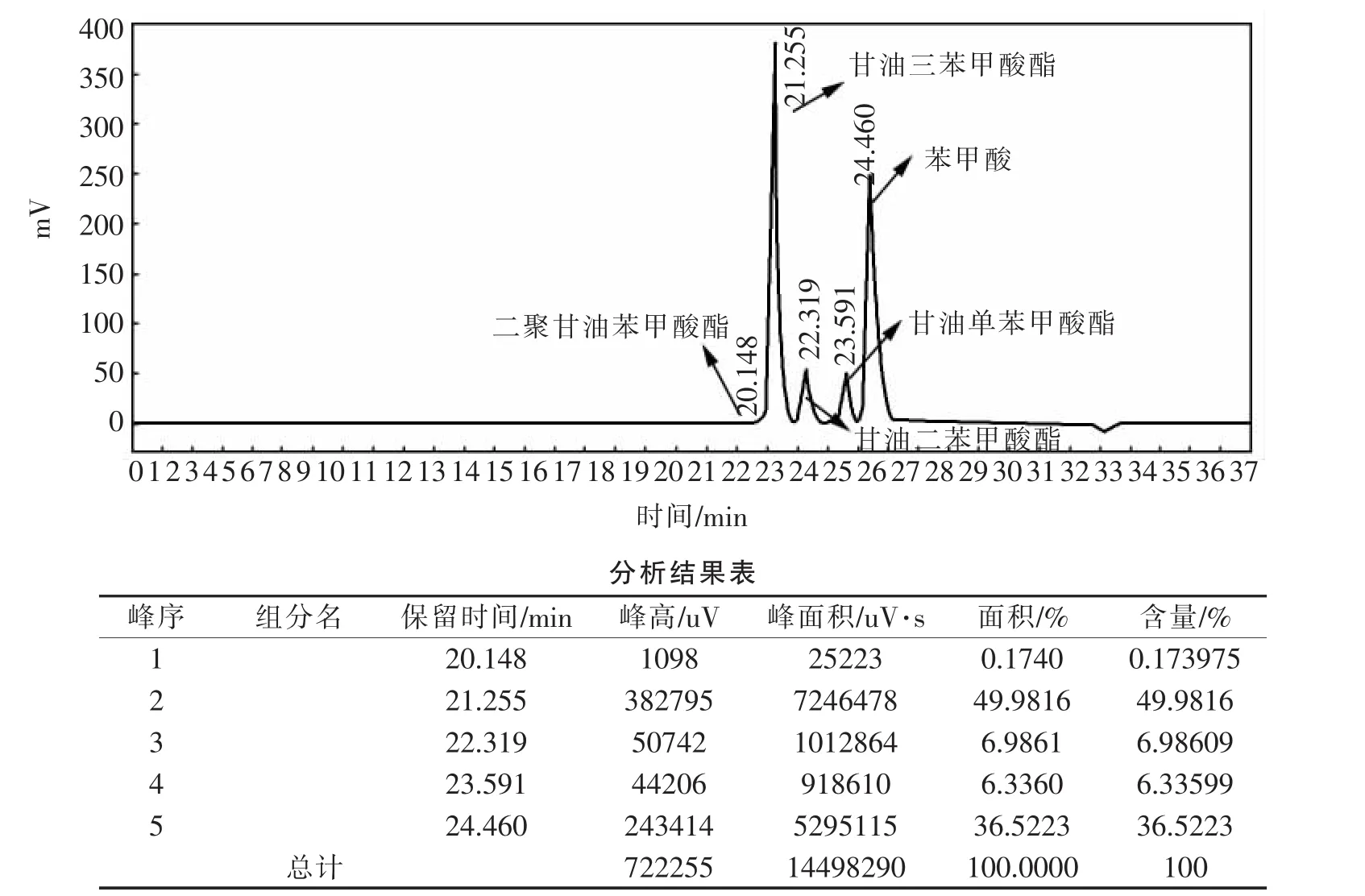
图1 GTB合成反应过程液相图谱①Fig.1 HPLC spectrum of GTB synthesis process①

图2 反应过程液相图谱②Fig.2 HPLC spectrum of GTB synthesis process②

图3 反应过程液相图谱Fig.3 HPLC spectrum of GTB synthesis process③
图1~图3为甘油在氢氧化钾催化下与苯甲酸反应过程用HPLC监测所得图谱。清楚表明,甘油三苯甲酸酯合成为多步反应。随反应进行,甘油单、二苯甲酸酯逐渐减少,甘油三苯甲酸酯逐渐增加,直至反应完全。反应过程中,甘油自身聚合被抑制,二聚甘油苯甲酸酯含量约0.26%。经后处理,由图4可知,GTB产品含量99.6%。
由于多元醇上有多个羟基,伯羟基活性最高,优先被酯化反应。酯化反应与水解反互为可逆反应,因水被带水剂从体系中移除,故反应向酯化反向移动,直至羟基被酯化完全。以甘油三苯甲酸酯合成为例说明酯化反应过程,见式(2)~式(8)。
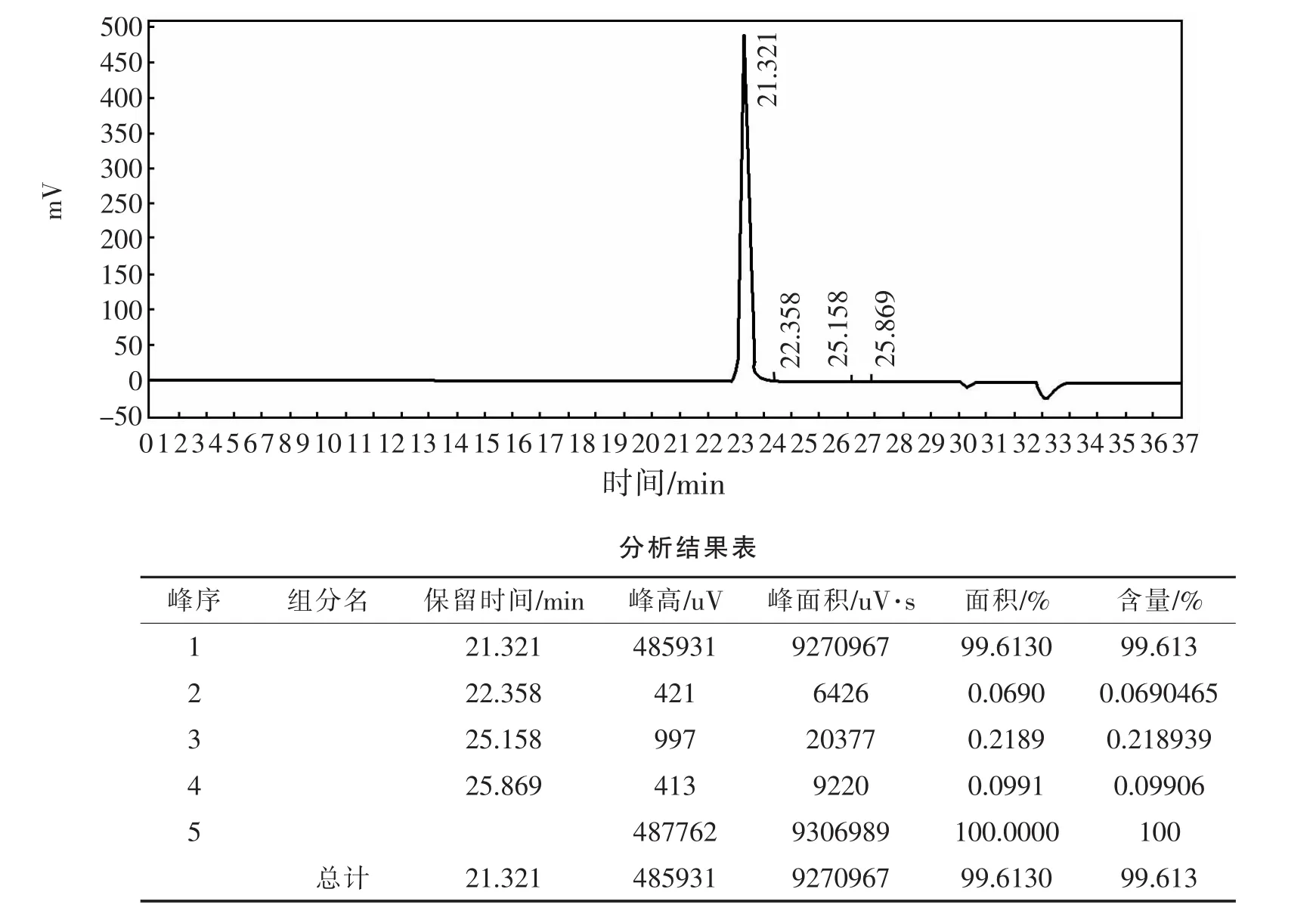
图4 GTB成品液相图谱Fig.4 HPLC spectrum of GTB as product


2.7 适用性评价
本文所选取的二丙二醇、丙三醇、季戊四醇为反应底物进行考察,优化反应条件,具有一定代表性。从原料角度,二丙二醇、丙三醇在常温下为液体,季戊四醇为固体;分别为二醇、三醇和四醇,酯化反应难度有一定差异。产物方面DPFDB为液体,GTB、PETB为固体。经优化,上述底物以氢氧化钾为催化剂的碱催化苯甲酸酯化反应均取得较好效果,反应适应性良好。
2.8 产物表征
2.8.1 红外光谱分析
图5~图7分别为 DPGDB、GTB、PETB的红外光谱图。
由图 5可以看出:3063、3031 cm-1为苯环上C—H的伸缩振动峰;1491、1451 cm-1为苯环碳骨架C—C伸缩振动吸收峰;711 cm-1为苯环上C—H弯曲振动吸收峰;1719处出现苯甲酸酯中C=O伸缩振动吸收峰,1155 cm-1处出现酯类C-O伸缩振动吸收峰,上述吸收峰的出现证明苯甲酸酯官能团的存在。2979、2876及1491 cm-1为亚甲基伸缩振动吸收峰;1451 cm-1处出现了甲基伸缩振动吸收峰;1113 cm-1处出现了饱和醚键C-O-C的伸缩振动吸收峰,这说明所测化合物存在醚键。初步表明与产物DPGDB结构相符。3450 cm-1为KBr压片中微量水O—H的伸缩振动吸收峰。

图5 DPGDB的红外光谱图Fig.5 IR spectrum of DPGDB
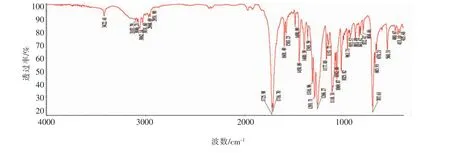
图6 GTB的红外光谱图Fig.6 IR spectrum of GTB
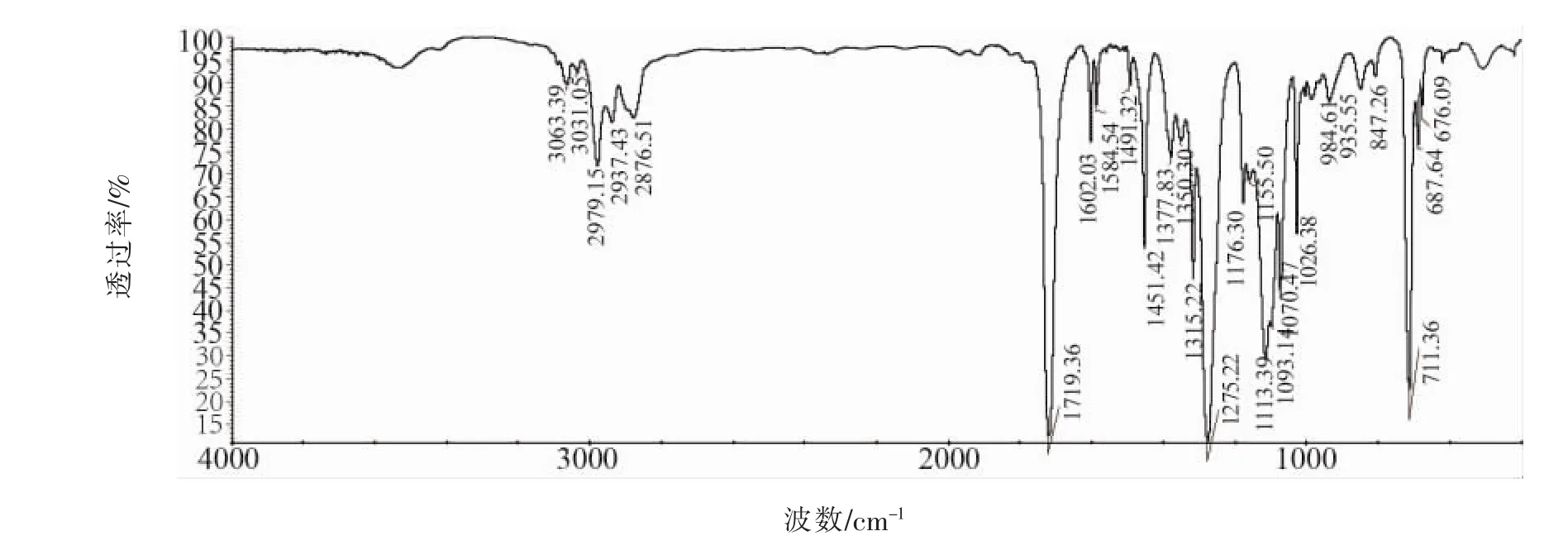
图7 PETB的红外光谱图Fig.7 IR spectrum of PETB
由图 6 可以看出:3086、3062、3031 cm-1为苯环上C—H的伸缩振动峰,1490,1450 cm-1为苯环碳骨架C—C伸缩振动吸收峰;707 cm-1为苯环上C—H弯曲振动吸收峰;1725,1716 cm-1处出现苯甲酸酯中C=O伸缩振动吸收峰,1153 cm-1处出现酯类C-O伸缩振动吸收峰,上述吸收峰的出现证明苯甲酸酯官能团的存在。2968、2951及1491 cm-1为亚甲基伸缩振动吸收峰。初步表明与产物GTB结构相符。3122 cm-1为残留未反应的多元醇羟基O—H的伸缩振动吸收峰,与成品HPLC图谱中含有少量中间产物一致。
由图 7可以看出:3067、3036 cm-1为苯环上C—H的伸缩振动峰;1492、1451 cm-1为苯环碳骨架C—C伸缩振动吸收峰;705 cm-1为苯环上C—H弯曲振动吸收峰;1716处出现苯甲酸酯中C=O伸缩振动吸收峰,1178 cm-1处出现酯类C-O伸缩振动吸收峰,上述吸收峰的出现证明苯甲酸酯官能团的存在。2965、2904及1492 cm-1为亚甲基伸缩振动吸收峰。初步表明与产物PETB结构相符。3430 cm-1处呈宽峰且含有尖峰精细结构,可能为KBr压片中微量水O—H的伸缩振动吸收峰和残留未反应的多元醇羟基O—H的伸缩振动吸收峰形成的复合峰。
2.8.2 核磁共振氢谱与质谱分析
将 DPGDB、GTB、PETB分别进行了1HNMR与UPLC-MS检测。1HNMR以DCCl3为溶剂,TMS为内标。结果如下所示:
DPGDB:1HNMR (600 MHz,Chloroform-d) δ 8.14~7.91 (m,4H),7.63~7.50 (m,2H),7.51~7.25(m,4H),4.50~4.25 (m,2H),4.12~3.22(m,4H),1.50~1.03(m,6H).UPLC-MS,m/Z:(M+H+),实测值343.38,理论值,342.39。
GTB:1H NMR(600 MHz,Chloroform-d)δ 8.08(ddd,J=15.5,8.3,1.4 Hz,6H),7.71~7.53(m,3H),7.56~7.39(m,6H),5.98~5.73(m,1H),4.92~4.66(m,4H).UPLC-MS,m/Z:(M+H+), 实测值 405.41,理论值,405.41。
PETB:1H NMR (600 MHz,Chloroform-d) δ 8.05~7.94(m,8H),7.55(tt,J=7.4,1.3 Hz,4H),7.45~7.35(m,8H),4.71(s,8H).UPLC-MS,m/Z:(M+H+),实测值,553.56,理论值,553.57。
DPGDB的1HNMR在δ8.14~7.25处出现多重峰,共10H,可归属为苯甲酰基苯环上的H。受苯甲酸酯基作用,次甲基H化学位移移向低场,为δ4.60~4.25,共2H。受氧的作用,亚甲基H化学位移移向低场,为 δ 4.12~3.22,共 4H。 δ 1.50~1.03,共6H,可归属为两个甲基上的H。以此可推断二丙二醇被二苯甲酸酯化。GTB的1HNMR在δ 8.08~7.39处出现多重峰,共15H,可归属为苯甲酰基苯环上的H。受三个苯甲酸酯基共同作用,次甲基H化学位移移向低场,为δ5.98~5.73,共1H,同理亚甲基H化学位移移向低场,为δ4.92~4.66,共4H。以此可推断丙三醇被三苯甲酸酯化。PETB的1HNMR在 δ8.05~7.35处出现多重峰,共20H,可归属为苯甲酰基苯环上的H。 δ4.71出现单峰,共8H,归属为4个亚甲基上的H。以此可推断季戊四醇被四苯甲酸酯化。UPLC-MS结果与目标产物相对分子质量一致。
综合以上谱图分析结果,证明产物的分子结构与目标产物的分子结构一致。
3 结论
(1)以二甲苯为溶剂兼带水剂,氢氧化钾为催化剂,n(苯甲酸)∶n(多元醇羟基)=1.05∶1.00,210~220℃保温回流分水至基本无水蒸出,液相监测中间产物小于0.5%,各多元醇苯甲酸酯化反应可进行完全,收率 97.7%~99.1%。 经 FTIR、1HNMR、UPLC-MASS对各产物结构进行表征,证实合成了目标产物。
(2)与酸性催化剂相比,使用碱催化反应产物颜色、多元醇聚合、分解副产物生成、后处理简化等方面均有明显改善。是一条可用于工业化生产多元醇苯甲酸酯类增塑剂的工艺路线。
(3)反应适应范围较广,多元醇及产物为液体、固体时均可采用,且均获得较高收率。

