茅苍术规模化组培快繁体系的建立
宋 刚,徐 银,史 俊,谢正林
(江苏农林职业技术学院,江苏 句容 212400)
茅苍术[Atractylodeslancea(Thunb.) DC.],又名南苍术、茅术、京苍术,是菊科苍术属多年生草本植物,地下根状茎经炮制作苍术入药。茅苍术在中国分布广泛,主产于江苏、浙江、山东、江西、广东、安徽、湖北、四川等地区[1-2]。江苏茅山地区是茅苍术道地药材的中心产区,品质优良的茅苍术根茎断面有黄白色或灰白色和棕红色油腺,习称“朱砂点”[3]。在传统用药中,茅苍术挥发油部分是主要药用成分,主要包括β-桉叶醇、茅术醇、苍术素、苍术酮等,药理药性研究表明茅苍术具有胃肠促进、抗缺氧、抗血糖、抗菌、抑制癌细胞增殖等作用[4]。体外细胞试验表明,茅苍术还具有一定的抗HIV病毒的活性[5]。除药用外,茅苍术还可用作各种饮料的添加剂和加工工艺品香包[6]。传统生产可以利用茅苍术种子和根茎进行繁殖,但存在种子生命力较差、繁殖系数较低;根茎繁殖时根茎需求量大、品质易退化等弊端。通过组培快繁技术能在短期内获得大量优质无菌苗,满足生产种苗需求。还能与生物技术育种结合选育高产优质的新品种,开辟新的药用资源,并对缓解供需矛盾,保护野生茅苍术资源具有重要的意义。对茅苍术组培快繁技术的研究已有报道[6-8],所用外植体包括根茎侧芽、胚根、胚轴、子叶、叶柄、叶片,通过直接诱导丛生芽和先诱导愈伤再分化成丛生芽再生途径实现再生。在配方研究方面,李文等[9]采用正交设计筛选了南苍术最佳增殖和生根培养基配方及试管苗移栽基质配方。王红娟等[10]通过均匀设计对茅苍术增殖和生根培养基进行了优化,并比较了不同移栽基质的效果。
前人研究中试验组合数偏少,研究目的偏向于再生体系建立,适合规模化工厂化生产的技术体系并未明确。本研究采用全面试验组合,旨在筛选适合生产用的高效增殖和生根培养基、同时对茅苍术组培苗多次继代,阐明其丛芽增殖变化规律,为实现茅苍术种苗工厂化生产奠定基础。
1 材料与方法
1.1 试验材料
茅苍术植株2011年11月采集自句容茅山,经江苏省中医院主任中药师宋金斌鉴定为野生茅苍术;将其移栽于江苏农林职业技术学院植物园。收集茅苍术种子,经无菌播种[11]培养成无菌苗(图1-A);选取叶色浓绿、植株粗壮的无菌苗作为试验材料。
1.2 试验方法
1.2.1 增殖培养 接种前于超净工作台上剪去茅苍术无菌苗叶片、根系,将胚轴形成的芽苗切割成单芽,接入不同芽增殖培养基,每瓶接1个单芽,每处理接6瓶,重复3次。培养6周后统计芽增殖系数。
1.2.2 生根培养 取株高达到5 cm以上,叶片挺拔、叶色浓绿的单株健壮的幼苗,接种至不同生根培养基,每瓶接1株,每处理接6瓶,重复3次。培养3周后调查统计生根率、平均生根数、根系长势情况。
1.2.3 驯化与移栽 挑选叶片数多于8片、不定根数多于15、苗高超过6 cm的壮苗,拧松瓶盖先在温室放置2 d,随后在温室自然光下锻炼1周,移栽前打开瓶盖,倒入少量水保持植株不萎缩。取出试管苗注意不要伤到根,洗净培养基后定植于72孔穴盘,2周后调查其移栽成活率。
1.2.4 培养基与培养条件 按表1所示,设计了16种增殖培养基和8种生根培养基。所有培养基均分装在组培瓶中,于122 ℃条件下灭菌20 min。培养时培养室温度控制在(25±2) ℃,日光灯光照强度2000~2500 lx,时间12 h/d[12-13]。

表1 培养基配方设计
1.2.5 数据统计与分析 按下列公式计算各指标:
增殖系数=增殖丛生芽数/接种瓶数
生根率=(生根苗数/接种瓶数)×100%
平均生根数=总生根数/接种瓶数
移栽成活率=(移栽成活苗数/移栽总苗数)×100%
利用Excel 2007和SPSS 20.0对统计的数据进行分析,多重比较采用Duncan’s检验法。
2 结果与分析
2.1 不同植物生长调节剂对不定芽增殖的影响
单芽接入培养基中,约1周可见新芽出现,陆续长出新叶。随后有更多丛生芽产生,最后形成丛苗(图1-B)。如表2所示,除了6、8、12、13、14、15号这6种培养基未能诱导增殖出丛生芽,其余9种培养基均能诱导分化形成数量不等的丛生芽,其中3号培养基丛生芽增殖系数达到15,为所有培养基中最高,并与其他处理间差异显著(P<0.05)。
添加4.0 mg/L 6-BA的培养基,虽然分别与4种不同浓度NAA搭配组合,但各组合都未有丛芽分化形成,说明在培养基中过高浓度的6-BA会抑制茅苍术单芽分化形成丛芽,相对较低浓度的6-BA与NAA组合能够诱导出丛生芽。而在形成丛芽的培养基当中,添加了1.0 mg/L的和部分2.0 mg/L 6-BA的培养基有少量同时诱导产生了愈伤组织,这些愈伤组织呈绿色到棕色,位于丛芽基部胚轴位置,随着丛芽增多而增大。愈伤组织的产生并未明显影响到丛生芽的分化。
对各培养基中丛苗长势进行比较发现,1~4号培养基中丛苗比较健壮,而其他培养基中丛苗长势偏弱,叶色偏浅,部分甚至发黄。
2.2 不同继代次数对丛苗增殖的影响
将3号培养基增殖的丛苗分成单芽(图1-C)继代培养于相同培养基,每隔4周继代一次,连续继代8次。每代调查每瓶平均叶片数、平均苗高和增殖系数,并描述芽苗生长状况。结果如表3所示,8代继代苗每瓶苗平均叶片数在34~43之间。平均苗高在5.95~6.33 cm之间,各代间差异不显著。增殖系数前3代与后5代差异显著(P<0.05);从第4代开始增殖系数趋于稳定,到第6代达最高值12.33。在增殖苗长势方面,1~5代苗的生长状况正常,叶形挺拔、叶色浓绿、株型匀称规则;从第6代起出现少部分苗长势偏弱,有叶萎缩卷曲、叶色偏淡转黄现象,但没有白化、玻璃化、黄化苗出现。
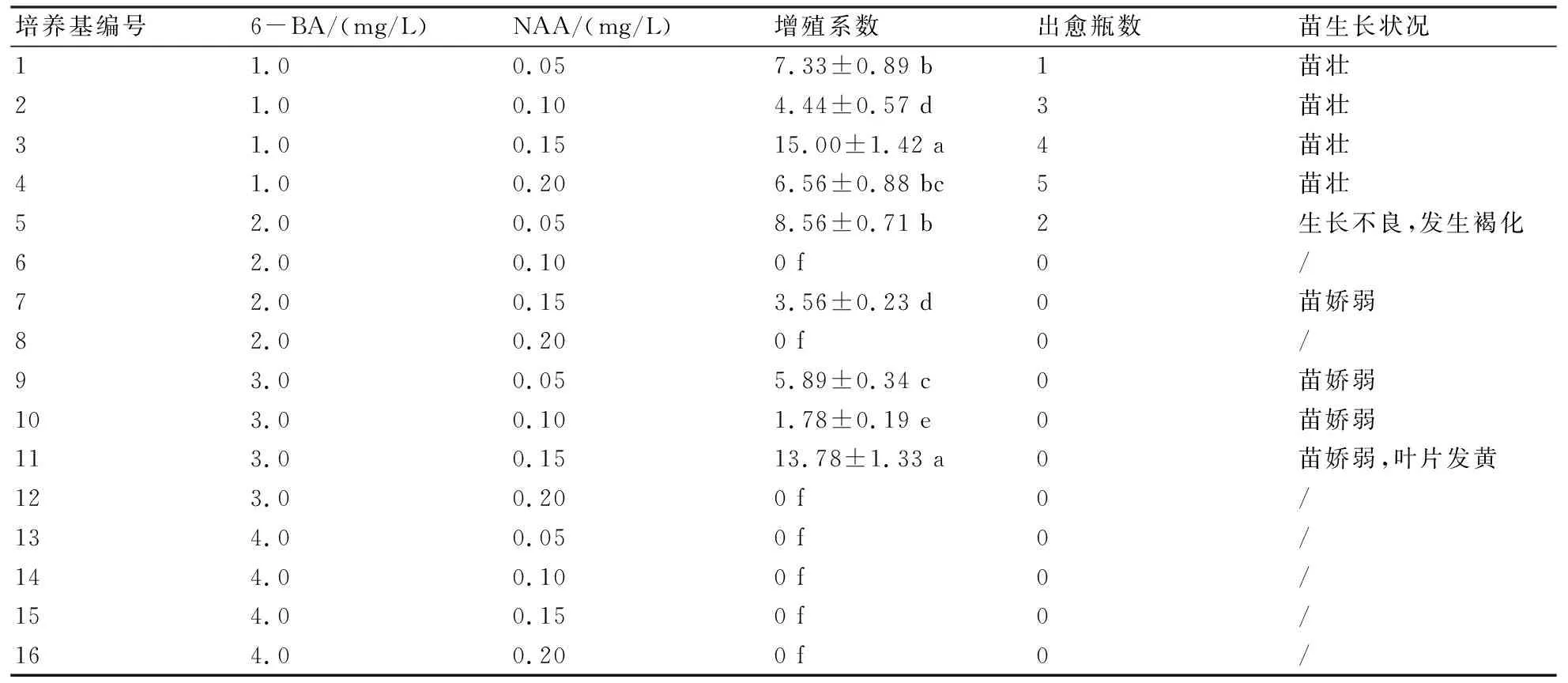
表2 不同植物生长调节剂组合对茅苍术丛芽增殖的影响
注:不同小写字母表示差异达到P<0.05的显著水平。下同。

表3 不同继代次数对茅苍术丛苗增殖的影响
2.3 不同培养基对生根的影响
取生长8周的一致单株壮苗(图1-D),接入生根培养基培养3周后调查生根状况,结果如表4、图1-E所示。根系长势采用“+++”(表示根长度长于8 cm、数量达到15根以上)、“++”(根系长度长于5 cm,数量10根以上)和“+”(根系长度短于5 cm,数量较少)三等级表示。在8种生根培养基中,3、4、5、6号培养基的生根率、平均生根数、根系长势都与其余4种差异明显,显然不适合作为茅苍术工厂化生产的生根培养基。1号对照与2、7、8号培养基比较,生根率都为100%,但平均生根数显著减少,根系长势也偏弱。
2、7、8号培养基分别添加活性炭、NAA及活性炭+NAA,它们的平均生根数分别为24.9、25.7和24.8,彼此差异不显著,根系长势也一致,都到达+++级别。

表4 不同类型培养基对茅苍术生根的影响
2.4 组培苗的移栽
茅苍术组培苗移栽基质采用泥炭土∶蛭石∶珍珠岩=2∶1∶1,高压蒸汽灭菌处理。移栽后穴盘置于温室,相对湿度保持80%以上,每周喷施0.1%多菌灵一次,常规管理移栽苗。两周后以产生新叶植株为移栽成活判断标准(图1-F)。经调查成活率达95%,后续可移入盆栽(图1-C),一年后可地栽(图1-H)。

A.无菌苗;B.丛生芽;C.单芽;D.试管苗;E.生根苗;F.移栽苗;G.盆栽苗;H.地栽苗图1 茅苍术高效快繁技术体系
3 讨论与结论
巢建国等[7]研究发现茅苍术胚轴分化能力最强,每段能产生8~10个新芽。王红娟等[10]研究茅苍术胚轴丛芽增殖最佳培养基,平均增殖系数为(10.0±0.71)。植物生长调节剂是植物组织培养器官分化的关键因素,形成器官的类型由培养基中不同植物生长调节剂的相对质量浓度控制,而不是由这些物质的绝对质量浓度决定[14]。本研究使用6-BA 1.0 mg/L、NAA 0.15 mg/L的植物生长调节剂组合,芽增殖系数达到最高15.0,高于前人的研究结果,这说明这2种植物生长调节剂的相对浓度比例较合适,对芽的增殖起到较好的促进作用。
利用此增殖培养基对茅苍术丛芽进行继代培养,共继代到8代。试验结果显示,4代以后增殖系数显著增加,一直到第8代,并且继代苗高度和叶片数各代间差异不大,丛苗生长状况良好。通常在种苗快繁与保存时,无菌繁殖体系在培养基中激素的作用下,分生组织不断分化,能连续多代增殖。曹孜义等[15]对葡萄离体培养48~80代后发现增殖倍数并未降低。苹果新梢外植体继代培养100余次,其器官再生能力没有显著变化[16]。本试验结果与上述研究结果相似,表明在茅苍术工厂化快繁生产中能使用此培养基多次继代,在组培苗生根前获得充足的中间繁殖体。
培养基中添加活性炭能为根的生长发育营造近似自然生长条件下的黑暗环境,吸附培养基中有毒副作用的物质,降低盐离子浓度,因而活性炭可以促进不定芽生根和生长。张素勤等[17]研究发现1/2MS中添加0.2%~0.3%活性炭能明显促进非洲菊不定芽生根,缩短生根时间,增加根数和根长。在本试验中,1/2MS添加0.5%活性炭与未添加活性炭平均生根数比较差异显著,说明添加活性炭有利于茅苍术生根。此外,1/2MS添加0.15 mg/L NAA的生根效果与添加活性炭类似,但两者均添加的培养基中并没有表现出明显增加、乃至倍增的生根效果,原因有待进一步深入研究。我们认为,与在生根培养基中添加生长素相比,添加活性炭取材容易、操作简便、无激素积累,更适合在工厂化生产中推广使用。
本研究以茅苍术无菌苗为材料,分别从16种增殖培养基和8种生根培养基中筛选出适合工厂化大规模生产用培养基。丛芽增殖培养基为:MS+1.0 mg/L 6-BA+0.15 mg/L NAA,可进行多次继代增殖。生根培养基为:1/2MS+0.5%活性炭。采用泥炭土∶蛭石∶珍珠岩=2∶1∶1的基质移栽成活率达95%。利用该体系可进行茅苍术组培苗高效扩繁,为规模化生产提供技术支持。

