牛蒡根中有效成分的含量测定
窦培元 ,栾晓宁 ,朱连连 ,窦德强 ,翟春涛
(1.山西中医药大学,山西晋中030619; 2.辽宁中医药大学,辽宁大连116600)
牛蒡根为菊科植物牛蒡(Arctium lappaL.)的根,在温带地区分布广泛,常被作为降血糖、补肾壮阳、抗衰老的保健蔬菜[1]。牛蒡根为我国传统的药食两用中药,《名医别录》称其“久服轻身耐老”;明朝李时珍《本草纲目》称其“剪苗淘为蔬,取根煮,曝为脯,云其益人”,又言其“通十二经脉,除五脏恶气”。牛蒡根风靡日韩两国,可以与人参相媲美,素有“东洋参”之美誉[2]。在我国牛蒡的种植,主要作为蔬菜出口日本和韩国,具有降脂和调节胃肠功能等作用[3]。近年来,牛蒡根在我国的食用消费和工业生产开发利用迅猛增加。本研究对牛蒡根中有效成分绿原酸、牛蒡苷及苷元、菊糖、蔗果四糖、果糖及葡萄糖等成分进行含量测定,为牛蒡根资源的进一步开发提供了理论依据。
1 材料与方法
1.1 试药与仪器
1.1.1 试药 牛蒡根(源升和金生物科技有限公司,批号:20161101,20161108,20171205);绿原酸对照品(中国食品药品检定研究所,批号:110753-201415);牛蒡苷及牛蒡苷元对照品(中国食品药品检定研究所,批号:110819-201611);葡萄糖(西王药业有限公司,批号:20160822);浓硫酸(沈阳新兴试剂厂,批号:20161023);苯酚(上海沪宇生物科技有限公司,批号:20160213);DNS试剂(北京雷根生物技术有限公司,批号:20160910);蔗果四糖、果糖及葡萄糖(色谱纯,日本Wako公司);薄层层析硅胶(青岛海洋化工有限公司,批号:20160923);色谱甲醇(天津市科密欧化学试剂有限公司,批号:20161002);乙腈(色谱纯,Oceanpak Alexative Chemical,批号:20161103)等。
1.1.2 仪器 UV2100型紫外可见分光光度计(尤尼柯上海仪器有限公司);SHZ-DⅢ型循环水真空泵(巩仪市予华仪器责任有限公司);1H-P202C富士宝电磁炉(佛山市富士宝电器科技有限公司);FD-EA-50冷冻干燥机(北京博医康实验仪器有限公司);AE系列电子分析天平:FA-1004电子天平(上海精科天平厂);DZF-6050真空干燥箱(上海一恒科技有限公司);Agilent 1260型高效液相色谱仪(安捷伦科技有限公司),配置四元梯度泵、DAD检测器;QE-100克粉碎机(武义县屹立工具有限公司);YB-IA真空恒温干燥箱(天津市鑫洲科技有限公司);KQ-250 DE型数控超声波清洗器(昆山市超声仪器有限公司)等。
1.2 实验方法
1.2.1 绿原酸含量测定 绿原酸的含量测定参照文献[4],具体方法如下。
1.2.1 .1 对照品溶液的制备 精密称取绿原酸对照品5 mg,置于100 mL量瓶中,加60%甲醇溶解并稀释至刻度,摇匀,即得含绿原酸0.05 mg/mL的对照品溶液,待用。
1.2.1 .2 供试品溶液的制备 精密称取过40目筛的干燥牛蒡根粉末0.5 g,置50 mL圆底烧瓶中,精密加入60%甲醇25 mL,加热(74.2℃)回流提取60 min,取出,放至室温后再称重,补足减失的重量,摇匀,过滤,取续滤液用微孔滤膜过滤,即为供试品溶液。
1.2.1 .3 色谱条件 色谱柱:phenomenex C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.4%磷酸溶液(8∶92);检测波长 327 nm;流速 1.0 mL/min;柱温35℃。进样量10 μL。
1.2.1 .4 方法学考察 线性关系考察,线性关系良好;精密度良好;重复性实验中RSD为1.1%,表明方法重复性良好;稳定性实验中RSD为1.4%,表明样品在12 h内具有良好的稳定性;绿原酸的平均回收率为99.9%,RSD为1.20%,说明该方法可行。
1.2.1 .5 测定方法 精密吸取对照品溶液和供试品溶液各10 μL,注入高效液相色谱仪,测定,即得。HPLC图见图1。
1.2.2 牛蒡苷及苷元含量测定 牛蒡苷及苷元含量测定参照中国药典[5],具体操作方法如下。
1.2.2 .1 对照品溶液制备 精密称取干燥至恒重的牛蒡苷对照品5 mg,置10 mL量瓶中,加甲醇稀释至刻度,制成每1 mL含牛蒡苷0.5 mg的溶液。精密称取干燥至恒重的牛蒡苷元对照品8.7 mg,置25 mL量瓶中,加甲醇稀释至刻度,摇匀,制成每1 mL含牛蒡苷元0.348 mg的溶液。
1.2.2 .2 供试液的制备 精密称取干燥的牛蒡根粉末(过40目筛)1 g,加30 mL甲醇超声20 min,过滤浓缩后定容于25 mL容量瓶中,取适量用0.45 μm微孔滤膜过滤即可。
1.2.2 .3 薄层检测 供试品(约20 μg)点于G60硅胶板(3 cm×6 cm),吹干后置于展层剂中使其上行展开,展开剂为 CHCl2-MeOH(15∶1)。展开完毕后晾干放进碘缸里用碘熏。
1.2.2 .4 色谱条件 色谱柱:phenomenex C18柱(250 mm×4.6 mm,5 μm);以甲醇-水(1∶1.1)为流动相;检测波长为280 nm;柱温:30 ℃;流速:1 mL/min。
1.2.3 总糖含量测定 总糖的含量测定参照文献[6],具体方法如下。
1.2.3 .1 葡萄糖标准品的配制 精密称取干燥至恒重的标准葡萄糖20 g于100 mL容量瓶中,加水至刻度,配成200 μg/mL的葡萄糖标准溶液。
1.2.3 .2 供试品溶液的配制 称取干燥的牛蒡根粉碎过40目筛1.00 g,料液比1∶40,提取温度80℃和提取时间3 h,抽滤得到牛蒡提取液,浓缩并定容至25 mL容量瓶中。精密量取1 mL定容于50 mL容量瓶中,待测。
1.2.3 .3 方法学考察 线性关系考察,线性关系良好;精密度实验中RSD 1.30%,为精密度良好;重复性实验中RSD为1.40%,表明方法重复性良好;稳定性试验中RSD为2.60%,表明样品在2 h内具有良好的稳定性;平均回收率为100.0%,说明该方法可行。
1.2.3 .4 测定方法 总糖的测定采用苯酚-硫酸法,根据对照标准曲线算出各样品中还原糖的含量。
1.2.4 还原糖含量测定 还原糖的含量测定参照文献[7],具体方法如下。
1.2.4 .1 葡萄糖标准品的配制 准确称取105℃烘干的葡萄糖标样1 g于100 mL的容量瓶中,用去离子水定容至刻度,摇匀,得到10 mg/mL标准溶液。
1.2.4 .2 供试品溶液的配制 精密称取干燥的牛蒡根粉碎过40目筛1 g,料液比1∶40,提取温度80℃和提取时间3 h,抽滤得到牛蒡提取液,浓缩并定容至25 mL容量瓶中。精密量取1 mL,定容于10 mL容量瓶中,待测。
1.2.4 .3 方法学考察 线性关系考察,线性关系良好;精密度试验中RSD 1.19%,为精密度良好;重复性试验中RSD为1.38%,表明方法重复性良好;稳定性试验中RSD为1.12%,表明样品在24 h内具有良好的稳定性;平均回收率为99.9%,说明此方法准确可靠。
1.2.4 .4 测定方法 还原糖的测定采用3,5—二硝基水杨酸法,根据对照标准曲线算出各样品中还原糖的含量。
1.2.5 菊糖含量测定 按“2.3”和“2.4”项下操作,菊糖含量=总糖含量-还原糖含量[8]。
1.2.6 蔗果四糖、果糖及葡萄糖含量测定 蔗果四糖、果糖及葡萄糖的含量测定参照文献[9],具体方法如下。
1.2.6 .1 标准品溶液的制备 分别精密称定蔗果四糖对照品2 mg,置于2 mL容量瓶中,果糖对照品2 mg,置于2 mL容量瓶中,葡萄糖2 mg加蒸馏水至刻度线,摇匀,备用。
1.2.6 .2 样品溶液的制备 精密取药材粉末1.5 g,加乙酸乙酯50 mL,超声提取30 min,过滤,残渣加70%甲醇50 mL,超声提取30 min,离心取上清液备用。
1.2.6 .3 色谱条件 色谱柱:Agilent ZORBAX NH2柱(5 μm,4.6 mm×150 mm);流动相为乙腈-水(70∶30);流速为1 mL/min;进样量5 μL;柱温30℃。检测器为蒸发光散射检测器(ELSD),漂移管温度80℃,氮气体积流量3.5 L/min。压力3.5 bar,gain值为5。
1.2.6 .4 方法学考察 线性关系考察,蔗果四糖、果糖及葡萄糖线性关系良好;在蔗果四糖、果糖及葡萄糖精密度试验中RSD 1.0%、1.45%、0.93%,精密度良好;重复性试验中RSD为2.6%、1.15%、1.24%,表明方法重复性良好;稳定性试验中RSD分别为1.1%、1.6%、1.66%,表明样品在48 h内具有良好的稳定性;蔗果四糖、果糖及葡萄糖的平均回收率分别为100.0%、95.35%、98.43%,说明此方法准确可靠。
1.2.6 .5 测定方法 根据标准曲线算出样品中蔗果四糖、果糖及葡萄糖的含量。
2 结 果
2.1 绿原酸含量
绿原酸测定的色谱图如下,样品中绿原酸峰与其他非被测成分峰能够达到基线分离。结果见图1。

图1 供试品溶液色谱图(A为绿原酸色谱峰)
外标一点法测定牛蒡根三批药材中绿原酸的含量,结果见表1。

表1 牛蒡根中绿原酸含量
2.2 牛蒡苷及苷元含量
2.2.1 薄层检测结果 用标准品牛蒡苷和苷元作对比,见下图2。从薄层板可以看出牛蒡根中不含有牛蒡苷和苷元。

图2 样品、牛蒡苷及苷元薄层色谱图
2.2.2 色谱结果 HPLC测定结果表明牛蒡根中不含有牛蒡苷及苷元。结果见图3。
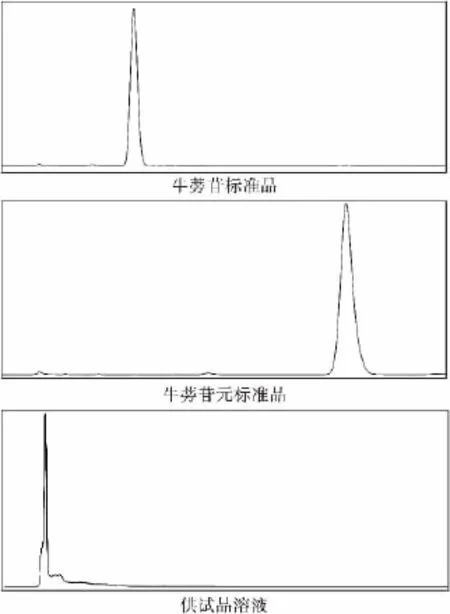
图3 HPLC法检测结果
2.3 总糖、还原糖及菊糖含量
按照实验部分得出总糖和还原糖标准曲线,根据总糖的标准曲线y=0.006 4x+0.021,R2=1和还原糖的标准曲线y=0.508 4x+0.017 1,R2=1计算牛蒡根药材中总糖及还原糖含量,结果见表2。
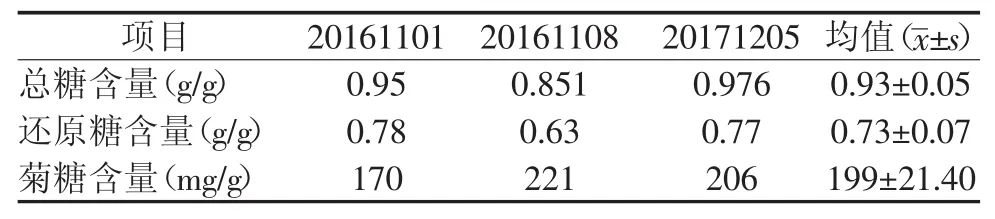
表2 牛蒡根中总糖、还原糖及菊糖含量
2.4 蔗果四糖、果糖及葡萄糖含量
牛蒡根中蔗果四糖、果糖及葡萄糖测定的色谱图见图4。

图4牛蒡根样品测定色谱图
按实验方法,得到蔗果四糖、果糖及葡萄糖回归方程分别为 Y(logY)=1.601 8X(logX)+2.076 8,R2=1;Y(logY)=1.210 4X(logX)+2.258 6,R2=1;Y(logY)=0.675X(logX)+2.422 1,R2=1。根据蔗果四糖、果糖及葡萄糖的标准曲线计算样品中蔗果四糖、果糖及葡萄糖的含量,结果见表3。

表3 牛蒡根中蔗果四糖含量
3 讨论
牛蒡根在我国作为传统中药材已经有很长的使用时间,传统中医认为牛蒡根具有利咽、解热、利尿、抗衰老等作用。近些年,越来越多的实验研究表明牛蒡根中有效成分的含量较为丰富。本实验所测得的牛蒡根中不含有牛蒡苷和牛蒡苷元,前述文献对牛蒡不同部位所含牛蒡苷和牛蒡苷元的含量进行了考察,其中野生牛蒡根含有少量牛蒡苷,含量为0.39 mg/g,不含牛蒡苷元;栽培根中不含有牛蒡苷和牛蒡苷元[10]。近年来牛蒡根在我国的食用消费迅猛增加,随着栽培牛蒡根的出现,消费者误认为牛蒡根中都含有牛蒡苷和牛蒡苷元。同时我们再次对栽培牛蒡根中是否含有牛蒡苷和牛蒡苷元进行验证,再次证明栽培根中不含有牛蒡苷和牛蒡苷元。牛蒡根中含有较高含量绿原酸、糖类、氨基酸和蛋白质等营养物质,具有较高的营养价值。
据报道每100 g鲜牛蒡根中含胡萝卜素 390 mg、维生素 C 25 mg、钙 242 mg、磷 61 mg、铁 7.6 mg,并含有锌、镁、铜等微量元素。牛蒡根的胡萝卜素含量比胡萝卜高150倍,蛋白质和钙的含量为根茎类之首[11]。牛蒡根中氨基酸以天门冬氨酸和精氨酸的含量较高,富含人体必需的各种氨基酸,具有抗衰老、抗炎、抗病毒、抗癌、扩张血管、促进血液循环等作用[12]。牛蒡根中还富含其他多种活性物质[13-15]:主要有牛蒡醛、牛蒡酸、多炔物质、愈创木内酯类化合物等。新鲜牛蒡根含有的多酚化合物主要包括绿原酸、异绿原酸、咖啡酸、一咖啡酰衍生物、二咖啡酰衍生物等,另外还含过氧化物酶;牛蒡根中多炔物质具有抑制细菌和抗真菌作用。牛蒡根中还富含纤维素[16]。因此进一步开发利用牛蒡根具有广泛的应用前景。本实验得到牛蒡根中有效成分含量测定结果为牛蒡根的开发利用提供了依据和参考,为牛蒡根的质量标准制定奠定基础。
Determination of active ingredients in the roots of Arctiumlappa
Dou Peiyuan1,Luan Xiaoning2,Zhu Lianlian2,Dou Deqiang2,Zhai Chuntao1
(1.Shanxi University of Chinese Medicine,Jinzhong Shanxi 030619;2.Liaoning University of Traditional Chinese Medicine,Dalian Liaoning 116600)
AbstractObjective:The contents of chlorogenic acid,arctiin and arctigenin,total sugar,reducing sugar,inulin,nystose,fructoseand glucose were determined in the roots of Arctiumlappa.Methods:HPLC method was used to determine the chlorogenic acid with the chromatographic conditions:phenomenex C18(250 mm×4.6 mm,5 μm),eluting with mixture of acetonitrile-0.4%phosphoric acid solution(8∶92)with flow rate of 1 mL/min,detection wavelength was set at 327 nm,and column temperature was at 35 ℃.TLC and HPLC methods were used to detect arctiin and arctigenin,the charomatographic conditions:phenomenex C18(250 mm×4.6 mm,5 μm)column,methanol-water(1∶1.1)as mobile phase with flow rate of 1.0 mL/min,The detection wavelength was set at 280 nm,column temperature was at 30℃.The inulin content was measured with the difference between total carbohydrate and reducing sugars.Reducing sugar was determined by the 3,5-dinitrosalicylic acid(DNS).The total carbohydrate was determined by H2SO4-minophenol method.HPLC method was used to determine the nystose,fructose and glucose,the chromatographic conditions:Agilent zorbax NH2column(5 μm,4.6×150 mm);acetonitrile-water(70∶30)as the mobile phase with flow rate 1.0 mL/min with evaporative light scattering detector(ELSD),a drift tube temperature of 80 °C and a nitrogen volume flow rate of 3.5 L/min.Pressure 3.5bar,gain value of 5.Results:(1.40±0.36)mg/g of chlorogenic acid was determined in the root of Arctiumlappa and the arctiin and arctigenin could not be detected in the root of Arctiumlappa.Total sugar was determined to be(0.93±0.05)g/g;Reducing sugar was determined to be(0.73±0.07)g/g;Inulin was determined to be(199±21.40)mg/g,the content of nystose was(2.87±0.10)%,the content of fructose was(8.68±0.23)%;the glucose in the root of Arctiumlappa was(3.56±0.20)%.Conclusion:The root of Arctiumlappa contains higher levels of chlorogenic acid,total sugar,reducing sugar,inulin,Nystose,fructose and glucose,indicating that it possessed higher research value.
Key wordsroots of Arctiumlappa;chlorogenic acid;arctiin and arctigenin,total sugar;reducing sugar;inulin;nystose;fructose;glucose

