运用HSCCC法分离纯化荷叶中 三种黄酮及抗氧化活性
潘 汇,蔡为荣,谢亮亮,张 杰
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
荷叶(Lotus leaf)系睡莲科属(Nymphaeaceaegenus)植物,生长在池塘以及湖泊中,中国荷叶资源丰富,在长江、黄河流域均有分布[1-2]。荷叶自古以来都被以药食两用的植物在民间应用,据《本草纲目》记载:“荷时服之,令人瘦劣,单服可以消阳水浮之气”。1991年11月中华人民共和国卫生部的卫监发(1991)第45号文件中,荷叶被列入第二批“既是食品又是药品”的名单之中[3]。
现代药理研究证明荷叶含有多种具有生理活性的物质,其中生物碱、黄酮类是荷叶中的主要活性成分[4]。黄酮类成分主要包括槲皮素、槲皮苷、紫英云苷、金丝桃苷等。研究表明荷叶中的黄酮类物质具有抗氧化、清除自由基[5]、消炎、镇痛、降血脂[6]、抗癌、抗肿瘤[7]等显著的生理活性。当前在荷叶黄酮分离纯化方面主要的方法有离子沉淀、膜分离、超滤、柱色谱技术、制备型高效液相色谱以及高速逆流色谱技术等[8]。单一的柱色谱分离纯化荷叶黄酮很难得到黄酮单体,制备型高效液相色谱制备荷叶黄酮单一处理的荷叶黄酮的量较小,工作较为繁重,很难对其进行大规模的推广。
高速逆流色谱是一种无固定相支撑的液-液色谱分离技术,它的固定相和流动相都是液体,没有不可逆吸附,具有样品无损失、无污染、高效、快速和大制备量分离等优点。盛达成等[9]利用高速逆流色谱技术在荷叶粗黄酮粉末中成功分离出纯度超过90%的槲皮素单体。邓胜国等[10]利用高速逆流色谱从荷叶中分离出三种荷叶黄酮苷。孙清华等[11]利用高速逆流色谱技术在中药知母中分离得到四种纯度超过90%的化合物。本研究以荷叶为原料,在高效液相色谱技术分析荷叶黄酮的基础上,通过对不同的两相溶剂系统的优化选择,建立高速逆流色谱法分离纯化荷叶黄酮的技术方法。为进一步开发利用荷叶黄酮类物质资源提供理论与技术依据。
1 材料与方法
1.1 材料与仪器
荷叶 (选用体格较大的荷叶采摘晾晒)2017年8月采摘于安徽工程大学校内池塘;乙醇、甲醇、乙酸乙酯、正己烷、正丁醇、三氯甲烷、甲酸 分析纯,天津科密欧化学试剂有限公司;甲醇 色谱纯,天津科密欧化学试剂有限公司;DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐) 美国sigma公司;蒸馏水 实验室自制;超纯水 上海合泰纯水机有限公司;槲皮素、异槲皮苷、芦丁、紫英云苷标准品 北京普天同创生物科技有限公司。
TBE-300B型高速逆流色谱仪(HSCCC)、聚四氟乙烯柱(管直径2.6 mm,柱体积310 mL,转速0~900 r/min)、TBD-2000 检测器、恒温水浴中压恒流泵 中国上海同田生化技术有限公司;Waters高效液相色谱系统配备waters C18柱(150×4.6 mm)2998二极管阵列检测器 美国沃特世公司;722型可见分光光度计 上海佑科仪器仪表有限公司;LGJ-10型冷冻干燥机 北京松源华兴科技有限公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;KQ-250E型超声波清洗器 昆山超声仪器有限公司。
1.2 实验方法
1.2.1 荷叶黄酮粗品样品的制备 荷叶经烘箱40 ℃烘至恒重后经粉碎机粉碎后过80目筛子,精密称取100 g荷叶粉末,加入到2 L已煮沸的蒸馏水中继续煮沸30 min,抽滤,浸提两次,合并两次滤液得到荷叶水提液。对所得的荷叶水提液在40 ℃,压强为-0.09 MPa条件下进行减压浓缩至100 mL。用经过预处理后的大孔树脂AB-8对荷叶水提液进行纯化,浓缩液一次上样50 mL,用蒸馏水以2 BV/h的流速洗去蛋白质、多糖等杂质至无色,用70%乙醇溶液以2 BV/h进行洗脱,收集洗脱液,在40 ℃条件下减压浓缩后进行冷冻干燥得到初步纯化的荷叶黄酮。
1.2.2 HSCCC法分离纯化 荷叶黄酮溶剂体系的选择速逆流色谱分离纯化荷叶黄酮溶剂体系的选择,参照邓盛国[12],李强[13],刘人民[14]等利用HSCCC对植物黄酮进行分离的溶剂体系结合样品情况,本研究设计以下两相溶剂系统:a.氯仿∶甲醇∶水(体积比为4∶3∶2);b.氯仿∶甲醇∶水(体积比为2∶2∶1);c.正丁醇∶甲醇∶水(体积比为5∶1∶4);d.正己烷∶乙酸乙酯∶甲醇∶水(体积比为1∶6∶1∶6);e.正己烷∶乙酸乙酯∶甲醇∶水(体积比为1∶3∶1∶3)。
1.2.3 HSCCC分离纯化 荷叶黄酮组分溶剂体系的制备按照1.2.2的溶剂体系配制两相溶剂,按照比例量取所需体积的溶剂置于分液漏斗中摇匀两相溶剂,记录分层时间,静置30 min达到平衡。分离出上下相,250 W功率下超声脱气20 min。以上相作为固定相,下相作为流动相。
样品制备:取100 mg经大孔树脂纯化后荷叶黄酮冻干样用10 mL下相超声溶解待用。
分离流程:以40 mL/min的流速泵固定相,待出口处有稳定的液体流出停止,启动高速逆流色谱仪至正转850 r/min。以2 mL/min泵流动相至出口所接的流出液出现明显分层,计算固定相保留值。在254 nm的检测波长下进行谱图采集,根据谱图出峰情况收集流出液组分,将收集得到流出液减压浓缩,冷冻干燥得到目标组分粉末,用分析天平称量各目标组分质量。
保留值(%)=(V总-V流)/V总×100
式中V总(mL)为柱总体积,V流(mL)为固定相被流动相排出的体积。
1.2.4 分配系数K的测定 分配系数指一定温度下,处于平衡状态时,组分在固定相中的浓度和在流动相中的浓度之比,以K表示。使用分液漏斗配制好溶剂系统,充分混匀,静置平衡,并记录其分层时间T。取适量荷叶黄酮冻干样用下相溶解,取下相3 mL加入等体积上相充分混合,分离上下相挥干用于高效液相色谱检测,分配系数K按照下面的公式计算。
K=A1/A2
A1:荷叶黄酮目标组分在上相中的峰面积;A2:荷叶黄酮目标组分在下相中的峰面积。
1.2.5 HPLC分析鉴定 所分离出的荷叶黄酮组分运用HPLC分别分析检测经大孔树脂纯化后及HSCCC分离后的荷叶黄酮组分。参考叶晓兰等[15]测定陈皮黄酮的高效液相色谱条件并结合样品情况确立液相色谱检测条件,高效液相色谱条件为:waters C18分析色谱柱(15 cm×4.6 mm,5 μm),柱温30 ℃,进样体积10 μL,流动相组成为A:甲醇;B:超纯水(含0.3%的甲酸)。以40% A相,60% B相进行等度洗脱,检测波长254 nm,流速0.8 mL/min。用所购得的标准品配置成0.1 mg/mL的溶液,以同样的色谱条件进行检测,通过保留时间作为参考来进行对照。
1.2.6 荷叶黄酮组分的抗氧化活性研究 对HSCCC分离所得的荷叶黄酮组分进行抗氧化活性研究。用所得组分进行清除羟基自由基、DPPH、ABTS的能力进行实验研究。
1.2.6.1 羟基自由基清除率的测定 利用Fenton反应原理产生羟基自由基进行实验研究。参考颜军等[16]的方法,在反应体系中加入2 mL 2 mmol/L FeSO4溶液,加入2 mL 6 mmol/L H2O2溶液,加入6 mmol/L的水杨酸6 mL,37 ℃水浴加热15 min 取出,加入一定浓度的荷叶多酚溶液0.5 mL,37 ℃条件下水浴0.5 h。以蒸馏水为参比液,在 510 nm测定其吸光值,以VC作为阳性对照,计算清除率。
清除率(%)=[(A0-A1+A2)/A0]×100
式中:A0位空白对照液吸光值;A1为加入样品后反应体系吸光值;A2为样品本底吸光值。
1.2.6.2 DPPH自由基清除率的测定 参考文献[17-18]并稍作修改,取DPPH试剂5 mg溶解于100 mL无水乙醇中制得DPPH储备液,在试管中依次加入2 mL DPPH储备液和一定浓度的多酚溶液,静置半小时在519 nm下测试吸光度,以VC作为阳性对照,计算清除率。
清除率(%) =[1-(A1-A2)/A0]×100
其中,A1为实验组的吸光度;A2为荷叶多酚样品本身吸光度;A0空白实验组吸光度。
1.2.6.3 ABTS+自由基清除率测定 参考文献[19-20]稍作修改,将ABTS(10 mg)溶解在2.6 mL 2.45 mmol/L过硫酸钾溶液以制备原液。该混合物在4 ℃条件下避光过夜。将该溶液在甲醇中稀释至吸光度在734 nm处测量为0.70±0.02。准确吸取0.1 mL不同浓度的荷叶多酚溶液置于试管中,加入3.9 mL的ABTS+工作液,混合摇匀,室温避光保存1 h,在734 nm条件下测其吸光度A1,采用VC作为阳性对照,对ABTS自由基的清除率按如下公式计算:
清除率(%)=[1-A1/0.070]×100
1.3 数据处理

2 结果与分析
2.1 HSCCC分离纯化荷叶黄酮条件的确立
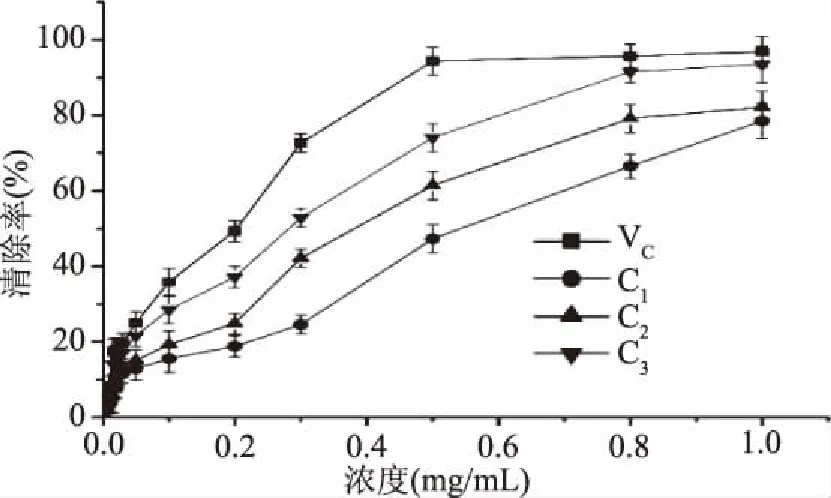
溶剂体系的选择对分离效果至关重要。研究表明,一个好的高速逆流色谱溶剂系统应满足下列要求:固定相要有较高的保留率;两相溶剂系统的分层时间小于30 s;分配系数 K 应尽量符合0.5 表1 不同溶剂系统中的分配系数(K)及效果分析Table 1 The partition coefficient(K)values of the targeted components measured in different solvent systems 图1 荷叶黄酮高速逆流色谱分离图Fig.1 Determination of flavonoid in lotus leaves by HSCCC注:a的分离体系为正己烷∶乙酸乙酯∶甲醇∶水=1∶6∶1∶6; b的分离体系为正丁醇∶甲醇∶水=5∶1∶4。 1、2、3分别为所分离的目标组分C1、C2、C3。 利用HPLC对经AB-8大孔树脂初步纯化的荷叶黄酮粗品及经高速逆流色谱技术(HSCCC)分离纯化的目标组分进行分析检测,得到经大孔树脂纯化所得粗黄酮及高速逆流色谱技术(HSCCC)分离纯化所得的荷叶黄酮目标组分及标准品的HPLC分析图如图2所示。通过标准品对照实验进行对照,得到3个目标组分分别是紫英云苷、异槲皮苷及槲皮素。 图2 荷叶黄酮的HPLC检测图Fig.2 Determination of flavonoid in lotus leaves by HPLC 2.3.1 荷叶黄酮目标组分对羟基自由基的清除作用 三种目标组分及对照品VC均对羟基自由基有一定的清除作用,在0~1.0 mg/mL浓度范围内,均随着浓度的增大而增强,即有一定的剂量效应。VC对羟基自由基的清除率最高,浓度为0.8 mg/mL时,清除率就达到98.01%。目标组分C3在1.0 mg/mL浓度下的清除率可以达到为96.32%。总清除活力有以下顺序:VC>C3>C2>C1,与HisashiMatsuda[23]对黄酮结构对抗氧化活性影响的研究结果一致。清除羟基自由基的半数清除率IC50分别为0.63、0.94、0.85、0.76 mg/mL,得到的实验结果见图3。 图3 荷叶黄酮目标组分对羟基自由基的清除率的影响Fig.3 Effects of hydroxyl radical scavenging rate on target components of lotus leaf flavonoids 2.3.2 荷叶黄酮目标组分对DPPH自由基的清除作用 利用DPPH试剂盒对经HSCCC分离所得荷叶黄酮目标组分进行抗氧化研究,以VC作为阳性对照,经HSCCC分离得到三种目标组分及阳性对照VC均对DPPH自由基有一定的清除作用,目标组分C3对DPPH自由基的清除作用最强,在浓度为0.1 mg/mL时已经达到75.42%。在0~1.0 mg/mL浓度范围内,三种目标组分及阳性对照VC均对DPPH自由基的清除作用均随着浓度的增大而增强,清除能力大小有以下顺序:C3>VC>C2>C1,类似的也有研究指出[24-25],对DPPH自由基的清除能力槲皮素>VC>异槲皮苷。其中VC、C1、C2、C3清除DPPH自由基的半数清除率IC50分别为0.12、0.39、0.28、0.06 mg/mL,得到实验结果见图4。 图4 荷叶黄酮目标组分对DPPH自由基的清除率的影响Fig.4 Effects of DPPH radical scavenging rate on target components of lotus leaf flavonoids 2.3.3 荷叶黄酮目标组分对ABTS+自由基的清除率的影响 利用ABTS试剂对经HSCCC分离所得荷叶黄酮目标组分进行抗氧化研究,以VC作为阳性对照,经HSCCC分离得到三种目标组分及阳性对照VC均对ABTS+自由基有一定的清除作用,VC对ABTS+自由基的清除活性最强,在0.3 mg/mL浓度下清除率就达到了72.63%,而C3在该浓度下仅为52.84%。在0~1.0 mg/mL浓度范围内,三种目标组分及对照组VC对ABTS+自由基清除能力均随着浓度的增加而增强。其中对ABTS+自由基清除能力大小VC>C3>C2>C1,有研究表明[26],对ABTS+自由基清除能力中,VC>槲皮素>异槲皮苷。其中VC、C1、C2、C3清除ABTS自由基的半数清除率IC50分别为0.21、0.56、0.47、0.29 mg/mL。得到的实验结果见图5。 图5 荷叶黄酮目标组分对ABTS+自由基的清除率的影响Fig.5 Effects of ABTS+ radical scavenging rate on target components of lotus leaf flavonoids 本实验采用高速逆流色谱法这种较为新颖的分离方法对荷叶黄酮进行分离纯化,以80 mg荷叶粗黄酮为原料分离纯化得到三种纯度较高的荷叶黄酮单体,质量分别为12.4、5.9、2.1 mg。经过标准品对照三种荷叶黄酮可能是:紫英云苷、异槲皮苷及槲皮素。 对所得到荷叶黄酮目标组分进行抗氧化研究,以羟基自由基、DPPH、ABTS+三种自由基机制作为衡量目标组分抗氧化活性的指标。得到三种目标组分对羟基自由基的半数清除率IC50分别为:0.94、0.85、0.76 mg/mL;对DPPH自由基的半数清除率IC50分别为0.39、0.28、0.06 mg/mL;对ABTS+自由基清除率分别为:0.56、0.47、0.29 mg/mL。对荷叶资源的开发与利用提供了一定的技术支持与理论参考。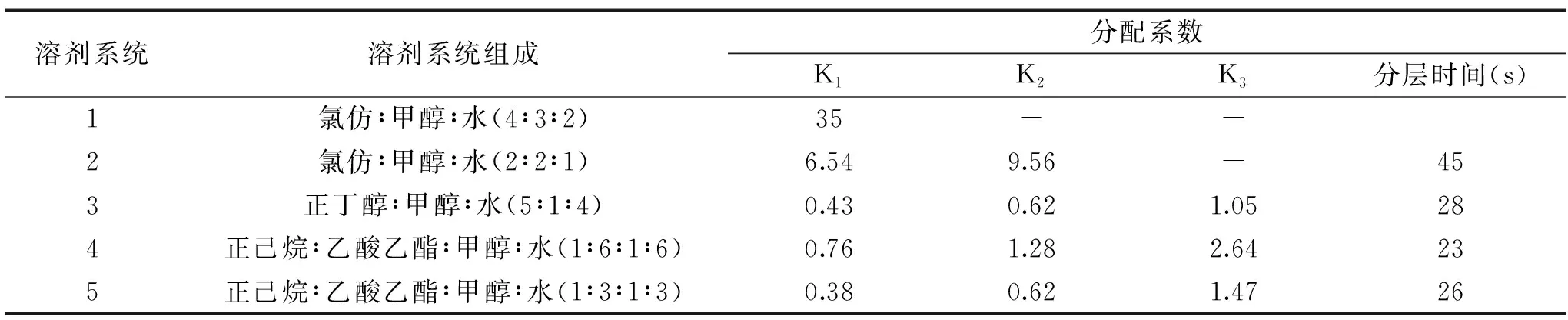

2.2 HPLC分析检测荷叶黄酮目标组分

2.3 荷叶黄酮目标组分的抗氧化活性研究


3 结论

