高压热杀菌处理对枯草杆菌芽孢皮层裂解酶活力的影响
章 中,孙 静,张津瑜,郭洪伟,贺晓光
(宁夏大学农学院,宁夏银川 750021)
芽孢是细菌营养体在缺乏营养的环境条件下形成的休眠态,对辐照、超高压、热、超声波、微波、化学物质等各种杀菌处理有极强的抗性[1-4]。高压热杀菌处理(HPTS)将超高压和温度耦合起来杀菌,对细菌芽孢有良好的杀灭作用,且对食品品质影响较小[5-6]。Uchida等[7]报道HPTS(600 MPa、65 ℃)能杀灭酸土脂环酸芽孢杆菌芽孢。Ates等[8]报道HPTS(650 MPa、65 ℃、10 min)能杀灭4.5个对数的枯草芽孢杆菌芽孢。Evelyn等[9]报道:HPTS(400~600 MPa、70 ℃)能杀灭牛奶中的蜡样芽孢杆菌芽孢,Weibull模型能很好地描述芽孢死亡动力学。Luu-Thi等[10]报道HPTS(300~600 MPa、60~100 ℃)能杀灭蜡样芽孢杆菌芽孢,HPTS处理下初期芽孢死亡较快、后期较慢,但两个阶段均可用一级动力学模型描述。HPTS对芽孢的杀灭作用和杀菌动力学已有广泛报道,但关于HPTS杀灭芽孢的机理却鲜有报道。芽孢的皮层是其耐压特性的关键结构,皮层主要由肽聚糖构成,前期研究发现HPTS处理下细菌芽孢皮层肽聚糖发生了水解[1],这是导致芽孢死亡的重要原因之一,然而其水解机理尚不明确,存在两种仅有的可能性:其一是HPTS能激活芽孢自身的皮层裂解酶,其二是HPTS未能激活皮层裂解酶,而其是芽孢中唯一能特异性地水解皮层肽聚糖的酶[1],即HPTS能导致皮层肽聚糖的非酶水解。
在休眠的芽孢中,皮层裂解酶不表现出活性,但在芽孢萌发而转变成营养体的过程中,皮层裂解酶通过某种机制被激活并将皮层肽聚糖水解,这是芽孢萌发过程中的一个重要步骤[11]。Reineke等[12]认为HPTS可能会影响皮层裂解酶的活性,在一定压力和温度条件下,皮层裂解酶可能会被激活,导致芽孢皮层水解,进而使得芽孢结构被破坏。Mathys等[13]认为,HPTS处理下芽孢内部的2、6-吡啶二羧酸(DPA)的释放可能会激活皮层裂解酶,从而将芽孢皮层水解,进而导致芽孢死亡。关于压力和温度对酶蛋白构象影响的报道很多[14-16],但未见有关温度和压力对芽孢皮层裂解酶活力影响的研究报道。
本实验从枯草芽孢杆菌(Bacillussubtilis)的芽孢中提取皮层裂解酶,研究温度、pH、磷酸钠浓度、压力和HPTS对芽孢皮层裂解酶活力的影响,以分析HPTS处理下芽孢皮层肽聚糖的水解机理,进一步阐明HPTS杀灭芽孢的机理,夯实HPTS技术在食品工业中应用的理论基础。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌 中国普通微生物菌种保藏管理中心(CGMCC) 编号As 1.433;促芽孢生长锰盐营养琼脂培养基 向普通营养琼脂培养基中加入MnSO4·H2O(使得培养基中Mn2+的浓度为50 mg/L),调pH至7,灭菌,备用;2,6-吡啶二羧酸(DPA) 分析纯,美国Sigma公司;L-丙氨酸、肌苷 上海瑞永生物科技有限公司;其它化学试剂 均为分析纯,天津市大茂化学试剂厂。
AL204型电子天平 梅特勒-托利多仪器(上海)有限公司;DSX-280B型高压灭菌锅 上海申安医疗器械厂;XMTD-6000型电子恒温不锈钢水浴锅 上海宜昌仪器纱筛厂;LRH系列生化培养箱 上海一恒科学仪器有限公司;GL-10C型冷冻离心机 上海安亭科学仪器厂;722型可见分光光度计 上海驰唐电子有限公司;FE28型pH计 梅特勒-托利多仪器(上海)有限公司;Agilent 1100型HPLC色谱仪及数据处理平台 美国Agilent公司;Welch Ultimate AQ-C18色谱柱(250 mm×4.6 mm,5 μm) 美国Welch公司;UV-2450型紫外可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 枯草杆菌芽孢菌悬液的制备 芽孢的制备参照Gao[17]的方法。枯草芽孢杆菌用营养琼脂培养基活化3代以上后,接入促芽孢生长培养基试管斜面上划线培养,经37 ℃培养7 d后,用无菌去离子水将试管斜面上的芽孢洗涤收集到离心管里,然后用冷的无菌去离子水离心洗涤芽孢三次,离心条件为7000×g、4 ℃、15 min,离心后将上清液和沉淀的上部一起倒掉,洗涤后的芽孢重悬在无菌去离子水中,浓度约为1.5×109CFU/mL,放在4 ℃下保存,一个月内使用。
1.2.2 脱芽孢衣芽孢的制备 脱芽孢衣芽孢的制备参照Gombas[18]的方法。将枯草杆菌芽孢用30 mmol/L十二烷基硫酸钠(SDS)、0.2 mol/L 2-巯基乙醇、0.1 mol/L硼酸盐缓冲液(pH=10.0)在40 ℃下处理8 h,再用蒸馏水彻底洗干净。
1.2.3 芽孢萌发处理 萌发处理参照Miyata[19]和Makino[20]的方法。将枯草杆菌芽孢悬浮液(0.1 g/mL)在65 ℃下热激活45 min,然后在冰水中冷却,再经离心(7000×g、4 ℃、15 min)沉淀后,将芽孢置于10倍体积的、pH为7.0的、30 mmol/L的磷酸钠缓冲液中,于32 ℃下萌发,磷酸钠缓冲液中含有10 mmol/L的L-丙氨酸和4 mmol/L的肌苷。通过测定芽孢悬浮液OD600值的变化来判断萌发的情况。
1.2.4 皮层裂解酶提取 皮层裂解酶提取参照Gombas[18]和Makino[20]的方法。在萌发处理后,将芽孢悬浮液离心(8000×g、4 ℃、10 min),取上清液(50 mL)在4 ℃透析处理2次,每次24 h,透析对照液为2 L、0.05 mol/L、pH=7.0的磷酸钠缓冲液,缓冲液中含有1 mmol/L的乙二胺四乙酸(EDTA)和1 mmol/L的巯基乙酸钠。
1.2.5 皮层裂解酶活性分析 皮层裂解酶会导致脱芽孢衣芽孢萌发[19]。芽孢萌发时,其核心部分水化,导致其折光性发生变化,表现为脱芽孢衣芽孢悬浮液OD600值显著下降,下降程度越高,芽孢的萌发率就越高,皮层裂解酶活性也就越高[21]。皮层裂解酶的活性分析参照Miyata[19]和Makino[20]的方法。在32 ℃下,通过测定1 cm光路内脱除芽孢衣的芽孢悬浮液的OD600值的减少量来评价酶的活性。反应混合物最终体积为5 mL,包含1 mL脱芽孢衣芽孢悬浮液和4 mL酶液,酶液包含0.05 mol/L磷酸钠缓冲液(pH=7.0)、1 mmol/L的EDTA和1 mmol/L的巯基乙酸钠。酶活性单位(U/L)定义为:每分钟OD600值降低0.001所需的酶量。计算公式为:
式中:X为酶活(U/L),t为反应时间(min),V为参与反应的酶量(mL)。
1.2.6 RP-HPLC法检测DPA DPA检测参照Fichtel[22]的方法。使用C18柱(250 mm×4.6 mm,5 μm),柱温30 ℃,流动相是20%的甲醇和80%的磷酸氢钠溶液(浓度为50 mmol/L,用磷酸调整pH至2.5),流速为1.0 mL/min,进样量为10 μL,采用紫外检测器检测,检测波长为272 nm。
1.2.7 各因素对皮层裂解酶活力的影响
1.2.7.1 温度对皮层裂解酶活力的影响 取4 mL透析后的酶液,酶液包含0.05 mol/L、pH为7.0磷酸钠缓冲液,分别于4、12、20、28、36、44、68 ℃培育20 min,对照组为4 mL无菌水在常温下放置20 min,再向各组加入1 mL脱芽孢衣芽孢悬浮液,在32 ℃下反应,每10 min测一次OD600值,根据80 min内OD600值变化量计算酶活。
1.2.7.2 pH对皮层裂解酶活力的影响 分别调整酶液pH为4、5、6、7、8、9、10,酶液包含0.05 mol/L的磷酸钠缓冲液,再各取4 mL酶液,对照组取4 mL无菌水,再向各组加入1 mL脱芽孢衣芽孢悬浮液,在32 ℃下反应,每10 min测一次OD600值,根据80 min内OD600值变化量计算酶活。
1.2.7.3 磷酸钠浓度对皮层裂解酶活力的影响 将透析后酶液中的磷酸钠浓度分别调整为0.05、0.10、0.15、0.20、0.25、0.30、0.35 mol/L,酶液pH为7,再取4 mL酶液,对照组为4 mL无菌水,再向各组加入1 mL脱芽孢衣芽孢悬浮液,在32 ℃下反应,每10 min测一次OD600值,根据80 min内OD600值变化量计算酶活。
1.2.7.4 压力对皮层裂解酶活力的影响 将透析后的酶液(包含0.05 mol/L、pH=7.0磷酸钠缓冲液)分别于常压、150、200、250、300、350、400、450、530 MPa下处理15 min,取处理后的酶液4 mL,对照组为4 mL无菌水在常压放置15 min,再向各组加入1 mL脱芽孢衣芽孢悬浮液,在32 ℃下反应,每10 min测一次OD600值,根据80 min内OD600值变化量计算酶活。
1.2.7.5 HPTS处理对皮层裂解酶活力的影响 将磷酸钠浓度为0.05、0.35 mol/L的两种透析后的酶液于530 MPa、68 ℃下处理15 min,取处理后的酶液4 mL,对照组为4 mL透析后的酶液和4 mL无菌水在常温常压下放置15 min,再向各组加入1 mL脱芽孢衣芽孢悬浮液,在32 ℃下反应,每10 min测一次OD600值,根据80 min内OD600值变化量计算酶活。
1.3 数据处理
所有实验重复三次,实验结果均以平均值±标准差表示。数据采用Origin 8.0进行统计分析。
2 结果与分析
2.1 芽孢皮层裂解酶提取液中DPA测定
芽孢萌发渗出物中不但有皮层裂解酶,也有DPA,而DPA也会诱导芽孢萌发,从而干扰实验结果,为此通过透析处理来去除皮层裂解酶提取液中的DPA。通过全波段扫描可以看出在272.5 nm处DPA有最大吸收峰,因此选取272 nm作为检测波长。由图1b~c可知,DPA的出峰时间为4.64 min,而透析后的皮层裂解酶提取物仅在2.37 min时出现了一个峰,说明透析处理已将酶液中的DPA完全去除。
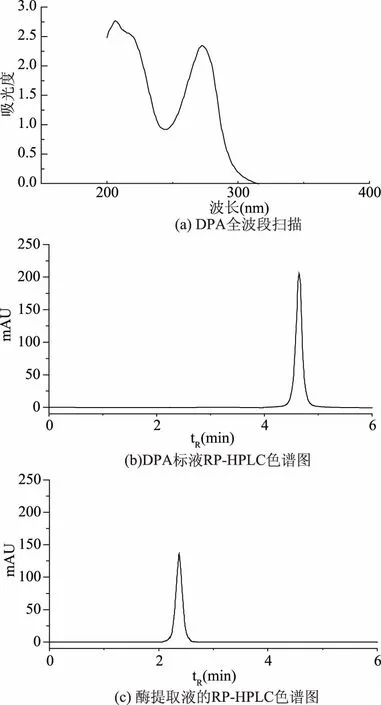
图1 芽孢皮层裂解酶提取液中DPA含量分析
2.2 温度对皮层裂解酶活力的影响
由图2可知,在4~44 ℃温度范围内时,芽孢悬浮液的OD600值与对照组相比,均显著下降(p<0.05),说明皮层裂解酶仍具活力,但是在此温度范围内,皮层裂解酶活力的变化并没有明显规律。而当温度升至68 ℃时,芽孢悬浮液OD600值与对照组基本没有变化,说明皮层裂解酶基本失活。Makino等[20]研究发现,60 ℃处理2 min或者45 ℃处理10 min时,分离出的皮层裂解酶就已经完全失活。Ando等[23]研究发现,当处理温度为45 ℃时皮层裂解酶活力最强,而当处理温度为60 ℃时酶活显著降低,处理时间为20 min时酶完全失活。这些研究报道与本实验的结果有细微差异,这可能与菌种有关,菌种不同,皮层裂解酶的分子量、分子结构不同,对温度的耐受程度也不同,但以上研究报道均表明,60 ℃以上的热处理会造成皮层裂解酶失活。
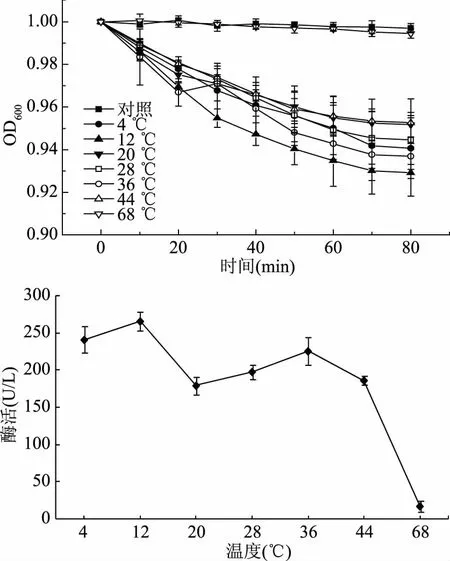
图2 温度对皮层裂解酶活力的影响
2.3 pH对皮层裂解酶活力的影响
由图3可知,皮层裂解酶对pH非常敏感,当pH为4~7时,随着pH的增大,芽孢悬浮液OD600值与对照组相比,下降幅度逐渐增大,说明皮层裂解酶活力逐渐增强;而当pH为7~10时,随着pH的增大,OD600值与对照组相比,下降幅度逐渐减小,说明皮层裂解酶活力逐渐降低。当pH为7时,OD600值的下降幅度最大,说明皮层裂解酶的活力最强。Miyata等[19]研究发现:当pH为7.2~8.4时,皮层裂解酶活力最佳,随着pH的减小,皮层裂解酶活力逐渐降低,当pH为3.4时,皮层裂解酶活力最低,这一研究报道与本实验结果基本一致。在研究其它因素对皮层裂解酶活力的影响时,将酶液的pH调整为7,以避免其对酶活的影响。
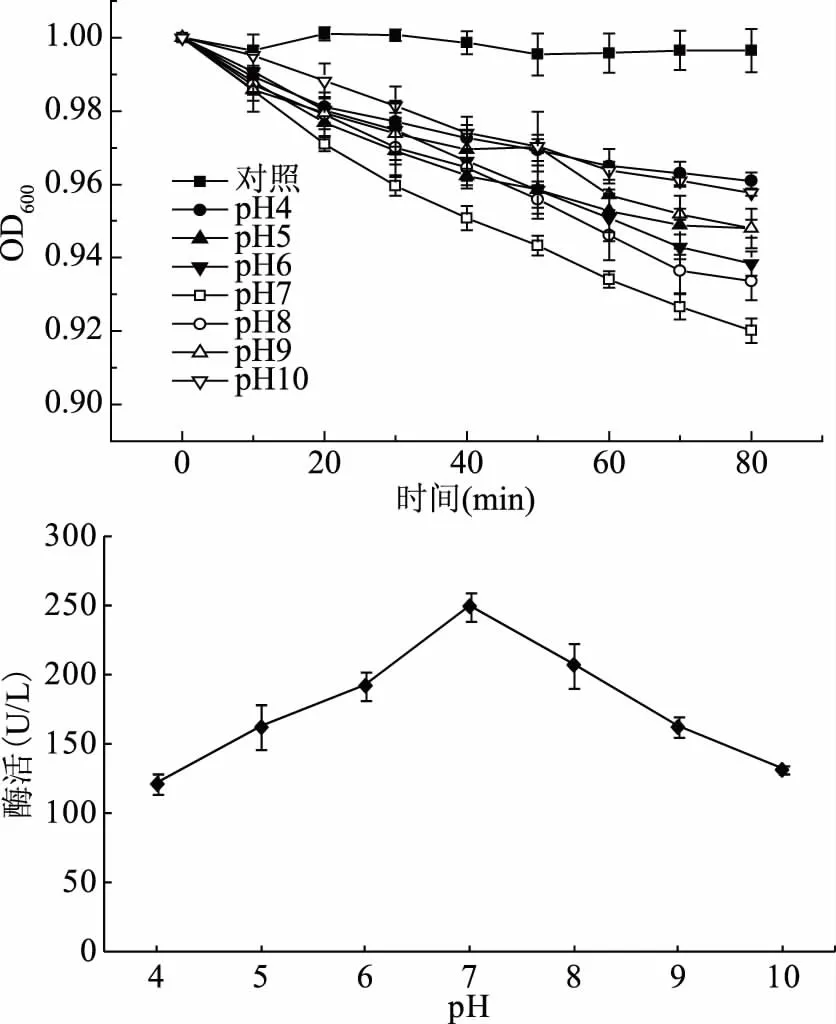
图3 pH对皮层裂解酶活力的影响
2.4 磷酸钠浓度对皮层裂解酶活力的影响
由2.3中的实验结果可知,pH是影响酶活性的一个重要因素,为维持稳定的pH,选用磷酸钠缓冲液,因此研究了磷酸钠浓度对皮层裂解酶活性的影响。由图4可知,随着磷酸钠浓度的增大,芽孢悬浮液OD600值与对照组相比,下降幅度变小,说明皮层裂解酶的活力逐渐降低。当磷酸钠浓度为0.05 mol/L时,OD600值与对照组相比,下降幅度最大,说明皮层裂解酶最具活力。而当磷酸钠浓度为0.35 mol/L时,皮层裂解酶活性最小。这可能是由于该酶的催化部位对离子浓度非常敏感,离子浓度对形成精确的三维结构位点起着重要作用[20],而高浓度钠盐形成的高渗透压作用及离子间静电作用破坏了某些酶结构,从而导致酶活性降低[24]。在研究其它因素对皮层裂解酶活力的影响时,将磷酸钠浓度调整为0.05 mol/L,以避免其对酶活的影响。
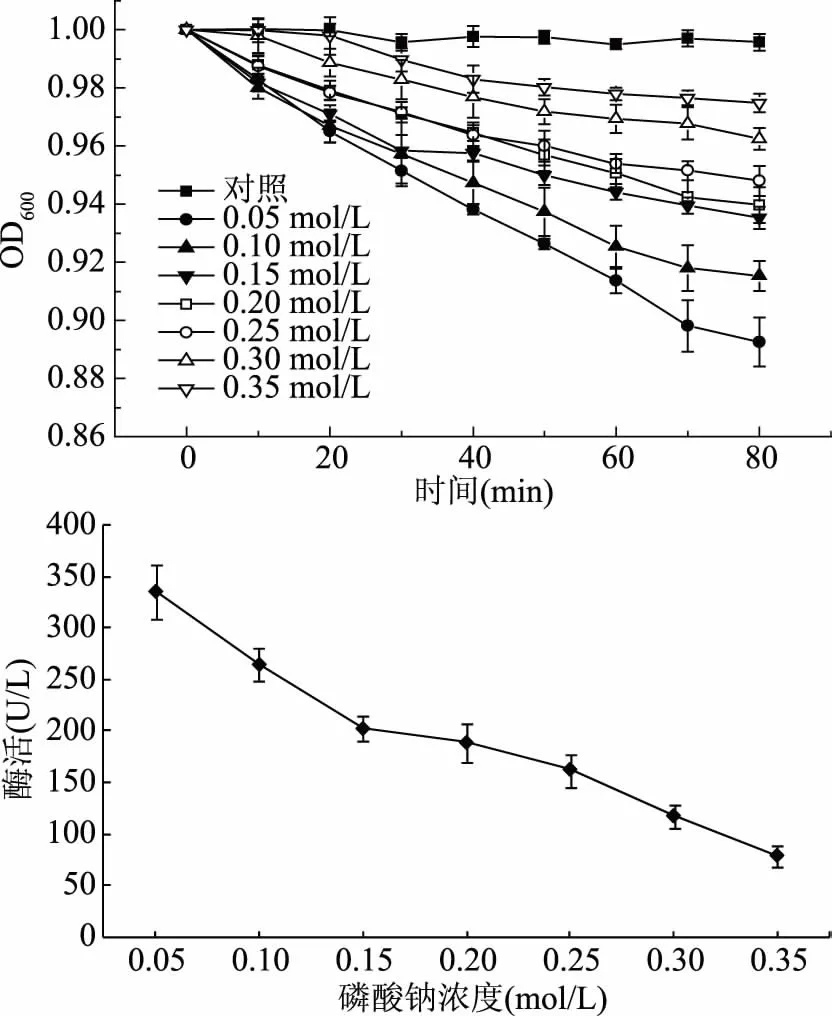
图4 磷酸钠浓度对皮层裂解酶活力的影响
2.5 压力对皮层裂解酶活力的影响
由图5可知,随时间增加,各处理压力下,芽孢悬浮液OD600值呈不断下降趋势,处理压力较低时,芽孢悬浮液OD600值与对照组相比下降速度较快,最终下降幅度较大。较常压相比,150、200 MPa下皮层裂解酶活力有所增强,当压力超过300 MPa时,皮层裂解酶活力逐渐降低,但仍无法灭活皮层裂解酶。有报道称超高压会改变酶的活力,郝梦甄等[25]研究发现在较低压力范围内,随着压力的升高,海参体壁粗酶的酶活逐渐升高,250 MPa处理时,酶活达到最高值。陈发庆等[26]研究超高压对核桃多酚氧化酶和过氧化物酶的影响时发现,当压力在200 MPa以下时,多酚氧化酶和过氧化物酶的活力随着压力升高而增大,但当压力超过200 MPa时,两种酶的活力随压力升高而逐渐减小。在超高压处理下,不同酶的活力变化是不同的,这是由于酶的种类和分子结构等不同而造成的。
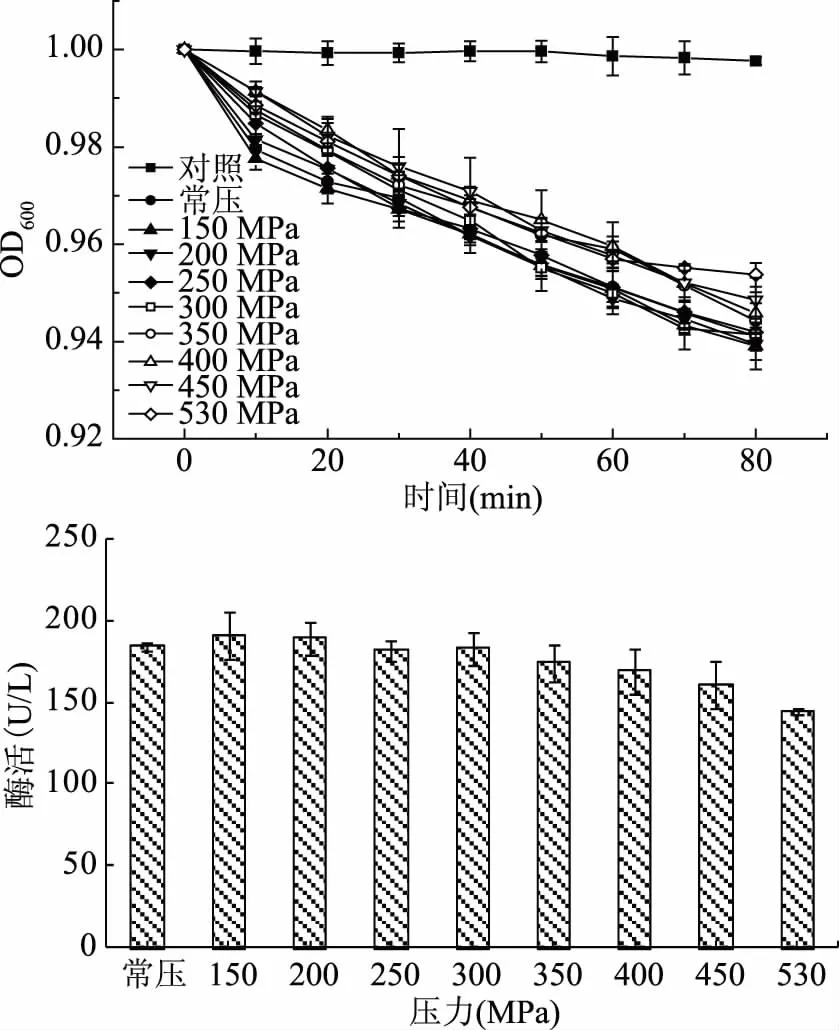
图5 压力对皮层裂解酶活力的影响
2.6 HPTS处理对皮层裂解酶活力的影响
由2.4中结果可知,0.05 mol/L磷酸钠浓度对皮层裂解酶活力影响最小,为进一步排除磷酸钠浓度对HPTS杀灭芽孢效果的影响,选用高纯水制备芽孢悬浮液以模拟天然的HPTS杀菌环境,发现HPTS处理下0.05 mol/L磷酸钠溶液(pH=7.0)中的芽孢死亡率和高纯水中芽孢死亡率无显著差异(p>0.05)。由图6可知,经530 MPa、68 ℃处理15 min后,0.05 mol/L磷酸钠溶液(pH=7.0)中的皮层裂解酶基本失活,表现为芽孢悬浮液OD600值基本无变化。有文献报道[14]:随压力和温度的变化,以压力和温度为横、纵坐标,酶构象和活力的变化呈现出一个椭圆形区域,在这个椭圆形区域内酶有活力,而在这个椭圆形区域外酶失活。实验结果表明,在530 MPa和68 ℃下,皮层裂解酶位于失活区域,HPTS处理不但没有激活皮层裂解酶,反而使得皮层裂解酶失去了活性,由此可推测HPTS处理下,芽孢皮层肽聚糖的水解方式是非酶水解,这对揭示HPTS杀灭细菌芽孢的机理有重要意义。

图6 HPTS处理对皮层裂解酶活力的影响
3 结论
本文研究了磷酸钠浓度、pH、温度和压力对枯草杆菌芽孢皮层裂解酶活力的影响,在此基础上研究了HPTS对该酶活力的影响。结果发现,皮层裂解酶的最适磷酸钠浓度为0.05 mol/L,当磷酸钠浓度为0.35 mol/L时,皮层裂解酶活力较低;最适pH为7,偏酸或偏碱性条件下,活力均有所降低;温度升至68 ℃时皮层裂解酶基本失活;在150~530 MPa压力范围内,压力对皮层裂解酶活性基本无影响,然而HPTS处理时(530 MPa、68 ℃、15 min),皮层裂解酶基本失活。HPTS处理下芽孢皮层肽聚糖水解机理仅有两种可能性,其一是HPTS激活皮层裂解酶,其二是HPTS导致皮层肽聚糖的非酶水解。实验结果表明,HPTS处理不但没能激活皮层裂解酶,反而导致了该酶的失活,由此可推测HPTS处理下芽孢皮层肽聚糖的水解方式是非酶水解。本实验推进了对HPTS杀灭芽孢机理的理解,有助于HPTS技术在食品工业中的应用。

