头孢克洛缓释片处方开发及释放度一致性研究
魏京璐,杨淑慎,王晓峰
(1.西北农林科技大学,陕西 杨凌 712100;2.扬子江药业集团有限公司,江苏 泰州 225300)
头孢克洛,属于2代口服头孢抗生素,其化学名称为:(6R ,7R)-7-[(R)-2-氨基-2-苯乙酰氨基]-3-氯-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸一水合物,即头孢氨苄第三位碳原子上的甲基被Cl所取代,因此又称头孢氯氨苄,分子式:C15H14ClN3O4S·H2O,头孢克洛的化学结构式:

图1 头孢克洛结构式Fig.1 Structure of Cefaclor
头孢克洛于1976年由美国礼来公司研制开发。具有抗菌作用强、耐青霉素酶,临床疗效高,毒性低等优点。目前头孢克洛国内市场已上市剂型有片剂、胶囊剂、颗粒剂、缓释微丸、缓释片、分散片等多个剂型。本文选择的参比制剂是由美国礼来公司研制开发的头孢克洛缓释片(II),商品名为CECLOR®,规格为375mg。本品采用湿法制粒的工艺,参照文献以羟丙甲纤维素为阻滞剂、乳糖为填充剂、80%乙醇溶液为粘合剂及硬脂酸镁为润滑剂[1],并对羟丙甲纤维素型号、规格进行了筛选,最终确定选用羟丙甲纤维素(K4M)为缓释材料。选择4%聚维酮K30的无水乙醇溶液作为粘合剂。文献显示,乳糖等还原性糖与头孢克洛会发生Maillard反应生成棕色产物[2],且乳糖含一分子结晶水,不适宜作为湿敏性药物的填充剂,故选取微晶纤维素(M101)及甘露醇来进行填充剂的筛选。
本文通过正交实验方法进行了头孢克洛缓释片处方组成及用量的筛选,确定了头孢克洛缓释片处方,并对产品与参比制剂进行释放度曲线对比,以判断两者体外释放度的一致性。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
0.1mol/L的稀盐酸;pH值4.0醋酸盐缓冲液;pH值6.8磷酸盐缓冲液;参比制剂—希刻劳? 头孢克洛缓释片Ⅱ(礼来苏州制药有限公司)规格:0.375g;头孢克洛对照品—中国药品生物制品检定所,含量:93.2%。
1.1.2 仪器
立式湿法混合制粒机HLSY-10型:上海心意制药机械设备有限公司;摇摆颗粒机YK-100/160型:南京东隆机械科技有限公司;热风循环烘箱RXH型:南京东隆机械科技有限公司;压片机ZP15D:上海天峰制药设备有限公司;溶出仪ZRS-8G:天津市天大天发科技有限公司;高效液相Agilent1200:安捷伦;电子天平AL204:梅特勒-托利多。
1.2 方法
1.2.1 处方制备方法
按照处方称取原辅料,将称取的原辅料(不包括粘合剂、润滑剂)混合后加入实验用小型湿法制粒机,干混10min,然后缓慢加入粘合剂,制粒3~4min。取出湿颗粒,用24目筛网在摇摆整粒机整粒,然后用热风循环烘箱,50℃干燥30~40min。取出干燥颗粒,混入硬脂酸镁。取混合后颗粒用压片机压片。取所得素片检测片重差异、释放度。实验筛选处方过程中共使用了九种处方,见表1。
1.2.2 释放度检验方法
取本品,按照《中国药典》2015版四部通则0931释放度测定法,采用溶出度测定法第一法(篮法)的装置,转速为100r/min,在1h、2h与4h分别取溶液7mL,滤过,并及时在操作容器中补充上述释放介质7mL;分别精密量取续滤液3mL,各置50mL量瓶中,释放介质稀释至刻度,照紫外-可见分光光度法,在267nm的波长处分别测定吸光度;另取头孢克洛对照品适量,用释放介质制成每1mL中约含25μg头孢克洛的溶液,同法测定,分别计算出每片在不同时间的释放度[3]。

表1 头孢克洛缓释片Ⅱ处方筛选Table 1 Prescription Screening of Cefaclor Sustained-releaseTablets II
2 结果与分析
2.1 处方筛选
按方法1.2.1制备处方,根据表1的处方组成及用量配比共制备了九组处方,压片后按照1.2.2方法分别检测每组处方产品的释放度,结果见表2。

表2 头孢克洛缓释片(Ⅱ)处方筛选结果Table 2 Prescription Screening of Cefaclor Sustained-releaseTablets II
由表2得知处方1和处方2样品释放度无明显差异,微晶纤维素(M101)作为填充剂可压性优于甘露醇,所以选择微晶纤维素(M101)为填充剂。
根据参比制剂释放度测定结果,我们对羟丙甲纤维素(K4M)的用量进行了筛选(处方3和处方4),结果显示单独采用羟丙甲纤维素(K4M)作为阻滞剂难以与参比制剂体外释药行为一致,故我们加入低黏度级别的羟丙甲纤维素E5和K100来调节本品的释药曲线。又处方5和处方6结果可以看出羟丙甲纤维素E5更优,释放度更接近,通过联合使用羟丙甲纤维素(K4M)和羟丙甲纤维素(E5),根据处方7、8、9调节用量配比,由结果可以看出处方9所制得的样品与参比制剂在0.1mol/L盐酸溶液中1h,2h,4h释放度均相似,所以确定处方9为最优处方。
2.2 释放度对比研究
为研究工艺验证产品与原研产品体外释药曲线的相似程度,我们采购了礼来苏州制药有限公司生产的希刻劳? 头孢克洛缓释片Ⅱ作为参比制剂,选取了一批产品为受试制剂,检测了他们在三种释放介质中的释放度[3],进行体外释药曲线相似性评价。

图2 水中释放度曲线对比Fig.2 Comparison of release curves in water


图3 0.1mol/L盐酸溶液中释药曲线Fig.3 Drug release curve in 0.1mol/L hydrochloric acid solution
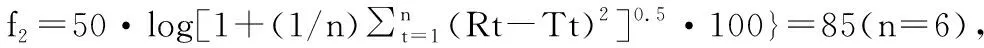

图4 pH值4.0醋酸盐缓冲液中释药曲线Fig.4 Drug release profile in pH4.0 acetate buffer

按照制定的处方工艺制作的产品与参比制剂在水、0.1mol/L盐酸溶液及pH值4.0醋酸盐缓冲液中体外释药曲线均相似[4],相似因子f2分别为82、85及87,符合国家规定,体外释放度相似。
3 结论
头孢克洛对湿热较敏感,本品现行工艺有效避免了主药与水的接触,并减小了温度的影响,从而保证了产品质量;本实验用微晶纤维素代替了文献中的乳糖做为填充剂,有效避免了贮存期间头孢克洛与乳糖发生美拉德反应的风险,保证了产品的质量稳定。经检测,本品与参比制剂在水、0.1mol/L盐酸溶液及pH值4.0醋酸盐缓冲液中的释药曲线均相似,相似因子均达到80%以上,且批间差异小,由此可以推断采用研究中的处方制备的样品与参比制剂体外释放度相似[5]。
4 讨论
头孢克洛缓释片是目前国内2代口服抗生素类中应用较为广泛的一个剂型,该产品以服用次数少、药效优良而广泛应用于市场。但是国内仿制药市场的质量和疗效良莠不齐严重影响了市场的发展和空间。原研药在药效方面虽然具备较大的优势,但是因为其价格居高不下,为医保增加了较大的经济负担。
自国家2016年开始大力推行一致性评价以来,头孢克洛的相关制剂做为第一批进入289目录的产品,受到了广大制药行业的关注。能够获得与原研一致的质量和疗效,是国产仿制药弯道超车的良机,同时也是行业内以质量和疗效为标准进行的新一轮洗牌。相信随着一致性评价的持续推进,国内的仿制药能够快速获得与原研药同等的质量,进而为国内患者的健康带来重大的福利和改善。
——读托马斯·克洛《18世纪巴黎的画家与公共生活》

