橘小实蝇神经肽sulfakinin的分子生物学特性及其表达模式
栗洪飞,郑莉莎,石 岩,王进军,蒋红波
西南大学植物保护学院,西南大学农业科学研究院,重庆 400716
橘小实蝇Bactroceradorsalis(Hendel),又名东方果实蝇,属双翅目Diptera实蝇科Tetriphitedae果实蝇属Bactrocera,是一种重大农业入侵害虫(陈韶萍等,2014)。橘小实蝇寄主范围广,可危害柑橘、番石榴、杨桃、芒果、香蕉、茄子、辣椒、瓜类等46科250多种水果和蔬菜(汪恩国等,2013;袁国瑞等,2016)。由于其极强的环境适应和入侵扩散能力,已被多个国家列为检疫对象,并且在热带和亚热带成为最具毁灭性的害虫之一(Clarkeetal.,2005)。尽管可以使用寄生蜂等对橘小实蝇进行生物防治,但目前最有效的控制方法仍是化学防治(Linetal.,2012)。近年来,橘小实蝇抗药性愈演愈烈,如何有效控制其危害,是目前全世界果蔬产业面临的一个严峻问题。
昆虫的神经肽是一类由昆虫神经系统分泌的微量高效能小分子蛋白质(多肽),是多细胞生物体内的重要信使(魏兆军和赵远,2005)。到目前为止,就多细胞生物体而言,昆虫神经肽是最大、种类最多的信号分子(Schoofsetal.,2017),调控着昆虫的许多重要生理过程,如生长、发育(Guietal.,2017)、取食(Hongetal.,2012;Wangetal.,2013)、记忆(Cervantes-Sandoval & Davis,2012)、生殖(Nilayetal.,2008)、代谢、遗传(Altstein & Nässel,2010)等。因此,神经肽信号调节系统被认为是理想的防治昆虫的杀虫靶标,如tachykinin(Nachmanetal.,2010)、滞育激素(diapaude hormone)(Zhangetal.,2011)、sulfakinin(Yuetal.,2013b)等。研究表明,sulfakinin与昆虫的取食有极密切的关系,调控多种昆虫的取食行为(Schoofsetal.,2017)。sulfakinins定位于交感神经系统和中枢神经系统,类似于哺乳类动物胃分泌素(Andersetal.,2000; Duveetal.,1994;Nichols & Lim,1995)。昆虫sulfakinins首次于马德拉蜚蠊LeucophaeamaderaeBrowse头部的提取物中分离得到(Nachmanetal.,1986)。随后,又在果蝇(Nicholsetal.,1988)、沙漠蝗SchistocercagregariaForsk (Weietal.,2000)、德国小蠊Blattellagermanica(L.)(Joseetal.,2001)等多种昆虫中发现。研究显示,注射sulfakinin后的亚洲飞蝗LocustamigratoriaL.减少了食物的摄取(Altstein & Nässel,2010),且与sulfakinin的注射量呈正相关(Zelsetal.,2015);德国小蠊在注射sulfakinin肽段后,减少了84%的食物摄取(Joseetal.,2001)。与之相反,利用RNAi抑制双斑蟋Gryllusbimaculatus(De Geer) 、赤拟谷盗TriboliumcastaneumHerbst的sulfakinin,其食物摄取量显著增加(Meyering-Vos & Müller,2007;Yuetal.,2013a);RNAi后果蝇出现摄食增加且取食行为异常的现象(Söderbergetal.,2012);nonsulfated sulfakinin(SK)参与调节大麦虫ZophobasatratusFab的幼虫和蛹期的糖类和类脂化合物代谢作用,影响其幼虫脂肪体和线粒体相关能量代谢活动(Slocinskaetal.,2016)。目前,sulfakinin被定位于许多昆虫的中枢神经系统,且又与昆虫的取食有密切关系,意味着其具有重要的生理功能以及良好的药靶潜力。
sulfakinin表达模式分析可为深入研究橘小实蝇sulfakinin的生理功能、药靶潜力提供基础数据,为靶向橘小实蝇重要神经肽信号传递系统、开发高度特异的控制剂奠定基础。橘小实蝇sulfakinin具有何种生理功能仍不得而知,是否具有药靶潜力亟需深入研究。本文以橘小实蝇为对象,克隆获得了神经肽sulfakinin的cDNA全长,并利用实时荧光定量PCR解析了其时空表达模式分析,为进一步研究橘小实蝇sulfakinin基因功能奠定基础,同时为以昆虫神经肽为靶标的新型杀虫剂的开发提供理论依据。
1 材料与方法
1.1 供试虫源
橘小实蝇于2007年采自云南省(云南品系),带回实验室后饲养于西南大学昆虫学及害虫控制工程重点实验室人工气候室内。饲养温度(27±1) ℃,饲养相对湿度(70±5)%,光周期14L∶10D。所有试虫均为人工饲料饲养。
1.2 主要试剂
高保真DNA聚合酶PrimerSTARTM Max Premix及PCR相关试剂、半定量PCR所用Taq酶及相关试剂均购自TakaRa公司,Trizol试剂购自Life Technologies公司,反转录试剂盒购自Promega公司,iQTM SYBR®Green Supermix购自Bio-rad公司。
1.3 样品的制备
加入Trizol试剂充分研磨,参照Trizol试剂说明书提取样品的总RNA,琼脂糖电泳检测总RNA的完整性,Nanodrop 2000 核酸浓度测定仪检测其浓度和纯度,使用RQ1 Rnase-Free Dnase去除基因组DNA,按照反转录试剂盒说明书进行反转录合成第一链cDNA,在-20 ℃冰箱中保存备用。
1.4 序列比对分析
在GenBank(XM_011207950)查询获得橘小实蝇sulfakinin序列;利用在线程序SignalP 4.1(http:∥www.cbs.dtu.dk/services/Signal P)预测信号肽(signal peptide);根据在线程序Neuro Pred(http:∥neuroproteomics.scs.uiuc.edu/neuropred.htm)预测成熟肽切割位点(dibasic cleavage sites);氨基酸序列比对分析通过DNAMAN、WebLogo等软件完成。通过MEGA5软件中的邻接法构建系统发育树,用在线工具WebLogo (http:∥weblogo.berkeley.edu/logo.cgi)作图;利用Primer premier 5.0软件设计橘小实蝇sulfakinin的特异性qPCR引物(表1),并用DNAMAN 6.0对所设计的引物进行评价。
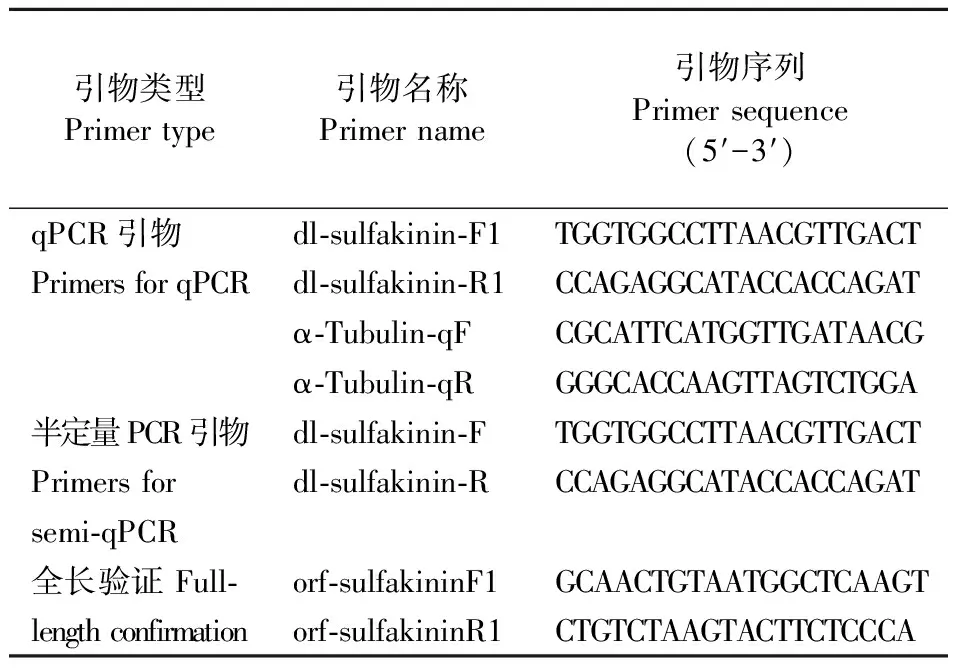
表1 研究所用引物序列Table 1 Primer sequences used in this study
1.5 sulfakinin表达模式分析
橘小实蝇不同发育阶段和不同组织表达模式的样品收集参照桂顺华(2017)方法:不同发育阶段选取卵(1 d)、幼虫(4 d)、蛹(4 d)、早期成虫(5 d)、晚期成虫(10 d);选取孵化后4日龄幼虫解剖不同组织,包括中枢神经系统、脂肪体、中肠、马氏管、气管和表皮;选取羽化后5日龄未交配的成虫解剖不同组织,包括中枢神经系统、脂肪体、中肠、马氏管、触角、精巢和卵巢。每个样品4个生物重复,总RNA提取和cDNA合成参照1.3。
根据GenBank查询获得的序列设计橘小实蝇sulfakinin特异性qPCR引物,同时采用橘小实蝇α-Tubulin作为内参基因(Shenetal.,2010)(GenBank登录号:GU269902)。qPCR反应体系如下:cDNA 0.5 μL、GoTaq®qPCR Master Mix 5 μL、ddH2O 3.5 μL、上下游引物各0.5 μL。反应条件为95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火30 s,60 ℃延伸30 s,进行40个循环,最后95 ℃后延伸30 s。每次实验技术重复2个,生物重复4次。
利用2-△△Ct法(Livak & Schmittgen,2001)对数据进行分析。其中,不同发育阶段表达模式研究中,晚期成虫相对表达量设置为校准值;成虫不同组织表达模式研究中,成虫触角组织的相对表达量设置为校准值;幼虫不同组织表达模式研究中,幼虫中肠组织的相对表达量设置为校准值。
1.6 半定量检测sulfakinin相对表达量
以反转录合成的第一链cDNA为模板,采用巢式PCR扩增,体系为25 μL:cDNA 1 μL、ddH2O17.375 μL、buffer (Mg+) 2.5 μL、dNTP 2 μL、rTaq 0.125 μL、上下游引物各1 μL。反应条件为98 ℃预变性3 min,98 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,sulfakinin扩增进行35个循环,内参α-Tubulin扩增进行30个循环,最后72 ℃后延伸10 min。用1.5%琼脂糖凝胶电泳检测。
1.7 饥饿胁迫
分别挑取4头经饥饿处理6、12、24 h的橘小实蝇羽化后5日龄的成虫,加入Trizol充分研磨,总RNA提取和cDNA合成参照1.2,每个处理4个生物重复,每个生物重复雌雄各2头且只取头部。
2 结果与分析
2.1 sulfakinin的序列分析
利用RT-PCR技术,克隆获得了橘小实蝇sulfakinin的cDNA全长序列(GenBank登录号:XM_011207950)。cDNA全长417 bp,编码138个氨基酸。5′端前30个氨基酸残基为信号肽序列;前体包含2个成熟肽(图1)。其成熟肽C端具有典型的sulfakinin基序GHMRFamide(图2)。
将sulfakinin编码的氨基酸序列与GenBank登录的其他昆虫的sulfakinin氨基酸序列进行比对(表2),并通过MEGA 5软件中的邻接法构建系统发育树,各分支重复检验次数均为1000。结果表明,橘小实蝇与黑腹果蝇Drosophilamelanogaster的sulfakinin亲缘关系最近,且聚为一支(图1A)。各目的昆虫均单独成一支,与传统的分类关系一致,说明昆虫sulfakinin在进化上具有较好的保守性。

图1 Sulfakinin的序列分析Fig.1 Sequence analysis of sulfakininA:Sulfakinin系统发育分析;B:5种不同昆虫sulfakinin成熟肽序列比对分析。A:Phylogenetic relationships analysis of sulfakinin; B:The alignment of five kinds of insect mature peptides.

图2 Sulfakinin基因全长序列及其编码的氨基酸序列Fig.2 The nucleic acid sequence of sulfakinin and the deduced amino acid (AA) sequence*:终止子,成熟肽用下划线代表。*:Terminator,the underline represents the mature peptide.
表2 不同昆虫sulfakinin的GenBank登录信息Table 2 The GenBank ID of sulfakinin of some insects
通过与果蝇、赤拟谷盗、冈比亚按蚊AnophelesgambiaeSay、长红猎蝽RhodniusprolixusStal五者之间sulfakinin成熟肽序列的比对,发现橘小实蝇与黑腹果蝇,长红猎蝽等的sulfakinin都具有较高的保守性(图1B)。橘小实蝇和果蝇的sulfakinin1序列完全一致,sulfakinin2序列有2个异常的氨基酸残基,橘小实蝇N端第三、第四位置是2个谷氨酸(E),而果蝇在对应位置是2个谷氨酰胺(Q)。此外,橘小实蝇、黑腹果蝇与冈比亚按蚊三者的sulfakinin成熟肽都具有完全一致的序列FDDYGHMRFamide。长红猎蝽sulfakinin1与赤拟谷盗sulfakinin2分别具有一个差异的氨基酸残基。赤拟谷盗的sulfakinin1 N端第三个位置的苯丙氨酸(F)残基替换成丝氨酸(S)残基,长红猎蝽的sulfakinin2 C端第三个位置的组氨酸(H)残基被替换为酪氨酸(Y)残基。
2.2 橘小实蝇sulfakinin的时空表达模式
2.2.1 橘小实蝇不同组织的表达特性 橘小实蝇成虫的不同组织中,sulfakinin在中枢神经系统的表达量显著高于其他组织(P<0.05),约为触角的2倍,在触角的相对表达量仅次于中枢神经系统,且显著高于其他组织(P<0.05)。sulfakinin在脂肪体、中肠、马氏管、卵巢和精巢中表达量很低或几乎不表达(图3)。半定量PCR结果与之对应。
在橘小实蝇幼虫的不同组织中,sulfakinin在中枢神经系统中显著高表达(P<0.05),在脂肪体、中肠及马氏管中均有一定程度的表达,在表皮和气管中表达量极低或几乎不表达(图4)。其中,sulfakinin在中肠的表达量约等于马氏管,约为中枢神经系统表达量的1/3;脂肪体中的相对表达量低于中肠和马氏管,高于表皮;在气管中的相对表达量最低,几乎不表达。半定量PCR结果与之对应。
2.2.2 橘小实蝇不同发育阶段的表达特性 在橘小实蝇的不同发育阶段,sulfakinin在卵期几乎不表达,在蛹期有一定量的表达,在幼虫、早期成虫、晚期成虫显著高表达(P<0.05)(图5)。其中,sulfakinin在早期成虫中的相对表达量约为晚期成虫的2倍,幼虫时期的相对表达量居于早期成虫与晚期成虫之间,晚期成虫的相对表达量在这3个时期最低。半定量PCR结果与之对应。
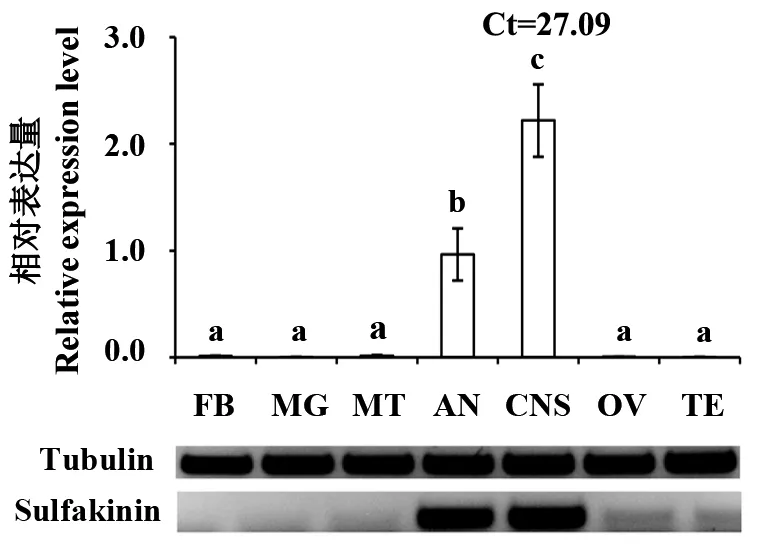
图3 Sulfakinin在橘小实蝇成虫不同组织的表达模式Fig.3 The expression profiles of sulfakinin in different adult tissues of B.dorsalis柱上不同字母表示经LSD多重比较后差异显著。半定量检sulfakinin在橘小实蝇成虫不同组织的相对表达量。FB:脂肪体;MG:中肠;MT:马氏管;AN:触角;CNS:中枢神经系统;OV:卵巢;TE:精巢。Different letters above the column indicate significant difference at P<0.05.Semi-quantitative RT-PCR detection of sulfakinin levels in different adult tissues of B.dorsalis.FB:Fat body;MG:Midgut;MT:Malpighian tube;AN:Antennae;CNS:Central nervous system;OV:Ovary;TE:Testis.
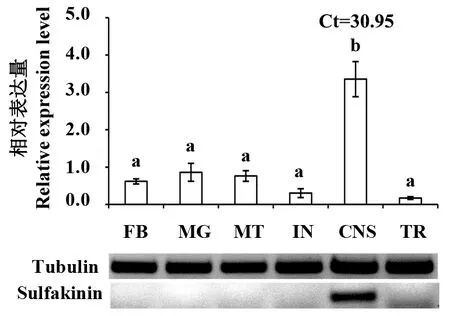
图4 sulfakinin在橘小实蝇幼虫不同组织的表达模式Fig.4 The expression profiles of sulfakinin in different larval tissues of B.dorsalis柱上不同字母表示经LSD多重比较后差异显著。半定量检测sulfakinin在橘小实蝇幼虫不同组织的相对表达量。FB:脂肪体;MG:中肠;MT:马氏管;IN:表皮;CNS:中枢神经系统;TR:气管。Different letters above the column indicate significant difference at P<0.05.Semi-quantitative RT-PCR detection of sulfakinin levels in different larval tissues of B.dorsalis;FB:Fat body;MG:Midgut;MT:Malpighian tube;IN:Skin;CNS:Central nervous system;TR:Tracheal.
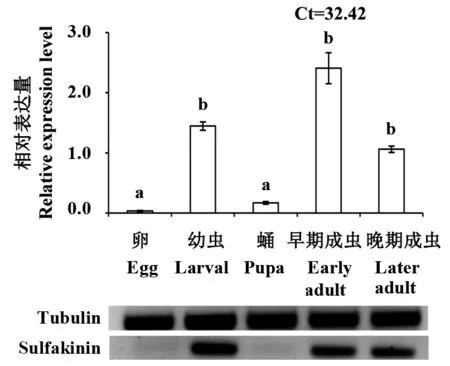
图5 Sulfakinin在橘小实蝇不同发育阶段的表达模式Fig.5 The expression profiles of sulfakinin in different developmental stages of B.dorsalis柱上不同字母表示经LSD多重比较后差异显著。半定量检测sulfakinin在橘小实蝇成虫不同组织的相对表达量。Different letters above the column indicate significant difference at P<0.05.Semi-quantitative RT-PCR detection of sulfakinin levels in different developmental stages of B.dorsalis.
2.3 sulfakinin在饥饿胁迫下的表达模式
橘小实蝇成虫在饥饿胁迫下,sulfakinin表达量随时间发生变化。结果显示,橘小实蝇成虫饥饿6 h后,sulfakinin的相对表达量为0.31,低于对照的0.58;随着饥饿时间不断延长,sulfakinin的表达量呈下降趋势;饥饿12 h后,sulfakinin的表达量达0.18,低于对照的0.26;24 h后,sulfakinin表达量为0.20,低于对照的0.27;总体来看,饥饿处理后成虫sulfakinin相对表达量均低于对照组,其中,饥饿6 h处,sulfakinin的表达量下降幅度最大。
3 讨论
本研究通过与其他昆虫sulfakinin编码氨基酸序列比较发现,黑腹果蝇、拟果蝇、赤拟谷盗等昆虫的sulfakinin单独聚为一簇;通过与其他昆虫的sulfakinin成熟肽序列的比对发现,橘小实蝇与黑腹果蝇、赤拟谷盗、冈比亚按蚊、长红猎蝽等的sulfakinin1和sulfakinin2均相似度很高,这表明物种之间的sulfakinin均有很好的保守性。
大量研究证实,sulfakinin调控昆虫对食物的摄取,这与本研究中sulfakinin在橘小实蝇不同发育时期表达模式结果一致,sulfakinin在幼虫、成虫期等取食高峰期抑制试虫过量取食而高表达,而在卵期和蛹期无取食行为时期则几乎不表达。
本研究发现,sulfakinin在橘小实蝇成虫和幼虫气管中高表达,而在幼虫和成虫的其他组织表达量很低或几乎不表达,这与在反吐丽蝇CalliphoravomitoriaL.(Duveetal.,1994)、美洲大蠊Periplanetaamericana(L.)(Eastetal.,1997)及黑腹果蝇(Nichols & Lim,1995)中的研究结果相似。研究还发现,sulfakinin在橘小实蝇成虫的触角中也显著性高表达。由于触角是昆虫感觉系统的重要组成部分,行使嗅觉,感受气流、CO2、湿度和温度等功能,左右其选择食物、取食、躲避危险等一系列行为。这暗示橘小实蝇sulfakinin在外周神经系统也扮演着重要角色,极有可能与嗅觉相关。
Sulfakinin在橘小实蝇早期成虫中的表达量约为晚期成虫的2倍。羽化不久的早期成虫需要补充营养以达到性成熟,尤其在鳞翅目和双翅目昆虫的生殖活动起重要作用。因此,早期成虫比晚期成虫的sulfakinin表达量的差异极大可能与此有关。
Sulfakinin在橘小实蝇幼虫脂肪体有一定程度的表达,其是否承担脂肪体和线粒体的相关能量代谢还有待进一步研究。另有研究表明,双斑蟋肠道有sulfakinin基因的表达(Meyering-Vos & Müller,2007),然而,sulfakinin在橘小实蝇中肠没有显著性表达,这暗示sulfakinin在橘小实蝇与双斑蟋之间可能承担着截然不同的生理功能。
研究表明,sulfakinin是类似于哺乳类动物胃分泌素或肠促胰酶肽,有减少食物消耗的作用(Joseetal.,2001; Nachmanetal.,1986)。本研究结果显示,橘小实蝇成虫在饥饿过程中,sulfakinin表达量起初下降幅度最大,随时间推移,下降幅度减小,但仍低于对照组,暗示sulfakinin参与了饥饿调节过程。究竟其如何调节橘小实蝇对饥饿的响应过程仍需进一步研究。

