一例猪瘟和猪伪狂犬病的鉴别诊断
滕金玲 李 清 陈为峰 刘 鹏 陈忠霞 谭善杰
(1山东省莒南县动物疫病预防控制中心,山东临沂 276600;2山东省临沂市畜牧兽医检测中心,山东临沂 276003;3山东省临沂市动物疫病预防控制中心,山东临沂 264205;4山东省临沂市畜牧站,山东临沂 276600)
1 发病情况
某猪场饲养21头母猪,产后20日龄左右仔猪出现腹泻、高热、偶有呕吐或盲目运动。抗生素药物治疗无效,同窝死亡率达100%,怀疑患有伪狂犬病。后又出现3窝发病,养猪场主电话求诊。通过了解情况得知该猪场未做任何疫苗免疫,之前生产状况稳定。
1.1 临床观察
3窝发病仔猪为25~30日龄,已隔离。患病仔猪排黄色或黄褐色粘稠稀便,消瘦,食欲减少或废绝,四肢无力,走路摇摆,眼屎增多,眼窝下陷,浑身被粪便污染脏腻。测量体温大都在40.5℃以上,呼吸快,耳尖稍紫,个别病猪呕吐或有神经症状。
1.2 剖检观察
每窝各剖检1头病死仔猪,剖检症状基本相似。死猪肌肉干燥,脱水严重,血液稀薄,肺脏、肾脏呈点状出血,肠内容物为黄色或褐色,淋巴结肿大出血,胃空瘪,其中1头膀胱有零星出血点,其他脏器无病变。
2 实验室检测
对3窝猪进行前腔静脉采血,每窝采集母猪血液和2头患病活仔猪血液,共采9份,编号为1~9号。第一窝:母猪1号,仔猪2号,仔猪3号;第二窝:母猪4号,仔猪5号,仔猪6号;第三窝:母猪7号,仔猪8号,仔猪9号。将9份血样2 000转/分钟离心5分钟后,取出血清备用。
2.1 猪瘟病毒抗体检测
猪瘟病毒抗体检测试剂盒采用美国(IDEXX)生产的ELISA检测试剂盒。具体操作步骤按说明书进行。使用前,所有试剂和微量包被反应板在22℃室温下放置2小时,并通过轻轻涡旋、旋转混匀。
2.1.1 判定方法
阴性对照平均OD450nm=1.076>0.500,阳性对照阻断率=86.2%>50%,试验成立。
计算被检样本阻断率=(阴性对照平均OD450nm-样本OD450nm)/阴性对照平均OD450nm×100%。
如果被检样本的阻断率≤30%,该样本被判为阴性,无猪瘟抗体存在;被检样本阻断率>40%,该样本被判为阳性,有猪瘟抗体存在;如果被检样品阻断率在30%~40%之间,该样本判为可疑。
2.1.2 检测结果
由表1可知,母猪在没有免疫猪瘟疫苗的情况下,猪瘟抗体阻断率分别达到94%、93%、92%,应视该抗体为野毒抗体,该母猪为猪瘟病毒带毒猪。6头患病仔猪的猪瘟病毒抗体阻断率很低,均在30%以下,且均为负值,说明患病仔猪猪瘟抗体阴性,无猪瘟抗体存在,猪瘟感染风险性大。
2.2 猪瘟病毒抗原检测
猪瘟病毒抗原检测试剂盒采用美国(IDEXX)的ELISA检测试剂盒。使用前,所有试剂和微量包被反应板在22℃室温下放置2小时,并通过轻轻涡旋、旋转混匀。整个试验过程严格操作程序,且不同的样本和试剂使用不同的吸头。2.2.1 判定方法
阳性对照OD的平均值(1.000)与阴性对照OD的平均值(0.085)之差为0.915,大于0.150;阴性对照OD的平均值为0.085,小于0.250,试验成立。计算S-N值,即样品S(OD450nm)与阴性对照N(OD450nm)的平均值之差。被检样本S-N值≤0.100判为阴性;被检样本S-N值>0.300判为阳性,即为感染猪瘟;被检样本0.100<S-N值<0.300,判为可疑。
2.2.2 检测结果
2号、3号、5号、6号、8号、9号6头患病仔猪的猪瘟病毒抗原S-N值均很高,大于0.3(见表2)。表明6头患病仔猪都感染了猪瘟病毒,并且已呈现出明显的临床症状,说明6头患病仔猪均在猪瘟感染发病期(病毒血症期)。
2.3 猪伪狂犬病毒gE抗体检测
猪伪狂犬病毒 gpI(gE) 抗体检测采用美国(IDEXX)检测试剂盒。使用前,所有试剂和微量包被反应板恢复至室温(18~26℃),并通过轻轻涡旋、旋转或颠倒混匀。整个实验过程严格操作程序,且不同的样本和试剂使用不同的吸头。
2.3.1 判定方法
阴性对照N(OD650nm)的平均值(0.879)减去阳性对照P(OD650nm)的平均值(0.169)等于0.71,大于0.300,试验成立。计算S/N值,即样品S(OD650nm)与阴性对照N(OD650nm)的平均值之比。被检样本S/N值≤0.60判为阳性,即被伪狂犬野毒感染;被检样本S/N值>0.60判为阴性;被检样本0.60<S/N值≤0.70,判为可疑,过一段时间后需要重新检测。
2.3.2 检测结果
1~9号9头猪伪狂犬病毒gE抗体S/N值均为阴性,且gE抗体水平基本一致,表明均未感染猪伪狂犬病毒(表3)。
2.4 猪伪狂犬病毒gB抗体检测
猪伪狂犬病毒gB抗体检测采用美国(IDEXX)ELISA试剂盒。使用前,所有试剂和微量包被反应板一律恢复至室温(18~26℃),并通过轻轻涡旋、旋转或颠倒混匀。
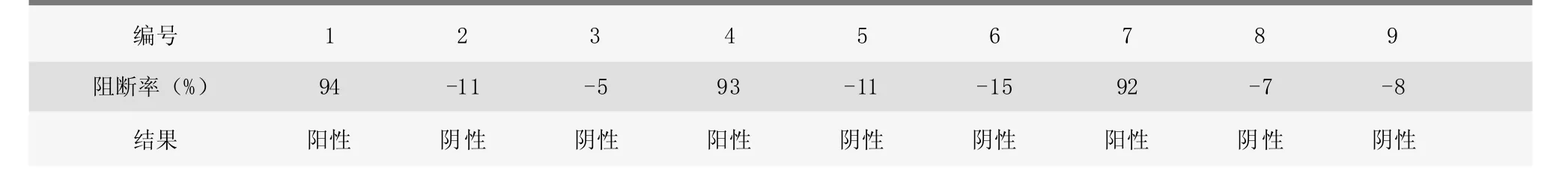
表1 猪瘟病毒抗体阻断率
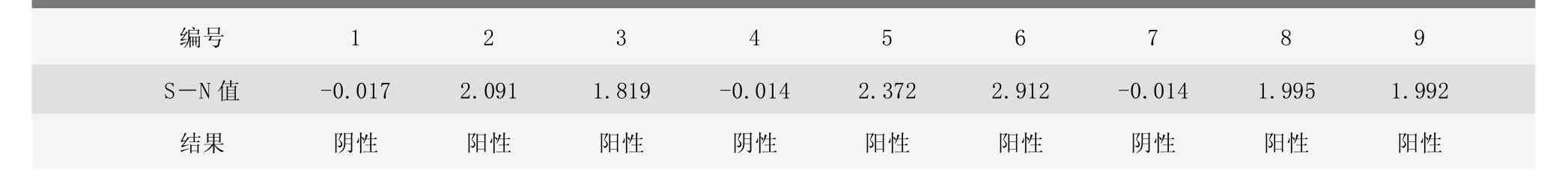
表2 猪瘟病毒抗原S-N值
2.4.1 结果有效性
阴性对照N(OD650nm)的平均值(1.315)减去阳性对照P(OD650nm)的平均值(0.101)等于1.214,大于0.300,试验成立。计算S/N值,即样品S(OD650nm)与阴性对照N(OD650nm)的平均值之比。结果判定:被检样本S/N值≤0.60判为PRV抗体阳性;被检样本S/N值>0.60判为PRV抗体阴性;被检样本0.60<S/N值≤0.70,判为可疑,过一段时间后需要重新检测。
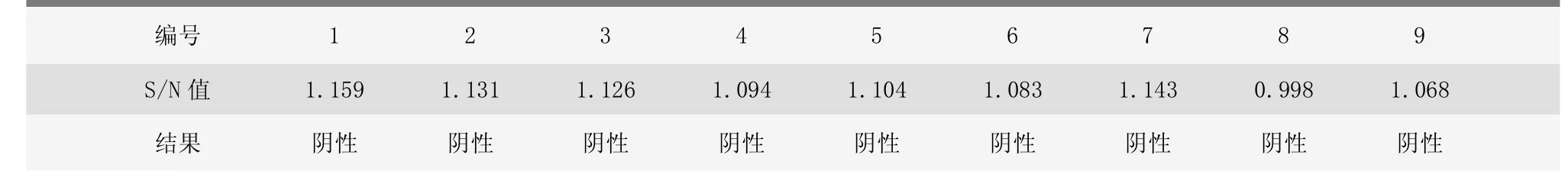
表3 伪狂犬病毒gE抗体S/N值
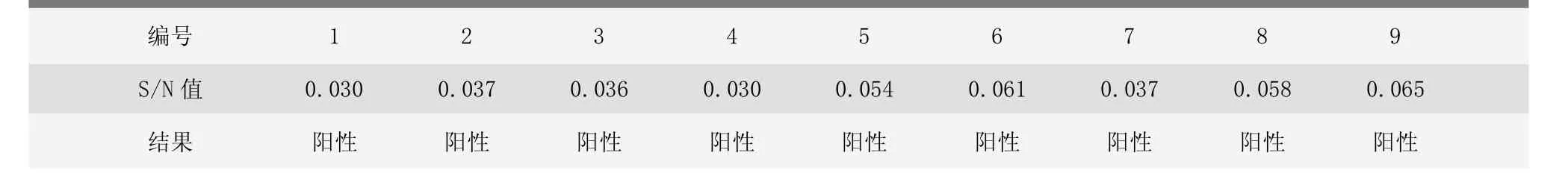
表4 伪狂犬病毒gB抗体S/N值
2.4.2 检测结果
9头猪伪狂犬病毒gB抗体S/N值均为阳性,且gB抗体水平基本一致,说明1~9号猪伪狂犬病毒抗体状况稳定(表4)。
3 诊断结论
由以上结果分析得出,该猪场发病猪为猪瘟感染病例,而非伪狂犬病病例。
4 总结
4.1 猪瘟和猪伪狂犬病临床相似点
体温高(40.5℃以上)、眼分泌物多、呼吸快、组织末梢发紫,皮下有出血点,呕吐,出现神经症状,拉黄色稀便,肾脏和肺脏呈点状出血,有扁桃体出血、坏死等症状。
4.2 猪瘟和猪伪狂犬病临床不同点
⑴病原不同:猪瘟病毒是黄病毒科、瘟病毒属、RNA病毒;猪伪狂犬病毒是疱疹病毒科、水痘病毒属、DNA病毒。
⑵临床症状不同:猪瘟呈现全身皮下出血点或斑,甚至大面积融合性出血,重者全身呈“紫罗兰”色。猪瘟表现全身组织、器官泛性出血,后期皮肤苍白或黄染,高热稽留,仔猪腹泻,粪便起初黄色粘稠,后期褐色,中大猪尿液为黄褐色,粪便干稀交替,甚至血便等。
猪伪狂犬病呈现腹下或腹股沟皮下出血点,少数病例会出现皮肤坏死,仔猪呕吐、腹泻、拉黄白色稀便、转圈等盲目运动,叫声嘶哑,耳朵直立,目光呆直,趋暗避光,中大猪顽固性咳嗽,后躯麻痹;母猪流产、木乃伊胎,屡配不孕不发情或情期不规律;公猪睾丸、精液质量下降等。
⑶剖检病变不同:猪瘟以出血为主。典型猪瘟病例呈现全身组织器官的广泛性出血,包括心、肝、脾、肺、肾、肠、胃、膀胱、肋骨、肌肉、脂肪等,喉头出血,淋巴结周边出血,脾脏出血性坏死,回盲结处钮扣状溃疡灶,血凝不良等。
猪伪狂犬病以坏死为主。某些器官心、肝、脾、肺、肾等出现白色、颗粒状、凝固性、米粒至豆粒大小的坏死灶,淋巴结肿大坏死、质地坚硬、红白相间;扁桃体、喉头气管坏死,颌下、胃部、肠系膜水肿等。
4.3 小结
猪瘟和猪伪狂犬病分别是由不同的病毒引起的病毒性疾病,但是在临床发病中,很多时候表现出相似的临床症状和剖检变化,凭经验和肉眼难以做出诊断。因此,必须采用实验室诊断方法才能进行确诊。实践中,采用血清学ELISA方法进行猪瘟抗原、猪瘟抗体和猪伪狂犬病毒gE抗体检测,进行鉴别性诊断;或采集相应病料用PCR方法进行猪瘟和猪伪狂犬病的病原学检测加以确诊,这两种方法可操作性强,结果精准,是兽医实验室检测猪病的常用方法。

