水涝胁迫下冬瓜幼苗的形态结构及生理响应差异分析
弭宝彬 武芳芳 谢玲玲 戴雄泽 周火强


摘要:【目的】分析水涝胁迫下涝耐受型冬瓜RW101和涝敏感型冬瓜SW15幼苗的形态结构及生理响应差异,为获得冬瓜耐涝性指标及创制耐涝冬瓜种质资源提供理论依据。【方法】对5叶1心期的涝耐受型冬瓜RW101和涝敏感型冬瓜SW15分别进行水涝胁迫0、24、48、72和96 h处理,对比分析其应对水涝胁迫的形态结构及生理响应差异。【结果】RW101在水涝胁迫48 h后即可萌发不定根,且随水涝胁迫时间延长,不定根数量和长度明显增加;SW15在水涝胁迫72 h后才萌发不定根,且数量和长度均显著低于RW101(P<0.05,下同);除丙二醛(MDA)含量外,RW101的净光合速率(Pn)、幼苗存活率、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、乙醇脱氢酶(ADH)活性、羟自由基去除能力、脯氨酸(Pro)及可溶性糖含量均显著高于SW15。【结论】涝耐受型冬瓜RW101和涝敏感型冬瓜SW15幼苗的形态结构和生理指标在水涝胁迫下存在明显差异,可作为冬瓜种质资源耐涝性评价的参考指标。
关键词: 冬瓜;水涝胁迫;形态结构;生理活性
中图分类号: S642.3 文獻标志码: A 文章编号:2095-1191(2018)12-2419-06
Differences in morphological structure and physiological response of wax gourd seedlings under waterlogging stress
MI Bao-bin1, WU Fang-fang2, XIE Ling-ling1, DAI Xiong-ze1, ZHOU Huo-qiang1*
(1Research Institute of Vegetables, Hunan Academy of Agriculture Sciences, Changsha 410125, China; 2College of Science, Hunan Agriculture University, Changsha 410128, China)
Abstract:【Objective】In order to obtain the waterlogging tolerance index of wax gourd and provide the reference for establishing the germplasm resources of wax gourd with resistance to waterlogging,the morphological structures and phy-siological responses of seedlings of tolerant wax gourd RW101 and sensitive wax gourd SW15 under waterlogging stress were analyzed. 【Method】The waterlogging tolerant wax gourd RW101 and sensitive wax gourd SW15 were flooded for 0,24,48,72 and 96 h respectively during the 5-leaf and one-phyllophore stage. The differences of the morphological structures and physiological responses of the two wax gourd materials in response to waterlogging were analyzed. 【Result】RW101 germinated adventitious roots after flooding for 48 h,and the number and length of adventitious roots increased greatly with the extension of flooding time.Adventitious roots of SW15 appeared after flooding for 72 h,and the number and length of SW101 were significantly lower than RW101(P<0.05, the same below). Except malondialdehyde(MDA) content,net photosynthesis rate(Pn),seedling survival rate,catalase(CAT) activity,peroxidase(POD) activity,alcohol dehydrogenase(ADH) activity,hydroxyl radical scavenging ability,proline(Pro) and soluble sugar content of RW101 were significantly higher than those of SW15. 【Conclusion】 There are large differences in morphological structures and physiological indexes of seedlings between tolerant wax gourd RW101 and sensitive wax gourd SW15 under waterlogging stress,which can be used as reference indexes for evaluation of waterlogging tolerance of wax gourd germplasm resources.
Key words: wax gourd; waterlogging stress; morphological structure; physiological activity
0 引言
【研究意义】冬瓜(Benincasa hispida Cogn.)是重要的葫芦科作物,在我国常年播种面积达32万ha,占世界种植面积的70%左右。冬瓜具有产量高、耐储便运等优点,在保证蔬菜周年均衡供应及南菜北运方面发挥重要作用(Jiang et al.,2013,2015)。洪涝灾害是限制作物生产的重要逆境(Bailey-Serres and Voesenek,2012),我国约2/3的国土面积存在不同程度的洪涝灾害,也是我国的主要农业灾害。冬瓜生产过程中经常会遇到洪涝灾害,给冬瓜生产带来严重影响。因此,分析水涝胁迫下涝耐受型冬瓜的形态结构及其生理响应,对获得冬瓜耐涝性指标及创制耐涝冬瓜种质资源具有重要意义。【前人研究进展】洪涝灾害可分为湿害和涝害(刘周斌等,2015),但水分本身不会对植物造成伤害,洪涝危害的实质是造成土壤缺氧,降低植物根际氧浓度而形成低氧和无氧状态(Sairam et al.,2009)环境,引起植物的生理生化、形态和解剖学结构發生变化。水涝胁迫时,植物根系形态发生一系列变化及根系活力降低,严重时甚至会因沤根而导致萎蔫、死苗(Mi et al.,2013)。涝害对植物的威胁主要是消耗细胞储存的能量和碳水化合物(Bailey-Serres and Brindon,2008;Colmer and voesenek,2009),而植物对水涝胁迫的适应主要表现为对积水或突然过湿的适应和抵抗能力增强,即耐胁变性和避胁变性,其中,耐胁变性的植物主要通过节约能源和碳水化合物以忍耐缺氧,延长其在水下生存的时间;避胁变性的植物在水涝条件下会发生一系列的形态和解剖结构变化以促进水下器官进行气体交换,阻止植物缺氧(Fukao et al.,2011),如植物在水涝胁迫下可形成通气组织(僧珊珊等,2012;Broughton et al.,2015)、产生不定根(Zhang et al.,2015)、增强相关酶活性(Laura et al.,2012;Puyang et al.,2015)或改变代谢途径(Rocha et al.,2010)以应对逆境胁迫。已有研究表明,植物在水涝胁迫下其体内的氧化酶活性升高及低级氧化产物丙二醛(MDA)持续积累,使细胞膜上的蛋白质和生物酶等失活,生物膜的结构和功能受到破坏,影响细胞的正常物质代谢(Ashraf,2012;Cheng et al.,2016)。【本研究切入点】目前,关于冬瓜耐涝方面的研究较少,而可评价与冬瓜耐涝性相关生理及形态结构指标的研究尚无报道。【拟解决的关键问题】对涝耐受型冬瓜RW101和涝敏感型冬瓜SW15进行水涝胁迫,分析其耐涝相关形态结构及生理响应的差异,为冬瓜耐涝性评价及耐涝冬瓜种质资源筛选提供参考依据。
1 材料与方法
1. 1 试验材料
供试材料为耐涝性差异明显的两份冬瓜材料,分别为涝耐受型RW101和涝敏感型SW15,均为湖南省蔬菜研究所冬瓜课题组通过大田水涝胁迫从500余份冬瓜资源中筛选获得的耐涝极端差异材料,二者田间表现整齐一致,生长势强,主蔓第18节左右现第一雌花,中晚熟,产量达150 t/ha,瓜型、瓜长和单瓜重等性状无明显差异。
1. 2 试验方法
1. 2. 1 育苗 试验于2017年4月在湖南省农业科学院蔬菜研究所玻璃温室内进行,将涝耐受型冬瓜材料RW101和涝敏感型材料SW15的种子进行55 ℃温汤浸种30 min,浸种过程中不断搅拌使种子受热均匀,浸种结束后用清水冲洗干净继续置于室温浸种12 h,去除多余水分后置于28 ℃恒温催芽箱中催芽,发芽后分别播种100株于9 cm×9 cm营养钵中进行正常管理,待冬瓜幼苗长至5叶1心时进行水涝胁迫处理。
1. 2. 2 试验设计 水涝胁迫处理采用双套盆法,将育苗钵放入48 cm×60 cm大盆中,每盆随机放置30钵(RW101和SW15各15钵),以水面保持在育苗钵表面3 cm以上为水涝胁迫程度,每隔2 d补水一次以维持水涝胁迫程度。上午9:00开始水涝胁迫处理,重复3次。当水涝胁迫超过96 h时,SW15植株死亡率超过半数,分析两组材料的差异具有统计学意义,因此,设在水涝胁迫0、24、48、72和96 h时分别测定其相关指标。
1. 3 测定指标及方法
1. 3. 1 干重测定 随机选择两种耐涝性冬瓜幼苗各3株,用清水洗净根系泥土后,将整株幼苗放入105 ℃烘箱杀青30 min,然后70 ℃烘箱烘干48 h至恒重,用电子天平称量幼苗的干重,取平均值。
1. 3. 2 光合速率测定 从每株中上部各选取叶龄相对一致的功能叶,使用LI-6400XT便携式光合作用测量系统测定光合速率,测定时设定叶室温度25 ℃、光强1000 μmol/(m2·s)、CO2浓度400 μL/L;测定时间为上午9:00—10:00。
1. 3. 3 不定根数量及长度测定 统计冬瓜幼苗茎基部长度超过0.2 cm不定根的数量,采用游标卡尺测定其长度,测量时小心将育苗钵取出,抽掉表层水,从茎部不定根萌发处开始测量。
1. 3. 4 根系总长度及表面积测定 采用Epson Perfection V700扫描仪测定根系表面积及根系总长度,并采用Winrhizotrou 2007b 进行分析。用清水冲洗干净冬瓜幼苗根系上的泥土及杂质,按测定标准进行样品准备。
1. 3. 5 抗氧化酶活性及脯氨酸(Pro)和可溶性糖含量测定 选取大小和叶龄相对一致的叶片分别称重后置于-20 ℃保存备用。Pro含量采用酸性茚三酮法测定,MDA含量采用硫代巴比妥酸法测定,可溶性糖含量采用蒽酮法测定,过氧化物酶(POD)、过氧化氢酶(CAT)和乙醇脱氢酶(ADH)活性及羟自由基含量采用比色法(试剂盒购自南京建成生物工程研究所)测定。
1. 4 统计分析
试验数据采用Excel 2016进行整理和绘图,并采用DPS 9.5进行方差分析。
2 结果与分析
2. 1 不同水涝胁迫时间下冬瓜幼苗干重、净光速率(Pn)及不定根萌发的差异
由表1可知,水涝胁迫前RW101和SW15幼苗的Pn差异不显著(P>0.05),随水涝胁迫时间延长,二者的Pn均呈下降趋势,其中,RW101在水涝胁迫24 h时下降明显,之后下降速率趋于稳定,水涝胁迫96 h时Pn仍保持在水涝胁迫前的73.2%;SW15的Pn随水涝胁迫时间延长急剧下降,至水涝胁迫96 h时Pn仅为水涝胁迫前的43.1%。RW101的干重在水涝胁迫0~48 h差异不明显,从水涝胁迫72 h后开始上升,推测涝耐受型冬瓜应对涝害胁迫时前期以忍受胁迫为主,以减缓能量代谢;水涝胁迫48 h后,不定根开始萌发,根部可获得一定量的氧气,植株开始生长,叶茎基部伸长,以避胁变性为主应对涝害胁迫。SW15的干重在水涝胁迫过程中呈先下降后缓慢上升的变化趋势,说明SW15在开始水涝胁迫时其生长已消耗幼苗储备的能量,其中部分植株在水涝胁迫过程中因能量耗尽而死亡,存活植株在水涝胁迫72 h后才开始响应生成不定根。RW101在水涝胁迫48 h时即有不定根产生,至水涝胁迫72 h时大量植株萌发不定根,水涝胁迫96 h时存活植株均有不定根的萌发;SW15在水涝胁迫48 h时有部分植株死亡,水涝胁迫96 h时有50.0%左右植株根际腐烂,水面处幼苗茎萎缩倒缢。图1为水涝胁迫72 h后两种冬瓜材料幼苗不定的根萌发情况(图1-A和图1-B)和根系形态(图1-C)及根周扫描情况(图1-D)。从图1可看出,RW101根系的完整性保持较好,且有大量不定根生成,而SW15原有根系褐化、易断,逐渐失去功能,且不定根分化较少。通过根系扫描发现,SW15和RW101根的总长分别为162.21和229.43 cm,总根投影面积分别为19.49和21.01 cm2,总根表面积分别为8.32和10.92 cm2,相互间存在明显差异。
综上所述,涝耐受型冬瓜RW101在水涝胁迫初期主要通过抑制生长以降低能量代谢的方式忍受水涝胁迫,水涝后期借助不定根吸取氧气,促进植株生长,表现以避胁变性为主应对涝害胁迫,因此,整个水涝胁迫过程中,涝耐受型冬瓜RW101的Pn始终高于涝敏感型冬瓜SW15;涝敏感型冬瓜SW15的耐涝性明显低于涝耐受型冬瓜RW101,在水涝胁迫48 h后约15%植株死亡;但长時间水涝也会对涝耐受型冬瓜RW101产生胁迫作用,使植株死亡率上升至18.33%(胁迫96 h时),因此,种植涝耐受型冬瓜RW101也需及时采取排水措施。
2. 2 不同水涝胁迫时间下冬瓜幼苗生理响应的差异
从图2可看出,涝耐受型冬瓜RW101和涝敏感型冬瓜SW15的各理化指标在水涝胁迫处理前后均存在一定差异。其中,RW101的CAT活性随水涝胁迫时间的延长总体上呈先缓慢上升后快速上升再稍下降的变化趋势,在水涝胁迫72 h时其活性达最大值;SW15的CAT活性在水涝胁迫初期迅速上升,随水涝胁迫时间的延长稍有下降,且各水涝胁迫时间点的活性均显著低于RW101(P<0.05,下同)(图2-A)。SW15的POD活性随水涝胁迫时间的延长逐渐上升,在水涝胁迫72 h时达最大值,随后稍有下降;RW101的POD活性随水涝胁迫时间的延长波动变化,在水涝胁迫72 h时稍有下降,但在水涝胁迫96 h后明显升高,且各时间段的POD活性均显著高于SW15(图2-B)。SW15的MDA含量随水涝胁迫时间的延长不断升高,至水涝胁迫96 h时达81.01 nmol/gFW,为水涝胁迫前的2.72倍;RW101的MDA含量在水涝胁迫24 h时明显升高,为水涝胁迫前的1.92倍,随后随水涝胁迫时间的延长波动上升,且整个水涝胁迫过程中SW15的MDA含量均显著高于RW101(图2-C)。SW15的ADH活性在水涝胁迫48 h时最高;RW101的ADH活性在水涝胁迫72 h时最高,为水涝胁迫前的1.48倍,其余水涝胁迫时间段的ADH活性也高于水涝胁迫前,且各水涝胁迫时间段的ADH活性均显著高于SW15(图2-D)。水涝胁迫处理前,RW101的羟自由基清除能力较SW15高15.70%,随水涝胁迫时间的延长,RW101和SW15的羟自由基清除能力均不断升高,但均以RW101高于SW15,至水涝胁迫96 h时,RW101的羟自由基清除能力较SW15高18.18%(图2-E)。总体而言,在水涝胁迫期间,涝耐受型冬瓜RW101的CAT、POD、ADH活性及羟自由基清除能力均显著高于涝敏感型冬瓜SW15,而SW15由于MDA含量的持续积累,致使生物膜的结构和功能受到损害,影响其植株的正常生长。
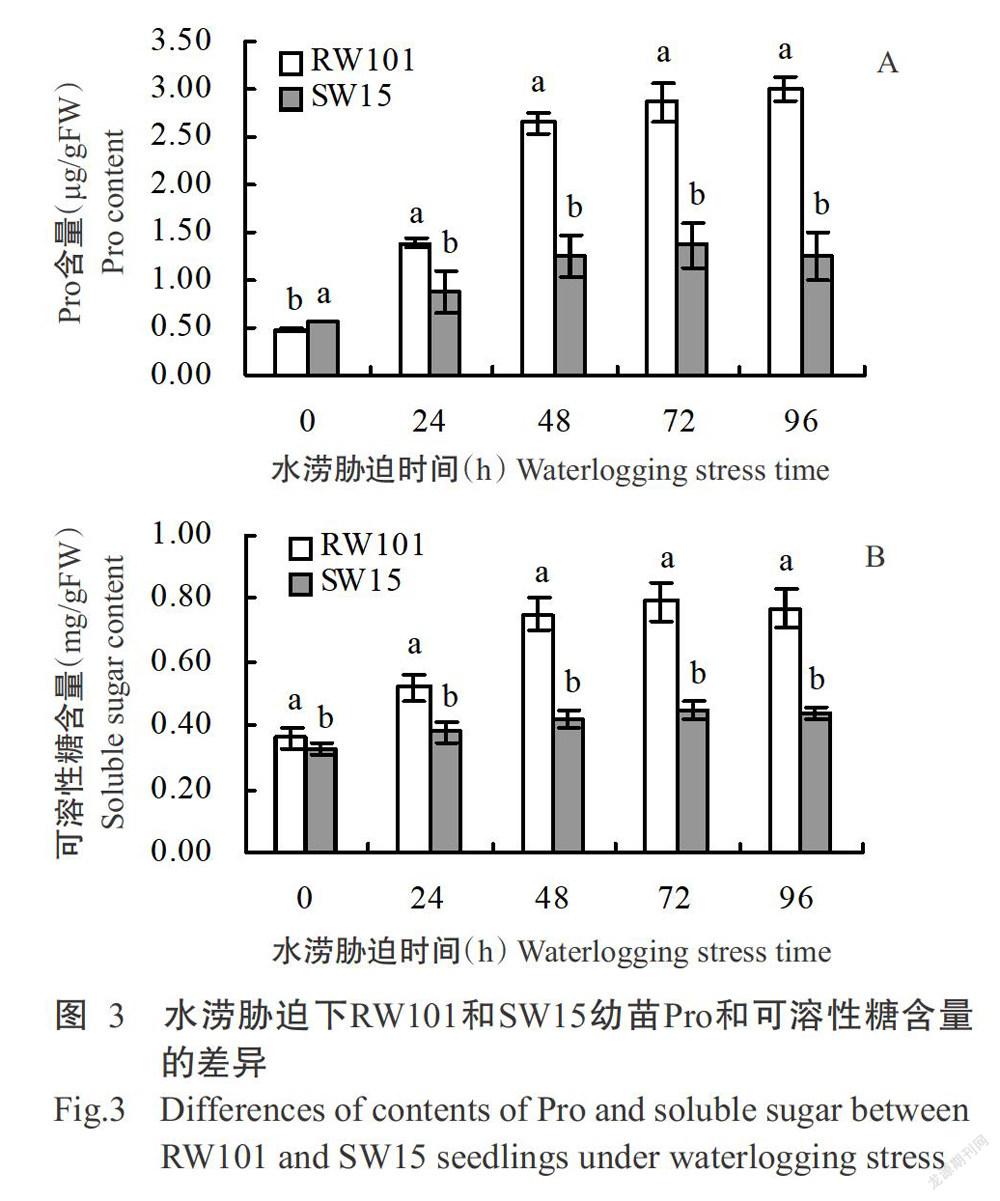
2. 3 不同水涝胁迫时间下冬瓜幼苗Pro及可溶性糖含量的差异
从图3-A可看出,在水涝胁迫下,RW101幼苗的Pro含量随水涝胁迫时间的延长而增加,且增幅较大,最高值出现在水涝胁迫96 h时,是水涝胁迫前的6.27倍,差异明显;SW15幼苗的Pro含量也随水涝胁迫时间的延长而增加,但增幅有限,且各胁迫时间点的Pro含量均显著低于RW101。从图3-B可看出,SW15和RW101的可溶性糖含量在水涝胁迫处理72 h内均有不同程度的增加,至胁迫96 h时略有小幅下降,且RW101的增幅明显高于SW15;RW101的可溶性糖含量最高值出现在水涝胁迫72 h时,是水涝胁迫处理前的2.14倍。说明涝耐受型冬瓜RW101在水涝胁迫下生成Pro和可溶性糖的响应速度及强度均优于涝敏感型冬瓜SW15,即涝耐受型冬瓜RW101可更好地应对水涝胁迫。
3 讨论
植物应对水涝胁迫时,可通过一系列生态结构改变及生理活性变化以适应胁迫环境。本研究发现,涝耐受型冬瓜RW101通过不定根快速萌发获得根部呼吸所需氧气以规避水涝胁迫,提高水涝胁迫下的存活率,与Rajhi等(2011)、Zhou等(2012)的研究结果相似。同时也有研究表明,植物应对逆境时会通过光合速率及无氧呼吸、抗氧化相关酶活性变化来应答(Caudle and Maricle,2014)。本研究中,在水涝胁迫72~96 h时存活的RW101和SW15植株叶片颜色存在明显差异,且相对于水涝胁迫前叶绿素含量均有所降低,但SW15明显存在叶片黄化现象,可能是水涝胁迫下氧气供给少致使呼吸作用减弱,导致细胞内累积较多的氧自由基,破坏叶绿体膜结构,造成叶绿素分解,与夏雪琴(2015)的研究结果一致。此外,叶片黄化现象可能与植物叶绿素合成相关酶活性降低影响叶绿素合成,使叶绿素含量总体上低于水涝胁迫前,进而影响光合速率有关(Candan and Tarhan,2012;Ou et al.,2011)。
已有研究证实,植物在受到非生物胁迫时会产生大量活性氧物质,造成蛋白质、核酸和膜脂过氧化,其中膜脂过氧化能产生醛类、烃类和酮等高活性有毒化学物质,对细胞造成损伤(杨红兰等,2015)。水分胁迫可诱导根系中相关激素的合成和抗氧化酶表达,导致某些内源激素和保护酶发生变化,植物生长受到抑制甚至死亡。相关研究显示,水涝胁迫下,植物的抗氧化酶系统能及时产生响应,防止细胞膜脂过氧化,对植物形成有效保护,增强植物的耐涝能力,从而减轻伤害(Ou et al.,2011;Liu et al.,2012)。本研究结果表明,RW101和SW15幼苗在水涝胁迫过程中其体内发生了一系列的生理变化,其中RW101的抗氧化酶活性和渗透调节物质含量显著提高,MDA和羟自由基含量也较低,在此条件下,RW101幼苗能维持高酶活性和高渗透物质含量以抵抗低氧环境,与王桂林等(2015)、郑佳秋等(2016)的研究结果一致;随胁迫时间的延长,RW101和SW15幼苗的MDA含量持续上升,但RW101的MDA含量升幅明显小于SW15,说明在水涝胁迫过程中其细胞膜系统受到的伤害逐渐加重,但SW15比RW101受到的伤害更重;同时,抗氧化系统酶活性不断升高,且RW101的升幅明显高于SW15,说明RW101具有较强的羟自由基去除能力。Pro除可作为渗透调节物质外,还可作为能量库、氮素储存剂、羟基清除剂、保护酶系和细胞结构稳定的兼容性溶剂(齐琳等,2015),对在渗透胁迫下的植物生长起保护作用。水涝胁迫下,植物常通过Pro和可溶性糖的大量积累以适应环境,RW101受到水涝胁迫时,其Pro和可溶性糖含量显著高于SW15,说明其适应水涝胁迫能力强于SW15。
4 结论
在水涝胁迫下,涝耐受型冬瓜RW101幼苗的存活率显著高于涝敏感型冬瓜SW15,其Pn、不定根萌发、抗氧化酶活性、MDA含量及羟自由基去除能力等均优于SW15;且随水涝胁迫时间的延长,RW101的Pro和可溶性糖含量显著高于SW15。因此,冬瓜幼苗在水涝胁迫时的形态结构及生理指标可用于评价冬瓜的耐涝性差异,为获得冬瓜耐涝性指标及创制耐涝冬瓜种质资源提供重要依据。
参考文献:
刘周斌,周宇健,杨博智,欧立军. 2015. 植物抗涝性研究进展[J]. 湖北农业科学,54(18):4385-4389. [Liu Z B,Zhou Y J,Yang B Z,Ou L J. 2015. Research progress in waterlogging of plant[J]. Hubei Agricultural Sciences,54(18):4385-4389.]
齊琳,马娜,吴雯雯,安玉艳,徐君成,秦祥宏. 2015. 无花果品种幼苗淹水胁迫的生理响应与耐涝性评估[J]. 园艺学报,42(7):1273-1284. [Qi L,Ma N,Wu W W,An Y Y,Xu J C,Qin X H. 2015. Physiological responses and to-lerance evaluation of fig cultivars to waterlogging[J]. Acta Horticulturae Sinica,42(7):1273-1284.]
僧珊珊,王群,李潮海,刘天学,赵龙飞. 2012. 淹水胁迫下不同玉米品种根结构及呼吸代谢差异[J]. 中国农业科学,45(20):4141-4148. [Seng S S,Wang Q,Li C H,Liu T X,Zhao L F. 2012. Difference in root structure and respiration metabolism between two maize cultivars under waterlogging stress[J]. Scientia Agricultura Sinica,45(20):4141-4148.]
王桂林,范伟国,彭福田. 2015. 桃树淹水及不同时间喷布水杨酸的生理响应[J]. 果树学报,32(5):872-878. [Wang G L,Fan W G,Peng F T. 2015. Physiological responses of the young peach tree to waterlogging and spraying SA at different timing[J]. Journal of Fruit Science,32(5):872-878.]
夏雪琴. 2015. 甜瓜CmHSP83基因克隆与遗传转化[D]. 武汉:华中农业大学. [Xia X Q. 2015. Clone of the me-lon CmHSP83 gene and genetic transformation[D]. Wuhan:Huazhong Agricultural University.]
杨红兰,周雅,张道远. 2015. 转乙醛脱氢酶基因ALDH棉花对干旱和高盐抗性研究[J]. 新疆农业科学,52(7):1177-1182. [Yang H L,Zhou Y,Zhang D Y. 2015. The research of transgenic ALDH cotton on drought and salt tolerance[J]. Xinjiang Agricultural Sciences,52(7):1177-1182.]
郑佳秋,郭军,梅燚,吴永成,祖艳侠,王薇薇. 2016. 辣椒幼苗形态及生理特性对涝害胁迫的响应[J]. 西南农业学报,29(3):536-540. [Zheng J Q,Guo J,Mei Y,Wu Y C,Zu Y X,Wang W W. 2016. Response of morphology and physiological characteristics of hot pepper seedling to waterlogging stress[J]. Southwest China Journal of Agricultural Sciences,29(3):536-540.]
Ashraf M A. 2012. Waterlogging stress in plants:A review[J]. African Journal of Agricultural Research,7(13),1976-1981.
Bailey-Serres J,Voesenek L A C J. 2008. Flooding stress:Acclimations and genetic diversity[J]. Annual Review of Plant Biology,59:313-339.
Bailey-Serres J,Brinton E. 2012. Waterproofing crops:Effective flooding survival strategies[J]. Plant Physiology,160(4):1698.
Broughton S,Zhou G F,Teakle N L,Matsuda R,Zhou M X,Oleary R A,Colmer T D,Li C D. 2015. Waterlogging tolerance is associated with root porosity in barley(Hordeum vulgare L.)[J]. Molecular Breeding,35(1):27.
Candan N,Tarhan L. 2012. Tolerance or sensitivity responses of Mentha pulegium to osmotic and waterlogging stress in terms of antioxidant defense systems and membrane lipid peroxidation[J]. Environmental & Experimental Botany,75(1):83-88.
Caudle K L,Maricle B R. 2014. Physiological relationship between oil tolerance and flooding tolerance in marsh plants[J]. Environmental & Experimental Botany,107(6):7-14.
Cheng X X,Min Y,Nan Z,Zhou Z Q,Xu Q T,Mei F Z,Qu L H. 2016. Reactive oxygen species regulate programmed cell death progress of endosperm in winter wheat(Triticum aestivum L.) under waterlogging[J]. Protoplasma,253(2):311-327.
Colmer T D,Voesenek L A C J. 2009. Flooding tolerance:Suites of planttraits in variable environments[J]. Funct Plant Biology,36:665-681.
Fukao T,Yeung E,Bailey-Serres J. 2011. The submergence tolerance regulator SUB1A mediates crosstalk between submergence and drought tolerance in rice[J]. Plant Cell,23:412-427.
Jiang B,Liu W,Xie D,Peng Q,He X,Lin Y,Liang Z J. 2015. High-density genetic map construction and gene mapping of pericarp color in wax gourd using specific-locus amplified fragment(slaf) sequencing[J]. BMC Genomics,16(1):1035.
Jiang B,Xie D,Liu W,Peng Q,He X. 2013. De novo assembly and characterization of the transcriptome,and deve-lopment of ssr markers in wax gourd(Benicasa hispida)[J]. PLoS One,8(8):e71054.
Laura P,Calogero L,Dario M,Cirilli M,Colao M C,Mensualisodi A,Muleo R. 2012. Novel prunus rootstock somaclonal variants with divergent ability to tolerate waterlo-gging[J]. Tree Physiology,32:355-368.
Liu K,Su R,Zhu J,Tian H. 2012. Physiological responses of cotton at seedling stage to waterlogged stress[J]. Advance Journal of Food Science & Technology,4(6):348-351.
Mi Y,Ma X,Chen S. 2013. Resistant evaluation of kiwifruit rootstocks to root zone hypoxia stress[J]. American Journal of Plant Sciences,4(4):945-954.
Ou L J,Dai X Z,Zhang Z Q,Zhou X X. 2011. Responses of pepper to waterlogging stress[J]. Photosynthetica,49(3):339.
Puyang X,An M,Xu L,Han L,Zhang X. 2015. Antioxidant responses to waterlogging stress and subsequent recovery in two kentucky bluegrass(Poa pratensis L.) cultivars[J]. Acta Physiologiae Plantarum,37(10):197.
Rajhi I,Yamauchi T,Takahashi H,Nishiuchi S,Shiono K,Watanabe R,Mliki A,Nagamura Y,Tsutsumi N,Nishizawa N K,Nakazono M. 2011. Identification of genes expressed in maize root cortical cells during lysigenous aeren-chyma formation using laser microdissection and microarray analyses[J]. New Phytologist,190(2):351-368.
Rocha M,Licausi F,Araújo W L,Nunes-Nesi A,Sodek L,Fernie A R,Dongen J T. 2010. Glycolysis and the tricarboxylic acid cycle are linked by alanine aminotransferase during hypoxia induced by waterlogging of Lotus japonicus[J]. Plant Physiology,152:1501-1513.
Sairam R K,Kumutha D,Ezhilmathi K,Chinnusamy V,Meena R C. 2009. Waterlogging induced oxidative stress and antioxidant enzyme activities in pigeon pea[J]. Biologia Plantarum,53(3),493-504.
Zhang X C,Shabala S,Koutoulis A,Lana S,Johnson P,Hayes D,David S,Nichols,Zhou M X. 2015. Waterlo-gging tolerance in barley is associated with faster aerenchyma formation in adventitious roots[J]. Plant Soil,394:355-372.
Zhou M,Johnson P,Zhou G,Li C,Lance R. 2012. Quantitative trait loci for waterlogging tolerance in a barley cross of Franklin×Yuyaoxiangtian Erleng and the relationship between waterlogging and salinity tolerance[J]. Crop Scien-ce,52(5):2082.

