酱油发酵过程中融合魏斯氏乳酸菌促进瓜氨酸的积累
贾爱娟,周凯,孙远明,徐振林,陈元佳,韦晓群
(1.广东美味鲜调味食品有限公司,广东中山 528437)(2.广东省食品质量安全重点实验室/华南农业大学食品学院,广东广州 510642)
氨基甲酸乙酯(EC),又称尿烷,是一种广泛存在于发酵食品中的 2A级致癌物(国际癌症研究机构,2007年),能够直接导致人类产生肝癌[1,2],主要在发酵、蒸馏、灭菌和贮藏等过程形成[3]。早在 2002年EC被联合国粮农组织纳入重点监控物质,推荐发酵食品中EC含量不超过20 μg/L[4]。在我国和其他一些 亚洲国家,发酵酱油是一类重要的食品调味料[5],Park在研究中指出,酱油是摄入EC的主要发酵食品,虽然致癌风险较低,但对于长期大量食用人群,需要保持警惕[6,7]。因此迫切需要准确了解发酵酱油中EC主要前体物质,并对形成主要前体物质的因素进行有效控制。
历年来广东是我国酱油的主要生产和出口地区[8]。以“日晒夜露”特色生产的高盐稀态发酵酱油因其发酵时间长风味醇香而成名。然而,由于独特的原料和发酵方式,很容易形成大量EC。酱油中EC的主要前体物质是酒精和瓜氨酸[9],分别在酵母发酵阶段和乳酸菌发酵阶段大量产生[10]。由于酒精有助于酱油独特的酱香风味,控制EC的方法主要集中于控制瓜氨酸形成[11]。瓜氨酸是一种非蛋白质氨基酸,主要由微生物通过精氨酸脱氨基途径(ADI)形成[1]。ADI途径只存在与少数原核生物中,酱油中的鲁氏结合酵母并不能产生瓜氨酸[12]。在酱油发酵过程中,前期发酵的曲霉以及随后使发酵液pH降低的乳酸菌可能成为瓜氨酸的主要来源。Zhang认为[10],Pediococcus acidilactici是酱油中瓜氨酸的主要来源,但在酱油发酵过程中,Weissella和Candida是优势菌株[13]。因此有必要深入了解酱油中的Weissella消耗精氨酸积累瓜氨酸的情况。
本研究以高盐稀态发酵酱油为主要研究对象,分离了酱油乳酸发酵阶段乳酸菌,确定了对瓜氨酸积累情况,并考察了环境因素Weissella confusa积累瓜氨酸的影响。为寻求有效的方法降低酱油中瓜氨酸积累,减少酱油中EC的产生提供参考。
1 材料与方法
1.1 原料和试剂
酱油曲料、酱醪和酱油发酵液来源于广东美味鲜调味食品有限公司和番禺东海调味食品有限公司两个酱油制造厂,均为高盐稀态发酵酱油,原料取回后均保存于4 ℃冰箱。
氨基甲酸乙酯(EC,99%)、9-占吨醇(98%)、氨基甲酸丁酯(BC,98%)、尿素(99%)、巴比妥酸、吡啶均为分析纯,购买于上海阿拉丁试剂公司。乙酸乙酯、乙醚、二氯甲烷为色谱纯,购买于RCI Labscan公司(泰国)。氢氧化钠、无水硫酸钠和盐酸等其他常用试剂购买于天津希恩思生化有限公司。
1.2 实验方法
1.2.1 氨基甲酸乙酯的测定
氨基甲酸乙酯的分离和检测参考国标中5009.223-2014并稍作修改,采用VF-WAX(30 m×0.25 mm,0.25 μm)色谱柱,气相色谱质谱型号为 Agilent 7890A-5975C(美国),色谱参数设置为:氦气为载气,流速为1.0 mL/min进样口温度为220 ℃,气体洗脱程序设置为初始温度50 ℃,保持1 min,以8 ℃/min加热至180 ℃后再以40 ℃/min加热至240 ℃,保持5 min,不分流进样,进样量为1.0 μL。质谱参数设定为:采用点喷雾离子源,电子能量70 eV,离子源温度为230 ℃采用SIM模式扫描,特征离子为62、74和89,为了提高灵敏度选择62为定量离子。
样品前处理参考国标5009.223-2014和Huang[14]并稍做修改。量取2 mL酱油及其发酵液并加入100 μL BC内标(1 μg/mL)混合均匀,EC提取和纯化采用固相萃取法,使用CNWBOND固相萃取小柱(上海安普),先用正己烷润洗,将样品溶液加入萃取柱中,静置10 min,用正己烷淋洗后,再用乙酸乙酯-乙醚(V/V=5:95)洗脱。将上述所得的萃取液和洗脱液收集到离心管后用氮吹仪浓缩至干,采用二氯甲烷后充分混匀溶解后定容至1 mL,经0.22 μm的有机滤膜后供GC-MS分析。
1.2.2 尿素和pH测定
尿素含量采用轻工业行业标准 QB/T 4710-2014进行测定,取稀释后的样品600 μL,加入400 μL的9-羟基吨氢醇(0.02 mol/L,溶于正丙醇)衍生化试剂,并加入 100 μL 1.5 mol/L 的盐酸溶液,漩涡震荡 1 min,避光在 25 ℃下反应 30 min,反应液经 0.45 μm 有机滤膜过滤后供高效液相色谱法色谱结合荧光检测器分离检测。以保留时间定性,采用峰面积外标法定量。色谱柱选择ZORBAX SB-C18柱,柱温35 ℃,进样量10 μL。荧光检测器激发波长为240 nm,发射波长为308 nm。采用PHS-25型pH计测定发酵液的pH值,测定前将发酵液放置于25 ℃水浴中放置20 min使温度达到平衡。
1.2.3 瓜氨酸和精氨酸测定
瓜氨酸和精氨酸的含量参考 Zhou[15]的方法利用分光光度法稍加修改。精氨酸测定:将40 g/L NaOH、80 g/L甲萘酚和0.5 mL/L双乙酰(用正丙醇溶解)各1 mL加入10 mL比色管中,然后加入100 μL适当稀释的样品(或标准溶液),混匀后在 30 ℃水浴中保温 15 min,冷却室温后测OD540,对应标准曲线中计算出精氨酸含量。瓜氨酸测定:将2 mL稀释的样品加入1 mL混合酸(V/V=1:3),加入 30 g/L 二乙酰一肟 0.125 mL,混匀后避光沸水浴 30 min,继续避光冷却室温后侧OD490,对应标准曲线中计算出瓜氨酸含量。
1.2.4 酱油中乳酸菌的分离和鉴定
将发酵酱醪用0.85%的生理盐水梯度稀释,取100 μL涂布于MRS固体培养基中并置30 ℃培养箱中培养直至有单菌落出现,将外观不同的菌落挑出并划线纯化数次,用20%的甘油保存于-80 ℃冰箱中。将纯化的菌株培养至OD600为1时分别接种至两种含有和不含18%NaCl的改良MRS液体培养基(加入了10 g/L精氨酸)中,置于30 ℃培养24 h。离心后测定上清液中瓜氨酸和精氨酸含量。细菌基因组DNA提取试剂盒(天根)步骤提取分离得到的菌株细菌基因组产物并送北京睿博兴科生物技术有限公司进行16s rDNA测序分析。并在 National Center for Biotechnology Information数据库(www.ncbi.nlm.nih.gov/BLAST/)上在线比对。
1.2.5Weissella confusa积累瓜氨酸的规律
挑选一株能够大量积累瓜氨酸的Weissella confusa,分别接种至 50 mL的两种含有和不含18%NaCl的改良MRS液体培养基(加入了10 g/L精氨酸),不含有 18%NaCl的培养基在 30 ℃中静置培养24 h,含有18%NaCl的培养基在30 ℃中静置培养48 h,分别定时取样测定OD值和上清中的精氨酸和瓜氨酸含量。将该菌株培养至 8 log cfu/mL 后取 1 mL 接种至9 mL改良的MRS培养基(含10 g/L精氨酸)中:不同的 NaCl浓度 6%、9%、12%、15%和 18%;不同pH 4、4.6、5.4、6.2;不同葡萄糖 0、20、40、80 g/L;不同尿素添加量5、10、20、40 mg/L;不同乙醇含量0.5%、1%、2%、4%。培养结束后测定上清液中精氨酸与瓜氨酸含量。其中不同pH组外,其余实验组均通过乙酸将pH调节至为6.2。除了不同的NaCl浓度组需要在 30 ℃培养 48 h,其他组均培养 24 h。
1.2.6 数据统计分析
每组实验分别重复三次。采用 SPSS statistics 19分析软件中的ANOVA程序对结果进行差异性显著分析。所有数据作图均采用origin 8.0软件作图。
2 结果与讨论
2.1 酱油发酵过程中EC与前体物质生成情况
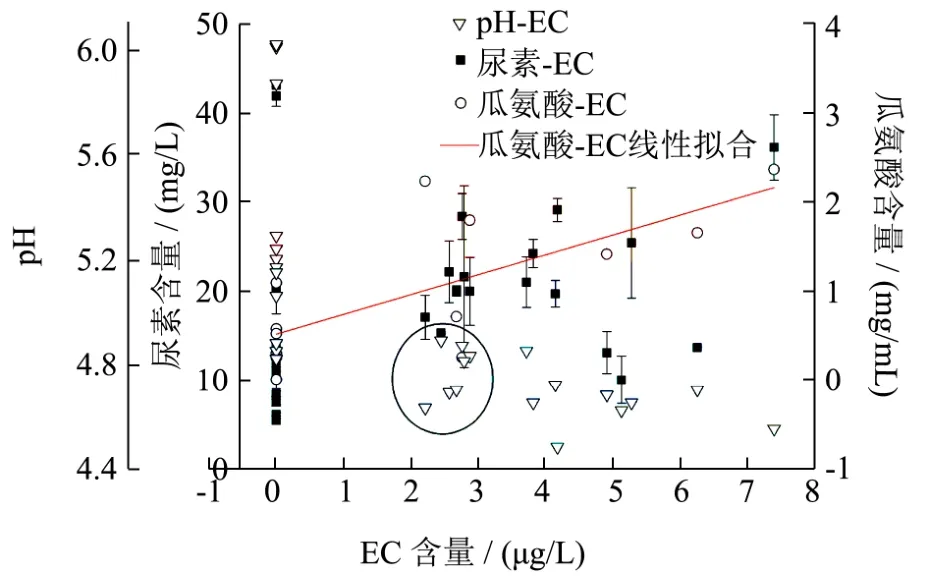
图1 酱油发酵过程中EC与尿素和瓜氨酸的相关性Fig.1 The relative of EC with urea and cirtulline during soy sauce fermentation
通过对番禺和中山两个酱油厂的酱油发酵液中的EC含量进行监控,同时也在实验室模拟酱油发酵过程,发现EC在整个酱油发酵阶段含量非常低(低于8 μg/L)。通过对比发现,发酵过程中EC与瓜氨酸相关性较高,相关系数达0.72,而尿素与EC的相关性很低(无法拟合,图1)。虽然酱油中EC大量形成于淋油和灭菌阶段[16],但主要EC前体物质瓜氨酸却在发酵前期的乳酸发酵过程中大量积累[10,17]。EC最早出现在pH约为4.8时(图1圆圈处),此时乳酸发酵临近结束,乙醇开始积累。在此过程中,酱油中的主要微生物为曲霉和乳酸菌。由于未在酱油曲料中检测到EC和瓜氨酸,因此认为曲霉新陈代谢并不能提供形成EC的主要前体物质瓜氨酸。
2.2 乳酸菌分离与瓜氨酸积累情况

图2 酱油中分离的乳酸菌在不含(a)和含有(b)18%NaCl的MRS培养基(含10 g/L精氨酸)培养24 h后利用精氨酸积累瓜氨酸的能力Fig.2 The arginine consumption and citrulline accumulation capacity of lactic acid bacteria isolated from the high-salt liquid-state fermented soy sauce
利用MRS固体培养基分离pH约为4.8中的酱醪中乳酸菌,通过对比菌落特征共得到34株菌,菌株鉴定结果与Sulaiman基本一致[13]。图2显示分离得到的乳酸菌在含有和不含18%NaCl的MRS液体培养基中利用精氨酸积累瓜氨酸的情况。显然 18%NaCl胁迫下,乳酸菌积累瓜氨酸能力显著提高[10],精氨酸到瓜氨酸的转化率提高了 1~14倍。根据能否大量利用和基本不利用精氨酸将得到的乳酸菌大致分成两类,基本不能利用精氨酸的菌株全部为Leuconostoc garlicum,这类乳酸菌虽然在含有与不含18%NaCl的培养基中均具有较高的瓜氨酸转化率,但利用精氨酸能力均很差,积累瓜氨酸能力很有限,即使在18%NaCl的胁迫下,积累的瓜氨酸含量均没有超过140 mg/L。另一类能大量消耗精氨酸,根据积累瓜氨酸情况也分成两类:一类积累少量瓜氨酸,主要为Weissella confusa(5号和34号)、Weissella cibaria、Enterococcus faecium、Weissella sp和Bacillus velezensis。另一类是大量积累瓜氨酸的菌株,主要有Pediococcus acidilactici、Weissella confusa、Leuconostoc sp、Sphingomonas echinoides和Rummeliibacillus stabekisii。其中Pediococcus acidilactici能够在 18% NaCl的培养基积累最多的瓜氨酸(1682 mg/L),且转化率达到17.18%,但数量很少。Weissella confusa检出数量最多,均能大量利用培养基中的精氨酸,但积累瓜氨酸的能力差别很大,其中5和34号的Weissella confusa在不含NaCl的培养基中利用精氨酸能力很差但在18% NaCl的培养基中能高效利用精氨酸且不积累瓜氨酸,而除5和34号的其他Weissella confusa在MRS培养基中均能大量利用精氨酸,在高含量的NaCl胁迫下积累瓜氨酸能力显著提高。
2.3Weissella confusa生长过程中对瓜氨酸积累情况

图3 Weissella confusa在不含(a)和含有(b)18%NaCl的MRS(10 g/L精氨酸)培养基中消耗精氨酸和利用瓜氨酸的情况Fig.3 The arginine consumption and citrulline accumulation ability of Weissella confusa in cultivating with (a) and without(b) 18%NaCl MRS Medium
图3是将挑选的一株Weissella confusa在最佳外界条件下培养,分别在不同时间内测定上清液中精氨酸和瓜氨酸的情况。由图可以看出,在没有18%NaCl胁迫下,Weissella confusa在对数生长期对精氨酸消耗量急剧增加,一方面能够满足菌体自身新陈代谢和繁殖,一方面利用ADI途径产物减缓环境pH值的降低[18]。由于环境适合,精氨酸含量高,精氨酸到瓜氨酸的转化率在对数生长期变化较小,而在培养24 h后,上清液瓜氨酸含量才显著升高。而18%NaCl胁迫显著抑制了Weissella confusa生长,瓜氨酸在整个生长过程中均在积累,且转化率都在20%以上。研究认为[15],盐是导致细胞内arcB基因转录水平相对于arcA减少从而造成瓜氨酸转化率提高。而瓜氨酸的释放机制却不清楚。在本实验室,推测瓜氨酸在没有盐胁迫下主要由后期细胞衰亡过程中释放到环境中从而积累,在有高浓度盐胁迫下,积累的瓜氨酸能够持续的释放至细胞外。
2.4 环境因素对魏斯氏菌株积累瓜氨酸的影响
分别考察了盐、pH、葡萄糖、乙醇和尿素含量对Weissella confusa消耗瓜氨酸积累精氨酸的影响。结果显示NaCl添加量是Weissella confusa转化率超过10%的唯一因素,也是积累瓜氨酸的最主要的因素,这也和P. acidilactici结果一致[10],但是,NaCl添加量为9%时,虽然精氨酸消耗量与6%NaCl时相近,但此时瓜氨酸显著增加至最大,转化率也为最高的58.5%。随后随着盐浓度的增加,Weissella confusa生长受到抑制,消耗精氨酸能力下降,转化率也随之下降,但在18%NaCl(酱油发酵时含盐量)的培养基下,转化率升高但瓜氨酸积累依然降低,此时瓜氨酸积累量为1333.54 mg/L。Weissella confusa在含12%~18% NaCl培养基下最终菌的数量基本一致,但精氨酸到瓜氨酸转化率在15%NaCl时最小,此时单位菌体利用精氨酸能力不是最弱,但消耗瓜氨酸能力强。
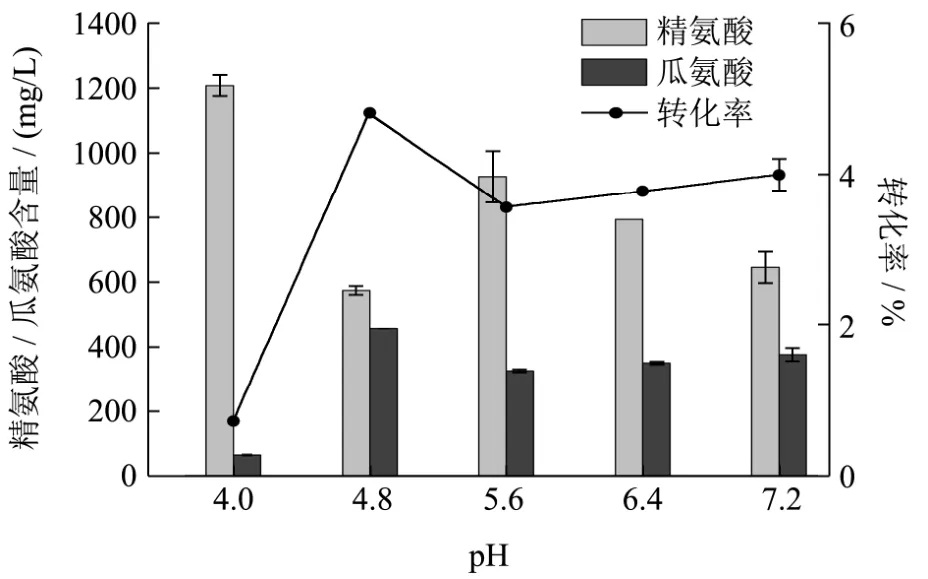

图4 Weissella confusa在不同条件下消耗精氨酸和利用瓜氨酸的情况Fig.4 The ability of Weissella confusa to consume arginine and accumulate citrulline in different conditions
推测在该盐浓度对Weissella confusa的ADI途径中精氨酸脱亚氨基酶(ADI酶)抑制强于12%NaCl,但对鸟氨酸转氨甲酰基酶(OTC酶)抑制又弱于18%NaCl,导致此时ADI/OTC酶活比例降至最低[12],因此15%盐浓度可做为降低Weissella confusa精氨酸到瓜氨酸转化率的重要因素之一。在pH为4.8时,Weissella confusa消耗精氨酸能力最强转化率也最高,这也和分离的酱醪pH一致,且为该菌积累瓜氨酸的最佳pH,但在pH为4时,Weissella confusa生长受到抑制,转化率不到1%。
葡萄糖对Weissella confusa积累瓜氨酸影响较大,虽然糖代谢和精氨酸的代谢相互独立,但实验显示高浓度的葡萄糖能够提高精氨酸到瓜氨酸的转化率和瓜氨酸浓度,可能的原因是:(a)提高了菌株生长速率,使得稳定期提前;(b)也可能是影响了环境的 pH,从而影响菌体的转化率[19];(c)葡萄糖氧化形成的大量ATP抑制了ADI途径在酸拮抗下产生ATP,导致瓜氨酸的积累[20]。由于酱油发酵时乙醇含量和尿素含量很低,这两者对Weissella confusa消耗精氨酸与积累瓜氨酸均没有显著影响。在2%乙醇浓度和10%的尿素存在下,精氨酸到瓜氨酸的转化率为最高。
3 结论
3.1 高盐稀态发酵酱油在发酵过程中EC最早出现在发酵液pH为4.8时,此时瓜氨酸大量积累,整个发酵过程中EC与瓜氨酸的相关性远高于尿素,证实了瓜氨酸才是酱油中主要的EC前体物质。制曲过程没有检测到瓜氨酸积累和EC形成。
3.2 分离得到的乳酸菌主要分成三类。一类是不能大量消耗精氨酸同时瓜氨酸积累量很小,全部是Leuconostoc garlicum;另外两类能大量消耗精氨酸,但积累瓜氨酸能力差异很大,除了先前报道的Pediococcus acidilactici能大量积累瓜氨酸外,Weissella confusa是分离得到的优势菌株,大部分能够在18%NaCl培养基中大量积累瓜氨酸。
3.3 盐胁迫是Weissella confusa积累瓜氨酸的主要因素,在含18%NaCl培养基中在生长过程中不断积累。Weissella confusa在9%NaCl存在下,精氨酸到瓜氨酸的转化率达到最高,瓜氨酸积累最多。pH 4.8和高浓度的葡萄糖能够提高精氨酸到瓜氨酸的转化率并积累更多的瓜氨酸。因此,消除此类乳酸菌在盐胁迫下积累瓜氨酸的能力或将产生的大量瓜氨酸转化掉将有助于高盐稀态发酵酱油中EC含量控制。

