超高效液相色谱-串联质谱法检测蜂蜜中的内源性酚酸和黄酮类物质
宿书芳,薛霞,公丕学,孙珊珊,付冉,张然,刘艳明,祝建华
(山东省食品药品检验研究院,山东济南 250101)
蜂蜜是指蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质。蜂蜜中除了含有葡萄糖和果糖等糖类物质外,还含有丰富的氨基酸、蛋白质、矿物质及酚酸、黄酮等生物活性物质[1],使蜂蜜具有抗氧化、抗菌和抗炎等功效,国内和国际市场对蜂蜜的需求量也不断扩大。
近年来,受蜂蜜产量、价格及检测标准滞后等因素的影响,不少商贩采用各种掺假手段生产低质量蜂蜜,甚至假蜂蜜,以赚取高额利润。掺假蜂蜜极大损害了蜂农、消费者和正规蜂蜜生产企业的利益,严重影响了蜂蜜产品的市场秩序和我国蜂蜜的出口贸易[2]。为提高蜂农的生产积极性、维护蜂蜜市场秩序,促进我国蜂蜜产业的健康发展,建立一套灵敏、高效、准确的蜂蜜掺假鉴定方法,尤其是蜂蜜中内源性成分的分析方法,对蜂蜜的掺伪鉴别具有重要的意义与价值。
酚酸、黄酮类物质是一类苯环上有若干个酚性羟基的化合物,多为植物的次生代谢产物,具有抗氧化、抗自由基等广泛的生理活性[3]。不同种类的蜂蜜,其酚酸类物质的含量及种类差别较大[4,5]。常见的酚酸、黄酮的测定方法有高效液相色谱法[5~8]、液相色谱质谱联用法[9~11]和紫外分光光度法[12]等。孙崇臻等[5]建立了蜂蜜中没食子酸、咖啡酸等14种多酚的高效液相色谱测定方法。但该方法需要的样品量较大,前处理净化过程复杂,分析时间较长。本研究建立了蜂蜜中咖啡酸、对香豆酸和没食子酸等18种酚酸、黄酮类物质的高效液相色谱串联质谱测定方法,样品采用 HLB固相萃取柱净化,超高效液相色谱串联质谱定性定量,仅需13 min,便可完成18种目标物的分析,大大缩短了分析时间,非常适合批量样品的分析与鉴别。利用该方法对实际蜂蜜样品进行检测,并将枣花蜜、洋槐蜜、荆条蜜、糖浆及糖浆掺假蜂蜜的测定结果做了汇总比较,为蜂蜜掺伪鉴别提供数据基础。
1 材料与方法
1.1 材料与试剂
没食子酸(gallic acid)、咖啡酸(caffeic acid)、阿魏酸(ferulic acid)、芦丁(rutin)、槲皮素(quercetin)、柚皮素(naringenin)、木犀草素(luteolin)、山奈酚(kaempferol)、芹菜素(apigenin)、原儿茶酸(protocatechuic acid)、二甲氧基肉桂酸(dimethoxycinnamic acid)、染料木素(genistein)、绿原酸(chlorogenic acid)、表儿茶素(epicatechin)、丁香酸(syringic acid)、对香豆酸(p-coumaric acid)、儿茶精(catechinic acid)、杨梅酮(myricetin)均购自美国 sigma公司;甲醇、乙腈(美国Fisher公司,色谱纯),其它试剂均为分析纯。
标准物质储备液除芹菜素外,其它17种化合物均用甲醇溶解,配制成浓度为1 mg/mL的标准储备液。芹菜素则在配制过程中,需先加入0.5 mL pH=10的氢氧化钠溶液,使目标物溶解,再用甲醇定容,配制得到1 mg/mL的标准储备液。
1.2 主要仪器设备
TQS超高效液相色谱-串联四极杆质谱联用仪,美国Waters公司;Milli-Q超纯水机,美国Millipore公司;超声波清洗器,宁波新芝生物科技有限公司;电子分析天平,北京赛多利斯仪器系统有限公司;HLB固相萃取柱(60 mg,3 mL),美国 waters公司。
1.3 方法
1.3.1 样品采集
天然成熟蜂蜜(枣花蜜、洋槐蜜、荆条蜜各 50批次)均购自当地蜂农,并于4 ℃冰箱中保存。市售洋槐蜜购自当地大型超市。高果淀粉糖浆由保龄宝生物科技有限公司赠送。
1.3.2 样品处理
1.3.2.1 提取
称取样品 5 g(精确至 0.01 g),加入 15 mL 0.01 mol/L盐酸水溶液,涡旋使样品充分溶解,超声30 min,待净化。
1.3.2.2 净化
将样品处理液转移至事先经5 mL甲醇,10 mL 0.01 mol/L HCl活化的HLB固相萃取小柱,待样品全部滴尽,用5 mL水淋洗,抽干小柱,再用10 mL甲醇洗脱,洗脱液于 35 ℃氮吹至近干,用 1 mL 1+1(体积比)甲醇水溶液复溶,经0.22 μm有机滤膜过滤,待上机测定。
1.3.3 色谱质谱条件
1.3.3.1 色谱条件
色谱柱:Acquity UPLC HSS T3(2.1*100 mm,1.8 μm);流动相A:乙腈;流动相B:10 mmol/L醋酸铵溶液;流速:0.3 mL/min,梯度洗脱程序:0~1 min,A为5%;1.0~7.0 min,A由5%线性变化至70%,7.1 min,A 为 100%,保持 3 min,10~13 min,以初始比例平衡色谱柱;柱温:40 ℃;进样体积5 μL。
1.3.3.2 质谱条件

表1 18种目标物质谱参数及保留时间Table 1 Mass spectrometric acquisition parameters and the retention time of 18 compounds
电离模式:电喷雾电离,负离子模式;毛细管电压:2.5 kV;锥孔电压36 V;离子源温度:150 ℃;脱溶剂气温度:550 ℃;脱溶剂气流量:800 L/H;锥孔气流量:150 L/H;碰撞气流速:0.15 mL/min。在优化的质谱条件下,各组分的母离子、子离子及碰撞能等参数见表1。
2 结果与讨论
2.1 样品提取剂的选择
对于食品中酚酸的测定,文献[13~15]采用水、乙酸乙酯、丙酮-水等溶液对样品进行提取。本方法若采用乙酸乙酯、丙酮等有机溶剂提取,提取后需经氮吹除去大部分有机溶剂,才能进行下一步的SPE净化操作,步骤繁琐;而若直接以水为提取剂,其操作方便,省时且绿色环保。考虑到被分析目标物多为有机弱酸,为避免其在中性水溶液中发生解离,实验采用 0.01 mol/L盐酸溶液作为样品提取剂。
2.2 液相色谱条件的优化
2.2.1 色谱柱
被分析组分大多含有酚羟基和羧基,分子的极性较强,在反相C18色谱柱上保留较弱,极易受杂质组分的干扰。实验大多通过降低流动相中有机相的比例来增强极性组分的保留。但是,流动相中水相的提高,得到稳定的雾化所需电压就更高,在负离子电离模式下,易导致放电,影响离子源的雾化效率,降低目标物灵敏度。因此,仅通过改善流动相的比例并不能达到较好的分离效果,选择合适的色谱柱更为关键。实验比较了 BEH C18,RP Shield C18 和 HSS T3 色谱柱对被分析组分的色谱保留情况,以保留时间最短的没食子酸为例(表 2),BEH C18 与 RP Shield C18 两种色谱柱,对极性较强的没食子酸,基本无保留,保留时间为 0.58~0.60 min;而 HSS T3 色谱柱,其保留机理主要是基于填料表面的硅羟基与目标物之间的氢键作用力,使得该色谱柱对极性小分子呈现良好的保留特性,从而减少了部分共流出物对目标物的基质干扰。而且该色谱柱能耐受高比例的水相流动相,更有利于水溶性极性化合物的保留。综合考虑,选择以高强度硅胶为基质的HSS T3色谱柱为分析色谱柱。
2.2.2 流动相
实验考察了甲醇-水、乙腈-水、乙腈-10 mmol/L的乙酸铵溶液作为流动相的色谱分离效果。结果表明,以乙腈-10 mmol/L的乙酸铵溶液作为流动相,被分析组分的离子化效率较高,信号较强(见表2),且没食子酸、绿原酸等弱酸性组分的色谱峰拖尾现象得到有效地改善,提高了方法灵敏度。因此选择乙腈-10 mmol/L的乙酸铵作为流动相。洗脱模式为梯度洗脱。根据各组分的保留时间,优化流动相洗脱梯度,以减少共流出物对目标组分的色谱峰的干扰。优化的流动相条件见1.3.3.1。在优化的色谱、质谱条件下,18种目标分析物的MRM色谱图如图1所示。
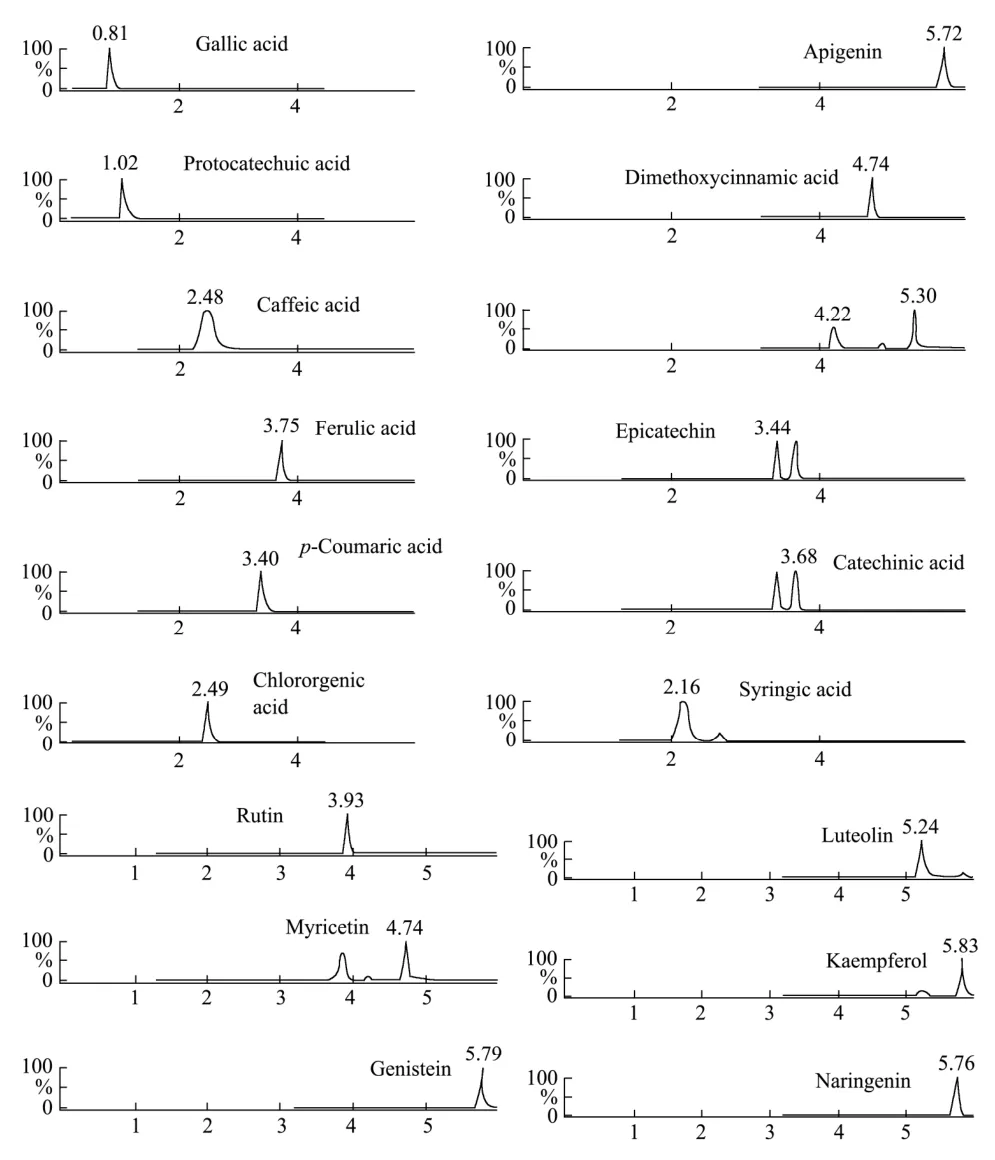
图1 18种目标物混合标准溶液的多反应监测离子流色谱图Fig.1 MRM chromatogram of 18 mixed analytes standard solution
2.3 SPE 条件的优化
蜂蜜成分复杂,且含有大量的糖类,为保证仪器响应灵敏度,有必要将样品净化,以减少杂质对色谱柱及质谱离子源造成污染。根据待分析化合物的性质,实验选用C18及HLB固相萃取柱对样品进行净化处理。通过比较,两种净化柱在净化效果上差异不大,但由于 HLB固相萃取柱采用特殊的聚合物吸附剂,所耐受的pH范围为pH 0~14,更适合酸性蜂蜜提取液的净化处理。因此实验采用 HLB柱为样品净化柱。实验以水作为淋洗液,除掉蜂蜜中的果糖、葡萄糖等糖类物质,再用纯甲醇将被分析物洗脱,经过氮气吹干浓缩,从而达到净化富集的目的。
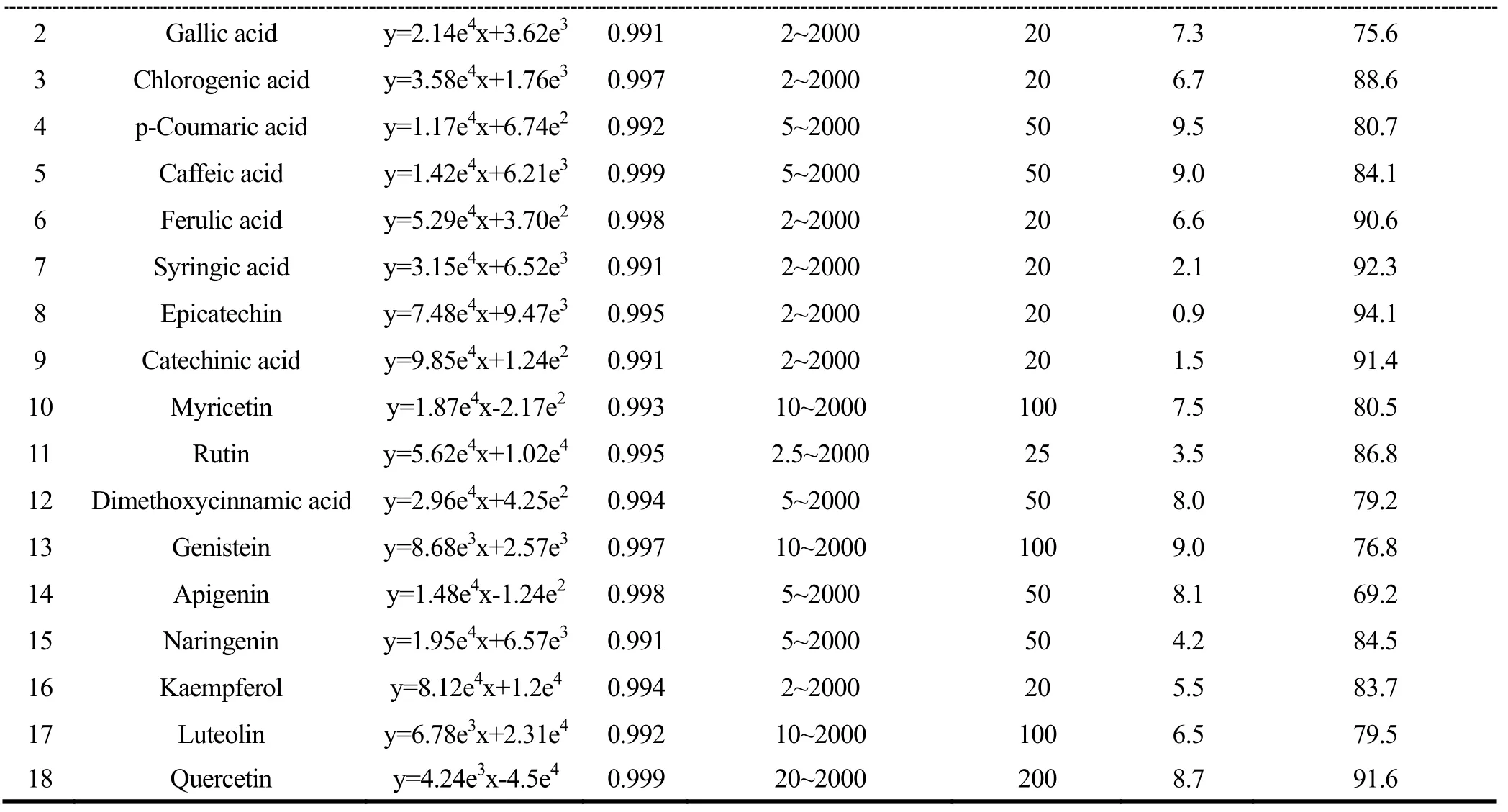
2.4 标准曲线和检出限
在优化的色谱质谱条件下,将18种目标物混合标准系列溶液依次注入色谱仪,以质量浓度为横坐标,各化合物的定量离子峰面积为纵坐标,绘制标准曲线。结果显示,18种目标物线性关系良好,相关系数(r2)均不低于0.992。以峰高3倍信噪比处对应的浓度,作为方法检出限,除杨梅酮、木犀草素等4种化合物检出限大于 100 μg/kg,其它化合物检出限均低于 50 μg/kg(结果见表3)。
2.5 添加回收率、精密度
以洋槐蜜为例,由于被分析组分的灵敏度不尽相同,且在洋槐蜜中的本底含量存在差异,所以选取浓度水平500 μg/kg为加入量,并平行测定6次,考察方法回收率和精密度。结果汇总见表3。
由表 3可知,18种目标物回收率范围为69.2%~94.1%,其中,芹菜素、染料木素等4种化合物的添加回收率不足80%,可能是由于基质共流出物抑制了目标物的电离,使得实际到达四极杆质量分析器的目标离子数量,大大低于理论值,回收率下降。从精密度数值看,各组分的RSD均小于10%,方法重现性较好。

表2 色谱柱及流动相对没食子酸的保留时间及信号强度的影响Table 2 The relationship of column and mobile phase to the retention time and the signal intensity

表3 18种目标物线性方程、检出限、回收率及精密度Table 3 The linear equations, LODs, spiked recoveries of 18 compounds in blank samples and RSDs (n=6)
2 Gallic acid y=2.14e4x+3.62e3 0.991 2~2000 20 7.3 75.6 3 Chlorogenic acid y=3.58e4x+1.76e3 0.997 2~2000 20 6.7 88.6 4 p-Coumaric acid y=1.17e4x+6.74e2 0.992 5~2000 50 9.5 80.7 5 Caffeic acid y=1.42e4x+6.21e3 0.999 5~2000 50 9.0 84.1 6 Ferulic acid y=5.29e4x+3.70e2 0.998 2~2000 20 6.6 90.6 7 Syringic acid y=3.15e4x+6.52e3 0.991 2~2000 20 2.1 92.3 8 Epicatechin y=7.48e4x+9.47e3 0.995 2~2000 20 0.9 94.1 9 Catechinic acid y=9.85e4x+1.24e2 0.991 2~2000 20 1.5 91.4 10 Myricetin y=1.87e4x-2.17e2 0.993 10~2000 100 7.5 80.5 11 Rutin y=5.62e4x+1.02e4 0.995 2.5~2000 25 3.5 86.8 12 Dimethoxycinnamic acid y=2.96e4x+4.25e2 0.994 5~2000 50 8.0 79.2 13 Genistein y=8.68e3x+2.57e3 0.997 10~2000 100 9.0 76.8 14 Apigenin y=1.48e4x-1.24e2 0.998 5~2000 50 8.1 69.2 15 Naringenin y=1.95e4x+6.57e3 0.991 5~2000 50 4.2 84.5 16 Kaempferol y=8.12e4x+1.2e4 0.994 2~2000 20 5.5 83.7 17 Luteolin y=6.78e3x+2.31e4 0.992 10~2000 100 6.5 79.5 18 Quercetin y=4.24e3x-4.5e4 0.999 20~2000 200 8.7 91.6
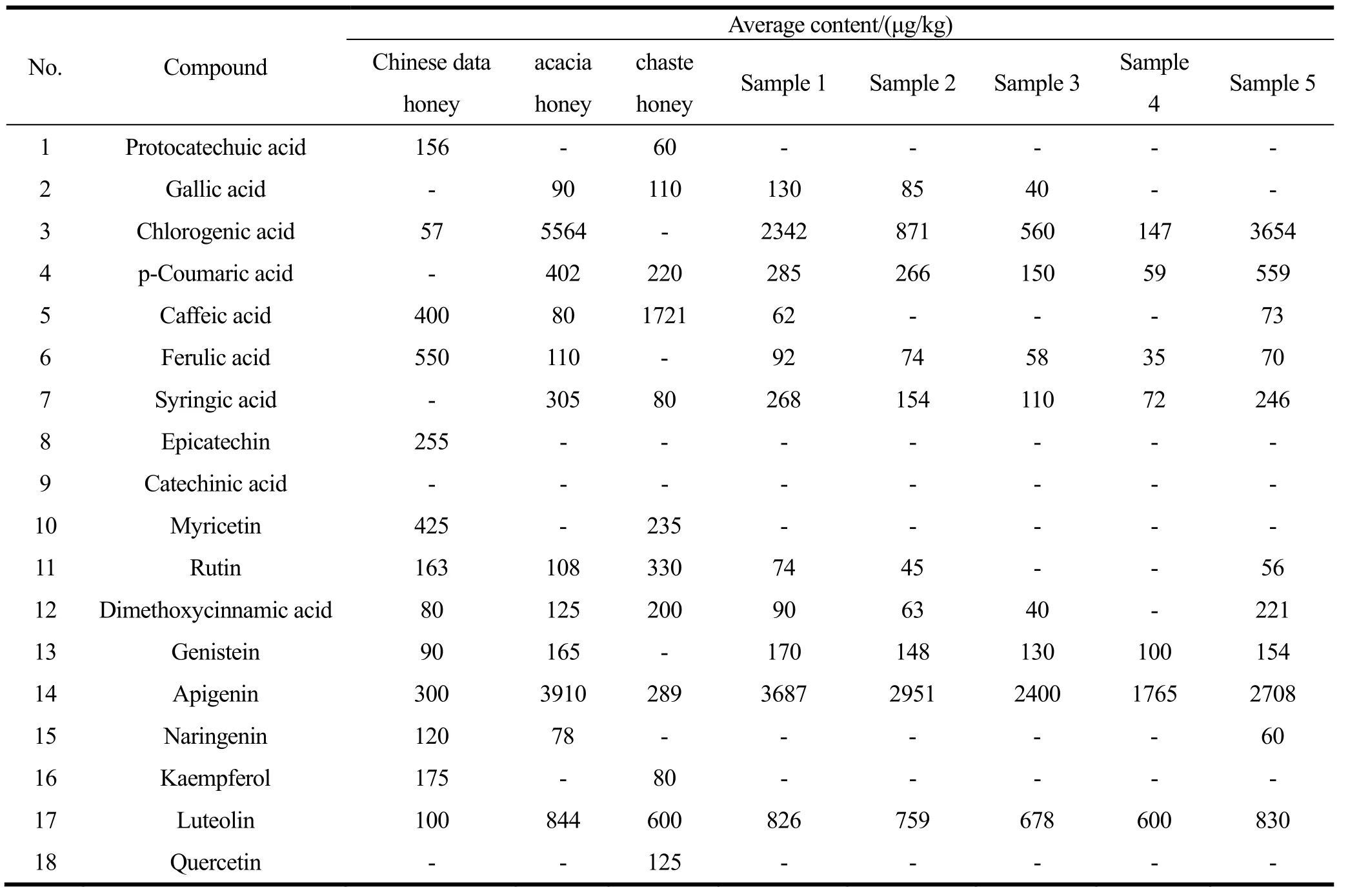
表4 不同蜂蜜中酚酸、黄酮类物质的平均含量比较Table 4 Comparation of average content results of the phenolic acids and flavonoids compounds in different honey samples
2.6 方法应用
利用该方法对150批次天然成熟蜂蜜、市售洋槐 蜜及以不同比例(20%、40%、60%和 80%)糖浆混合的洋槐蜜进行检测,对不同蜂蜜中酚酸及黄酮类物质的含量进行了汇总整理(详见表4),根据测定结果:
(1)不同蜂蜜中目标物的组成及含量存在明显的差异,这主要与蜜源植物花粉本身有关。其次,不同蜂蜜厂家的生产工艺的不同也可能会导致样品中酚酸含量的差异。在检出的目标成分中,阿魏酸在枣花蜜中的平均含量最高,为550 µg/kg;洋槐蜜中平均含量最高的为芹菜素,平均含量为3910 µg/kg;咖啡酸在荆条蜜中平均含量最高,为1721 µg/kg。
(2)糖浆中未检测到任何的酚酸与黄酮类物质,而对于糖浆掺假蜂蜜,随着糖浆比例的增大,各目标组分的含量逐渐降低,市售蜂蜜中目标物的含量大多优于糖浆掺假蜂蜜。
(3)不同蜂蜜的色谱图比较(以第2通道为例),如图2,其中图(a)、图(b)分别为真正蜂蜜,色谱图中呈现的色谱峰个数较多,而图(c)和图(d),由于不含或仅含少量蜂蜜,其色谱峰信息明显较少。通过比较各质谱图的差异,可以实现糖浆及掺假蜂蜜的鉴别。
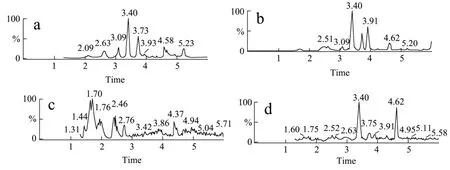
图2 实际样品(a)枣花蜜;(b)洋槐蜜;(c)糖浆;(d)20%糖浆掺假洋槐蜜测定总离子流图Fig.2 TIC chromatograms of different honey samples (a) date honey; (b) acacia honey; (c)syrup and (d) 20% molasses adulterated honey
3 结论
本文针对目前造假蜂蜜中普遍使用糖浆及劣质蜂蜜,以及缺乏准确有效的检测方法,难以对市场进行有效监管的问题,建立了高效液相色谱-串联质谱法同时测定蜂蜜中内源性酚酸、黄酮的分析方法。样品经提取溶剂提取,HLB固相萃取柱净化,超高效液相色谱串联质谱法测定,可同时完成18种目标物的定性定量分析。该方法操作简单、专属性好、准确性高,可用于掺假蜂蜜的快速鉴别检测。方法的实施对推动行业科技进步、规范蜂产品市场、保障消费者合法权益以及促进我国蜂产品事业的健康发展具有重要意义。

