温度对浓香型白酒发酵的影响
应 静,游 玲,邱树毅,王 涛,傅小红,罗明有,雷春琼,冯学愚*
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.宜宾学院 发酵资源与应用四川省高校重点实验室,四川 宜宾 644000;3.成都师范学院 化学与生命科学学院,四川 温江 611130;4.四川省宜宾市叙府酒业有限公司,四川 宜宾 644000)
浓香型白酒是典型的自然混菌、泥窖续糟发酵产品[1-2],影响发酵的因素众多,长期生产经验及研究表明,温度是发酵过程中的重要影响因素之一[3-5]。温度可通过影响微生物生长代谢及其一系列生化反应过程影响酒的产量及质量[6-7],因此,准确了解温度对白酒发酵过程的影响极其重要。当前通过人为控温了解温度对白酒发酵的影响研究相对较少。罗明友[8]证实在不加窖泥的基础上以黄水为接种剂进行浓香型白酒窖外控温发酵是可行的;张鑫[9]以地上不锈钢槽控制发酵温度的方式生产汾酒,出酒率略有降低,酸度略有升高;蒲岚等[10]发现,控温发酵不会造成酒体风格的改变,可提高糟醅总酯含量;陈丙友等[11]发现,清香型白酒地缸发酵中存在温度场,温度及其变化模式对微生物群落生长和代谢产生显著影响。采用泥窖续糟发酵工艺的浓香型白酒,由于窖池体系庞大,糟醅温度受环境因素影响大,且窖池内部不同位置、不同层次糟醅存在较大温度差,难以实现整个体系糟醅温度均匀一致,控温发酵作为中国白酒生产从传统方式向机械化、标准化转变的关键技术之一[12-13],亟待开展控温发酵机理、控温模式、控温方式等方面的系统研究。
本研究以传统浓香型白酒发酵工艺为基础,在实验室条件下用玻璃坛模拟浓香型白酒发酵,并对发酵过程进行温度控制,通过监测发酵过程糟醅理化指标变化,采用稀释涂布平板分离计数法检测典型微生物数量变化,气相色谱(gas chromatography,GC)结合外标法比较不同控温条件出坛糟醅主要挥发性风味物质组成及含量,运用主成分分析(principal component analysis,PCA)以直观了解不同温度与对照窖池出池糟醅风味成分的总体差异,探究温度对浓香型白酒发酵的影响,为人工定向控制发酵、实现白酒行业科学化和标准化生产奠定基础,以丰富浓香型白酒发酵机理的理论阐释。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与试剂
糟醅样品:取自宜宾某知名多粮浓香型白酒企业准备入窖的拌曲糟醅,黄水为入窖糟窖池上一轮发酵黄水,窖泥为该酒厂特制封窖泥;正丙醇、异丁醇、正丁醇、正己醇、β-苯乙醇、乙醛、异丁醛、糠醛、己酸乙酯、乳酸乙酯、乙酸乙酯、丁酸乙酯等多组分混合标样(均为色谱纯):郑州谱析科技有限公司;其余试剂均为国产分析纯。
1.1.2 培养基
营养琼脂培养基、虎红琼脂培养基:北京奥博星生物技术有限责任公司。培养基灭菌条件121℃灭菌20 min。
1.2 仪器与设备
Basis Hei-VAP-ML旋转蒸发仪:德国Heidolph设备生产公司;Agilent 7890A气相色谱仪:安捷伦科技有限公司;PHSJ-5精密pH计:上海仪电电子股份有限公司;mj-250-1恒温培养箱:上海齐欣科学仪器有限公司;1M探头式电子测温仪:广州偲瑞电子科技有限公司;LZ-1L玻璃坛:四川省泸州市晶盛玻璃厂。
1.3 方法
1.3.1 发酵实验方法
取72个121℃灭菌20 min的1 L玻璃坛作发酵容器,坛内依次装入充分混匀的待入窖粮糟0.8 kg、3%入坛糟窖池上一轮发酵黄水[14-15]、温度探头,封窖泥封坛。发酵初始阶段,所有发酵坛统一放在温度为22℃左右的实验室自然发酵8d。8d后将发酵坛随机分成三等份,分别放入高(36℃)、中(30℃)、低(24℃)三个温度[16-17]的培养箱中恒温培养52d,发酵周期为60d。糟醅入坛前取一次样,从入坛开始到发酵结束,前16 d每4 d取一次样,后44 d每11 d取一次样,取样时取每坛充分混匀的糟醅200 g,各温度条件下分别取样,同一温度条件取3个发酵坛做平行试验,进行微生物计数、理化指标分析。
1.3.2 温度监测
以预先埋入发酵坛内的温度探头监测糟醅中心位置温度变化情况;高(36℃)、中(30℃)、低(24℃)三个恒温培养箱维持不同发酵条件的温度需要,数显温度计检测培养箱实时温度。
1.3.3 理化指标检测
水分含量测定:烘干法[1];酒精度测定:蒸馏法结合酒精计法[1];酸度测定:酸碱中和滴定法[1];还原糖含量测定:斐林试剂法[18];淀粉含量测定:酸水解结合斐林试剂法进行测定[18]。
1.3.4 典型微生物培养计数
采用稀释涂布平板分离计数法对微生物进行计数[18]:好氧细菌培养温度为37℃,培养基为营养琼脂培养基;酵母菌、霉菌培养温度为30℃,培养基为虎红琼脂培养基。
1.3.5 风味物质检测
蒸馏法结合气相色谱法分析。称取100 g出坛糟醅样品,加入200 mL蒸馏水,蒸馏得100 mL溜出液,过滤备用。气相色谱分析条件:采用Lzp930毛细管柱(50 m×0.25 mm×0.25 μm);进样体积:1 μL;载气流速:氮气(N2)1.5 mL/min;分流比:40∶1;进样口温度:250℃;氢火焰离子化检测器250℃;柱温升温程序:35℃保持5min,以5℃/min升至100℃,再以10℃/min升至210℃,最后210℃保持10min。相同条件下测定糟醅的平行样,数据取平均值。
1.3.6 主成分分析
单独比较不同温度下出坛糟醅风味成分差异无法得到一个总体上的评价,主成分分析是一种通过降维,将原始变量重新组成一组新的互相无关的几个综合变量,通过确定少数几个主要因子来表示原来样本中多个复杂的变量,进而代替原始变量的多元统计分析方法[19]。采用SPSS 19.0数据分析软件对发酵60 d的低温出坛糟醅L-1、L-2、L-3,中温出坛糟醅M-1、M-2、M-3和高温出坛糟醅H-1、H-2、H-3及窖池出窖糟醅C0共10个糟醅样品的主要风味物质进行主成分分析,以直观了解不同温度糟醅之间的差异。
2 结果与分析
2.1 不同控温条件下糟醅温度变化
不同控温条件下糟醅温度变化如图1所示。由图1可知,糟醅入坛发酵初始温度为20℃左右,符合浓香型白酒发酵“低温入窖”特点[20]。发酵前8 d,各发酵坛温度较低且呈缓慢上升趋势,可能是因为入坛温度低,霉菌和酵母菌等微生物利用糟醅中的空气和营养物质开始进行繁殖代谢,产生一定的热量,使发酵坛内温度缓慢升高,与浓香型白酒发酵“前缓”规律一致,有利于控酸产酯,说明发酵正常。从第8天开始,发酵坛被分别放入温度设定为36℃、30℃和24℃的培养箱中恒温培养。除发酵第22天实验室停电,温度突然下降外,三个温度条件下糟醅温度与培养箱温度一致,由于是用小体积发酵坛在实验室条件下模拟大生产使用的窖池,糟醅发酵温度受环境影响大,加之培养箱温度恒定不变,因此在整个发酵过程中发酵温度得到有效控制,糟醅温度基本稳定。

图1 发酵过程中不同控温条件下糟醅温度的变化Fig.1 Changes of temperature of fermented grains under different temperature-controlled conditions during fermentation process
2.2 温度对糟醅理化性质的影响
2.2.1 温度对糟醅水分含量的影响

图2 发酵过程中不同控温条件下糟醅中水分含量的变化Fig.2 Changes of moisture in fermented grains under different temperature-controlled conditions during fermentation process
由图2可知,糟醅入坛水分在56%左右,稍高于窖池发酵的入窖水分,与糟醅装坛时接入了3%左右入坛糟窖池上一轮发酵黄水有关。不同控温条件下糟醅最终水分含量差异明显,发酵60 d时,36℃条件下糟醅出坛水分含量最低为61.4%,30℃条件下糟醅出坛水分含量为64.5%,24℃条件下糟醅出坛水分含量最高达66.3%,出入坛水分增幅在5.4%~10.3%,水分含量随温度增加而减少,可能与高温加快水分蒸发有关。
2.2.2 温度对糟醅淀粉、还原糖含量、酒精度和酸度的影响
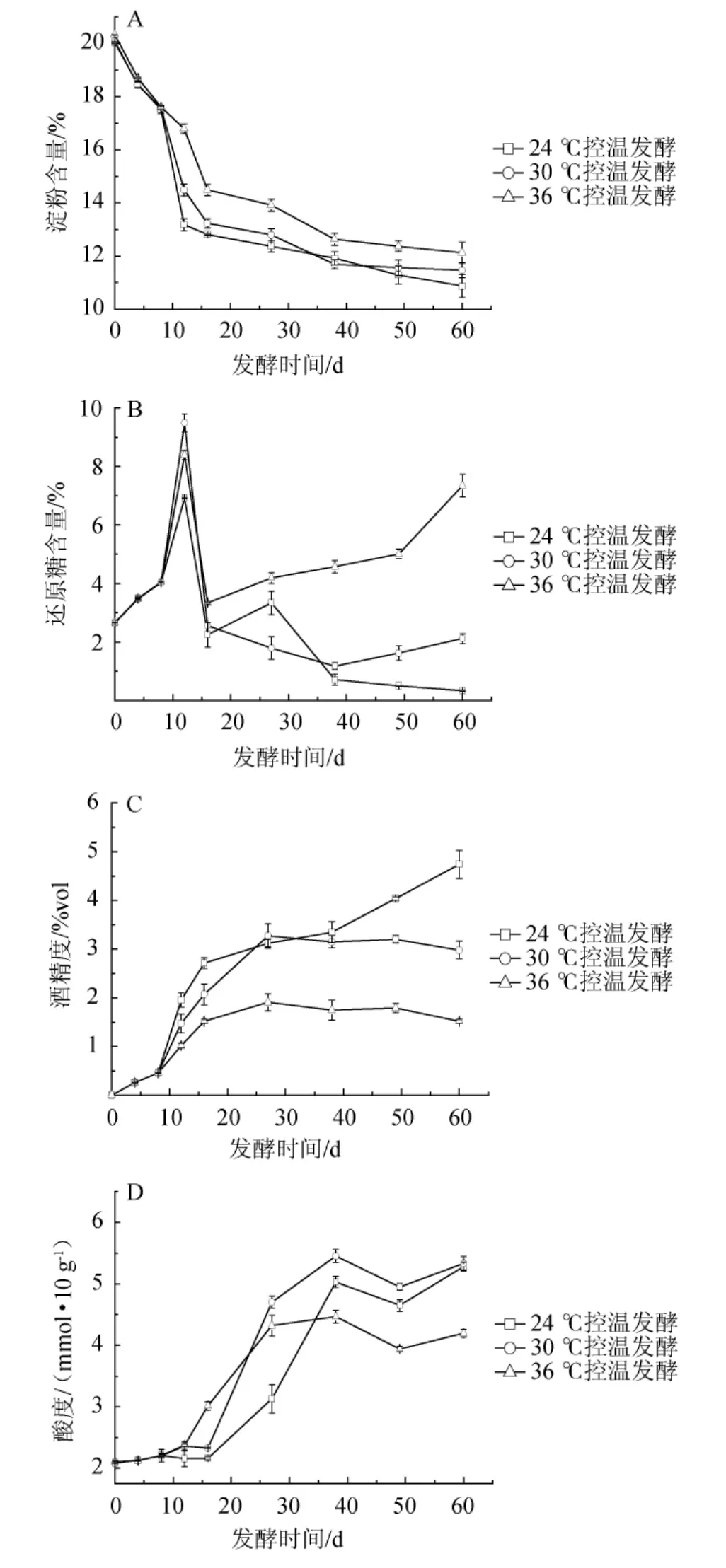
图3 发酵过程中不同控温条件下糟醅理化指标的变化Fig.3 Changes of physicochemical indexes of fermented grains under different temperature-controlled conditions during fermentation process
由图3A可知,不同控温条件下糟醅淀粉含量随发酵时间在0~60 d范围内都呈下降趋势,36℃条件下发酵糟醅残淀粉含量下降较慢,最终含量较30℃、24℃残淀粉含量高1%左右,说明控温发酵对淀粉含量变化影响较小,与罗冰等[3]的窖内研究一致。
由图3B可知,三种温度发酵糟醅中还原糖含量在12~16 d发酵过程中不断减少,36℃发酵糟醅在16 d左右还原糖停止减少,后期还原糖含量不降反升,酒精度也不再明显上升,说明较高温度影响酒化过程,造成还原糖累积。
由图3C可知,36℃发酵糟醅在16 d左右酒精度不再明显上升,其最终酒精度为1.52%vol,说明较高温度影响酒化过程,出酒率低,与陈丙友等[11]研究规律一致;而24℃发酵糟醅中,由酵母转化还原糖生成乙醇一直持续到发酵结束仍在进行,最终酒精度达4.67%vol,表明较低温度酵母菌不易衰老,倾向于“柔俨”型发酵,使最终酒精度较高;30℃发酵糟醅在27 d左右完成主发酵,最终酒精度为2.98%vol,变化趋势与窖池相似[21]。说明24℃低温条件导致产酒不彻底,需延长发酵期,不利于企业效益的提高,30℃控温发酵与实际生产接近,36℃较高温度条件严重影响产酒,不利于浓香型白酒发酵,24~30℃控温范围有利于酵母菌发酵产酒。
由图3D可知,控温开始,36℃发酵糟醅在第12天开始大幅生酸,而中、低温糟醅第16天才开始,且24℃升酸最慢,说明温度对产酸微生物的代谢有促进作用。发酵38~49 d,酸度略有下降,不同温度糟醅酸度都下降约0.4 mmol/10 g,分析可能是这一阶段醇酸酯化反应使酸度降低,49 d直至发酵结束,糟醅酸度出现回升,结合此时坛内发酵环境,推测坛内酸的生成与部分兼性厌氧菌和厌氧菌代谢产酸有关。最终30℃发酵糟醅酸度略大于24℃,在5.2 mmol/10 g左右,高于出窖糟醅适宜酸度范围3.0~4.5 mmol/10 g[22],推测一方面可能是因为发酵周期长,另一方面可能与出坛糟醅未进行“滴窖”过程有关,36℃控温发酵糟醅酸度为4.2 mmol/10 g,低于中低温发酵糟醅,产生这一现象的原因可能是36℃发酵糟醅温度较高,有机酸挥发较快,同时高温有利于醇酸酯化反应,导致最终酸度偏小。
2.3 温度对糟醅微生物数量变化的影响
2.3.1 温度对糟醅好氧细菌数量变化的影响

图4 发酵过程中不同控温条件下糟醅中好氧细菌数量的变化Fig.4 Changes of aerobic bacteria amounts in the fermented grains under different temperature-controlled conditions during fermentation process
由图4可知,0~12 d三种不同温度条件下糟醅好氧细菌数量变化趋势相似,都呈现出先增加,随后下降的趋势,好氧细菌数量在第8天达峰值,这是由于发酵初期糟醅含氧相对丰富,好氧细菌大量增殖,随着氧气的减少及酒精和酸的生成,好氧细菌出现死亡,细菌总数下降,中、高温发酵糟醅在第16天出现第2个峰值,低温发酵糟醅迟于中、高温糟醅,在27天出现峰值,推测与兼性厌氧细菌的增殖有关[2],低温发酵糟醅生酸产酒过程相对缓慢,使得其出现第2个峰值的时间晚于中、高温糟醅,且好氧细菌总数较中、高温糟醅大。随着发酵的进行,糟醅环境条件不再适合好氧细菌,好氧细菌数量不断减少,直至发酵结束,三个不同条件下好氧细菌数量很低且无明显差异。
2.3.2 温度对糟醅酵母菌数量变化的影响
酵母菌是白酒发酵过程中产酒产酯极其重要的微生物之一[1]。
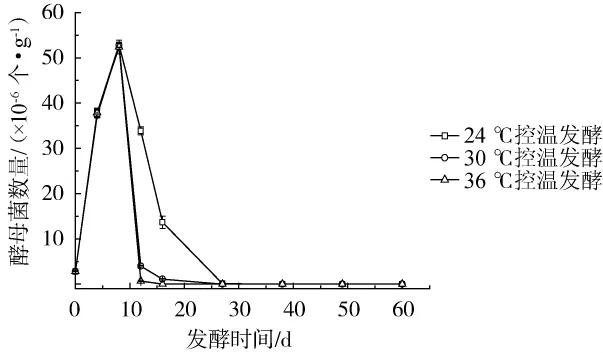
图5 发酵过程中不同控温条件下糟醅中酵母菌数量的变化Fig.5 Changes of yeast amounts in the fermented grains under different temperature-controlled conditions during fermentation process
由图5可知,酵母菌数量在不同温度白酒发酵过程中总体变化规律相同,都是在发酵初期(0~12 d)快速增长,随后数目开始下降,不同之处在,发酵中期(12~28 d),低温发酵糟醅酵母菌数量远多于中、高温发酵糟醅,36℃发酵糟醅酵母数量最少,接近于0。酵母菌最适生长温度为20~30℃,过高温度不适于酵母菌生长,容易使其过早衰老死亡。
2.3.3 温度对糟醅霉菌数量变化的影响
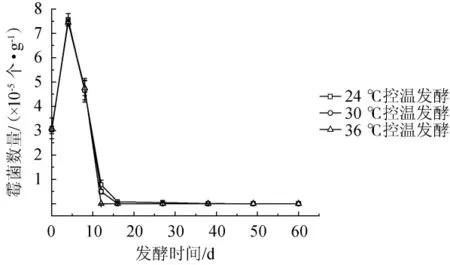
图6 发酵过程中不同控温条件下糟醅中霉菌数量的变化Fig.6 Changes of molds amounts in the fermented grains under different temperature-controlled conditions during fermentation process
由图6可知,不同控温条件下霉菌数量变化趋势基本相同,说明温度对霉菌数量的变化无显著影响。霉菌数量在第8天达到峰值,为750 000个/g糟醅,后急剧下降,到发酵后期,基本检测不到霉菌。
2.4 温度对糟醅主要挥发性风味物质变化的影响
采用气相色谱结合外标法对不同控温条件下出坛糟醅样品的主要挥发性风味物质进行检测[23],结果见表1。由表1可知,三个控温条件下共检测出18种主要挥发性风味物质,包括7种酯类物质、8种醇类物质和3种醛类。

表1 不同控温条件下糟醅中主要挥发性风味成分及含量检测结果Table 1 Determination results of main volatile flavor components and contents in the fermented grains under different temperaturecontrolled conditions
2.4.1 温度对糟醅醇醛类物质含量变化的影响
从3种不同控温条件发酵糟醅中共检测到8种主要醇类物质和3种醛类物质,分别是正丙醇、异丁醇、正丁醇、异戊醇、正戊醇、正己醇、β-苯乙醇、甲醇、乙醛、异丁醛和糠醛,不同温度糟醅醇醛类物质含量见图7。
由图7可知,高级醇类物质异戊醇、异丁醇、正丙醇、正丁醇、正己醇、正戊醇的生成都随发酵温度增加而减少,其中正丁醇变化尤为明显,随温度降低,含量成倍增长,造成这一现象的原因可能是酵母与多种高级醇的生成密切相关[24],而温度偏高使主发酵期提前结束,产高级醇类酵母过早衰老死亡,醇类物质生成少,中、高温发酵糟醅中检测到的高级醇类物质总含量仅为7.42 mg/100 g、7.74 mg/100 g,而24℃较低温度发酵糟醅主发酵期更长,高级醇类物质总含量达9.720 mg/100 g,β-苯乙醇随温度变化无明显规律。24℃低温发酵糟醅中没有检测到甲醇含量,30℃发酵糟醅中甲醇含量为0.001 mg/100 g,低于36℃甲醇含量的0.004mg/100g,甲醇含量随温度降低而减少,说明低温有利于减少甲醇的生成量[25]。糠醛仅在高温(36℃)发酵糟醅中检测到,含量为1.901 mg/100 g,可能是糠醛主要由发酵过程中美拉德反应等热反应过程生成,偏高温有利于美拉德反应,从而增加糠醛含量,与杨国先等[26]的研究相似。故在浓香型白酒生产过程中,为了降低糠醛物质含量,除生产中少用谷糠、稻壳外,还应注意控制发酵温度。

图7 不同控温条件糟醅中醇醛类物质含量的变化Fig.7 Changes of alcohols and aldehydes contents in the fermented grains under different temperature-controlled conditions
2.4.2 温度对糟醅酯类物质含量变化的影响
发酵糟醅中共检测到7种酯类物质,分别是己酸乙酯、乳酸乙酯、乙酸乙酯、丁酸乙酯、戊酸乙酯、己酸异戊酯、乙酸丙酯。不同控温条件下酯类组成及含量见图8。
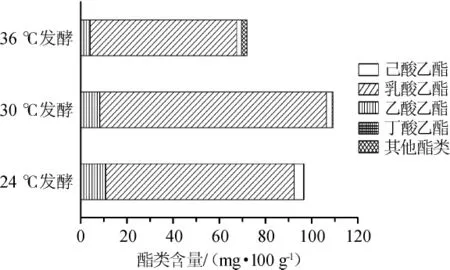
图8 不同控温条件糟醅中酯类物质含量的变化Fig.8 Changes of esters content in the fermented grains under different temperature-controlled conditions
由图8可知,不同控温条件下总酯差异明显,30℃控温发酵糟醅总酯含量为109.12 mg/100 g,较24℃发酵糟醅总酯含量96.64 mg/100 g大,说明温度偏高,酯化酶活力稍大,对酯化反应有促进作用,与万清徽等[27]研究规律一致。而36℃控温发酵糟醅总酯最终含量较30℃、24℃少,仅为69.99 mg/100 g,产生这一现象的原因推测是高温有利于酯类化合物的生成[28],但过高温度一方面加速酯类物质挥发,与陈玉香等[29]的研究相似;另一方面使产酯酵母早衰,最终导致较高温度发酵(36℃)糟醅中酯类物质最少,而30℃总酯含量大于24℃。实验还发现,不同温度梯度下糟醅中各酯类物质组成极不平衡,尤其乳酸乙酯和己酸乙酯相对含量,其中乳酸乙酯含量远大于己酸乙酯,分析原因可能是本实验所用发酵坛体系小,厌氧条件不够,使坛内发酵环境利于乳酸菌代谢产乳酸,己酸数量有限,产己酸少,最终导致己酸乙酯的生成少于乳酸乙酯,与潘玲玲等[30]研究结果一致。
2.4.3 糟醅主要挥发性风味物质的主成分分析
为直观了解不同温度下发酵糟醅风味成分的总体差异,对3种不同控温条件下及出池对照糟醅共10个糟醅蒸馏样品进行主成分分析,主成分分析得分图见图9。

图9 不同控温条件下糟醅与对照窖池糟醅风味物质PCA得分图Fig.9 PCA scores of fermented grains and control group under different temperature-controlled conditions
由图9可知,提取了两个主成分,第1个主成分能够解释原始风味组分的方差为46.53%,第2个主成分能够解释原始风味组分的方差为25.13%,前两个主成分总共可解释71.66%的原变量信息,能较大程度地反映糟醅风味组分差异。不同控温条件下糟醅样品能较好区分开。其中高温发酵(36℃)的H-1、H-2、H-3集中分布在第三象限,与中、低温发酵糟醅样品明显不同,可归纳为一类;低温发酵(24℃)的L-1、L-2分布较为靠近,集中在第四象限可归为第二类;低温发酵(24℃)的L-3与中温发酵(30℃)的M-1、M-2、M-3及出池糟醅C0在得分图上分布更为接近,可归纳为第三类。这说明不同温度对白酒发酵糟醅风味的生成有重要影响,中温发酵糟醅与窖池发酵糟醅风味构成更相似。第二类和第三类在得分图上明显区别于第一类,表明中温(30℃)、低温(24℃)及窖池发酵糟醅风味组分构成明显不同于高温(36℃)发酵糟醅,与前面所述高温(36℃)不适合浓香型白酒发酵相一致。
3 结论
利用实验室模拟传统浓香型白酒发酵探讨温度对浓香型白酒发酵过程的影响,在本实验条件下,可得出以下结论:高温(36℃)发酵生酸快,酵母及霉菌数量减少快,主发酵期结束较早,高级醇类物质含量为7.74 mg/100 g,糠醛含量为1.90 mg/100 g。低温(24℃)发酵产酒率最高,好氧细菌及酵母菌数量大且持续时间长,高级醇含量为9.72 mg/100 g,未检测到甲醇和糠醛物质。中温(30℃)发酵有利于最终酯类生成,含量为109.12 mg/100 g,其总体风味主成分分析结果与出窖糟醅更为接近。
根据研究结果,在本实验条件下,发酵温度宜在30℃左右,并可以通过控制发酵温度生产特定基酒。企业根据自身需要,选择通过控温发酵来解决生产实际问题,如生产中出酒率高,要增加酯类物质含量、减少高级醇生成,可控制发酵温度在30~36℃之间;酯类物质足够而出酒率偏低,可控制发酵温度在24~30℃之间。由于本研究以小体积发酵坛作发酵容器,尽管实现了对发酵温度的有效控制,但乙醇及风味物质的挥发也是实验误差的主要来源,因此,上述结论还需要通过窖内发酵进一步验证。

