水稻Ds标记的矮秆突变体的分子鉴定
郭妍妍, 赵丁丁, 孙丙耀
(苏州大学医学部基础医学与生物科学学院,江苏苏州 215123)
水稻作为主要的粮食作物和分子生物学(单子叶植物)研究的模式植物,随着其全基因组序列的公布[1],寻找和认识新型水稻功能基因已经成为水稻功能基因组学的重要研究任务。通过构建突变体库,以突变基因为研究对象分析水稻基因功能,是一条有效的研究捷径。产生水稻突变体的方法主要有T-DNA插入、理化诱变、转座子插入等[2-7]。其中,利用Ac/Ds插入产生水稻突变体,并以TAIL-PCR技术克隆突变位点侧翼序列寻找功能基因得到了广泛应用。国内外许多研究单位构建了多个水稻Ac/Ds突变体库,也从中分离到一些控制不同水稻性状的基因[2-6]。矮秆作为重要的农艺性状,矮秆基因的发现、研究和利用在“绿色革命”中起到至关重要的作用。但是目前为止,能够在生产上实际应用的矮秆主基因只有sd-1。植物矮化常与赤霉素(GA)、油菜素类固醇(BR)的代谢有关[8-10]。GA是植物生长发育过程中一类重要的调节激素,对诱导α-淀粉酶的形成、茎的伸长和植株增高、节间和叶片的伸长、禾谷类种子的萌发、花器官的形成等都具有明显的促进作用。目前,已有136种GA在植物、真菌、细菌中发现(http://www.plant-hormones.info/gibberellins.htm)。GA的合成需要3种基本酶:GA2氧化酶、GA3氧化酶和GA20氧化酶。这3种酶都具有保守的2OG-Fe(Ⅱ)加氧酶蛋白结构域,属于2OG-Fe(Ⅱ)加氧酶蛋白超家族[11-14]。Lo等在水稻TRIM群中发现的GA2氧化酶6,也具有保守的2OG-Fe(Ⅱ)结构域[15];Teng等在研究玉米第3号染色体上的GA3氧化酶2时,发现它是一个对玉米株高起主效作用的数量性状基因座,编码GA3-β羟化酶,与水稻GA3氧化酶2的同源性非常高[16]。寻找和发现新的能在生产上利用的矮秆资源以及研究矮生相关机制是水稻分子遗传工作者的不断追求。本研究利用已构建的Ac/Ds突变体系,筛选到矮秆表型突变体(mutant type,MT),并且在矮秆突变体后代培育中出现株高回复突变植株(revertant type,RT)。由此,展开对未知矮秆基因的分子研究。希望通过对MT、RT株高控制基因的研究,揭示此未知基因的结构和功能。
1 材料与方法
1.1 水稻材料
试验材料来源于水稻品种Dongjin(OryzasativaL. var.japonicacv. Dongjin)的Ac/Ds插入突变株系[17](由韩国国立庆尚大学Han Chang-deok教授实验室提供),经过连续4代自交培育出现MT,MT后代自交培育,出现RT。本试验以MT、RT作为试验材料。
1.2 引物设计
采用PCR方法检测Ac、Ds在水稻基因组上可能的插入,根据Ac、Ds的序列特点设计1对特异引物P1、P2,同时使用GUSBYF、GUSBYR作验证。TAIL-PCR引物:Ds序列的3个特异引物SP1、SP2、SP3,分别与随机简并引物AD组成3对引物,用于TAIL-PCR的3个反应,扩增Ds插入位点侧翼序列。Ds插入基因型分析引物:根据插入位点水稻序列特点设计特异引物F1、R1;利用前述引物SP3与R1组成1对引物,检测Ds插入,从而分析Ds插入基因型(表1)。
1.3 基因组DNA的提取和Ds插入的PCR鉴定
基因组DNA的提取依照Sun等的方法[18]进行。
Ds插入的PCR鉴定:建立PCR反应体系,选择特异引物P1、P2,94 ℃变性30 s, 58 ℃复性1 min,72 ℃延伸2 min,35个循环,检测有无Ac/Ds插入。同时,对GUS报告基因进行PCR鉴定,再次验证有无Ac/Ds插入。

表1 PCR反应引物
1.4 Ds侧翼序列的TAIL-PCR分析
对含Ac/Ds双元件的样品进行TAIL-PCR分析[18]:TAIL-PCR反应体系涉及的第1、第2、第3反应所采用的特异引物分别为SP1、SP2、SP3,随机简并引物为AD。反应结束后将第2、3轮反应的产物依次上样于2%琼脂糖凝胶电泳以选择迁移条带。
特异条带的洗脱、纯化和Ds侧翼序列的测定:根据所设计的特异引物SP2、SP3在Ds序列上的间隔(36 bp)选择第2、3轮反应产物中的特异迁移条带。从凝胶中切出第3反应的条带,回收纯化,TA克隆测序。
1.5 Ds侧翼序列的GenBank检索和插入位点的基因分析
为分析Ds插入部位的水稻基因情况,将上述已测的Ds侧翼序列用NCBI的Blast进行在线检索(http://www.ncbi.nih.gov/BLAST/),确认Ac/Ds插入植株中Ds的染色体定位和插入部位水稻基因结构和编码氨基酸序列。同时,利用FGENESH(http://www.softberry.com/)和GeneMark.hmm(http://opal.biology.gatech.edu/)推测残留8个碱基足迹后的被插入基因的结构,获得其编码的氨基酸序列。
1.6 RT中Ds跳跃行为的分子验证
Ds的跳跃往往会留下8~11个碱基的足迹。设计特异引物F1和R1进行PCR反应,对扩增条带克隆测序,即可验证有无足迹残留。
2 结果与分析
2.1 水稻突变体主要表型差异
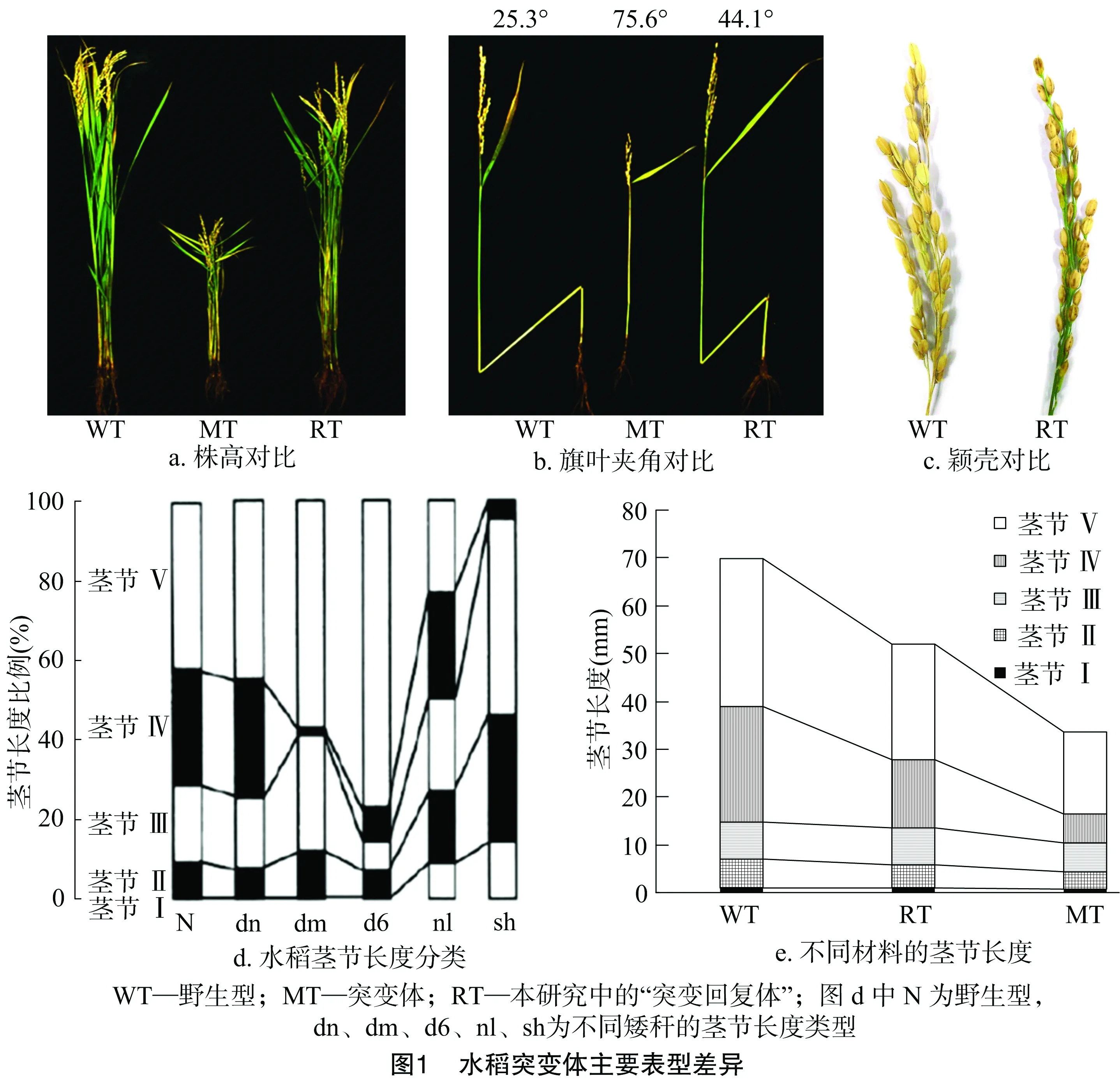
从图1可以看出,株高突变体系MT、RT和野生型(wild type,WT)对照,表型差异主要表现在株高和旗叶倾角上。WT平均株高79.02 cm,旗叶倾角25.3°;MT平均株高 45.86 cm(野生型的58.04%),旗叶倾角75.6°;RT平均株高74.13 cm(野生型的93.81%),旗叶倾角44.1°(图1-a、图1-b)。另外,RT在回复株高的同时,出现1个新性状,颖壳上出现杂斑(图1-c)。根据水稻前4~5茎节长度比例的差异,Takeda将水稻矮秆突变体分为6类[19](图1-d)。本研究中,MT和RT均属于dn型突变体(图1-e)。
2.2 PCR分析Ac/Ds在水稻基因组上的插入
本研究根据Ac、Ds元件的核酸序列特点设计1对特异引物,以基因组DNA为模板进行PCR扩增,分析基因组上是否存在Ac和Ds元件。图2-a为采用特异引物P1、P2进行PCR扩增的结果,其中,扩增出约0.4 kb特异条带的表明基因组中含Ac元件;扩增出约0.5 kb条带的表明含有Ds元件。可见,MT和RT基因组中均有Ac/Ds双元件。图2-b为GUS验证,即根据Ac/Ds双元件上含有的GUS报告基因,设计特异引物PCR扩增,进一步验证了MT和RT均有Ac/Ds双元件插入。
2.3 Ds侧翼序列的TAIL-PCR分析
对经上述Ac/Ds插入分析证实含Ac/Ds转座元件的MT、RT进行TAIL-PCR,扩增Ds插入位点侧翼序列,选择“*”标示序列凝胶回收(图3),纯化后将该片段连接到T载体上,经转化大肠杆菌DH5α、蓝白斑筛选、菌液PCR扩增验证,再进行序列测定。
2.4 Ds侧翼序列的GenBank检索和水稻Ds插入位点的分析
将上述测得的Ds侧翼序列的核苷酸序列用NCBI的Blast软件进行在线检索,发现Ds插入在水稻第3号染色体上,具体基因为Os03g0147400(Oryzasativajaponicagroup),在其第3外显子上,序列ID为BAS82290.1(图4)。此基因编码假拟氧化还原酶蛋白[19-20],含有1个保守的2OG-Fe(Ⅱ)加氧酶结构域,属于2OG-Fe(Ⅱ)加氧酶蛋白超家族。该假拟氧化还原酶蛋白拥有469个氨基酸。
2.5 Ds跳跃行为
根据Ds插入位点旁侧水稻序列特点,设计引物F1和R1,PCR扩增、克隆测序发现RT中有Ds转座跳跃,并残留“CATCATGA”8个碱基的足迹。插入位点水稻部分侧翼序列:5′-G A C C A G G A G G C T T T G G T T G G C G C C T T T A G G G A T A A A -C A G C A G A G C A T G G C C A T A C A C C A C T A C C C T C C T T G C C G C C A C -C C A G A C A A G G T G A T C G G C A T C A C G C C G C A C T C C G A T G G T C T C G- G C C T G A C G C T G C T G C T G C A G C T C G A C G A C A C G C C C G G C C T G C- A G A T C A G G A A G G A T G G C A G G T G G T T A C C A G T G C G A C C T C G C -C C G G G C A C C T (Ds插入位点)T C A T C A T G A C A T C A T C A A T G T- C G C C G A C A T A C T C G A G G T C C T T A C C A A T G G C G C G T A C A A G A G- C G T C G A G C A C A G A G T A C T C G C G G A C G C A G A G A A A G G C C G A A- C C A C C A T C G T G A C A T T T C A T G A A G C C T A T G T C G A T G G A A T G G- T G A A G C C G A T C C C G G A G G T G C T C A A G C T C A A C G G A G C A G A G G- C A C G C T A C A A G T C C A T A G A A A G A A T T G A G T A T A T C A A G G G A A- A C T T T G T G G C G C T T T C T G A G G G G A C A C G A T T T C T G G A G A G C C- T T A A G A T A T A G -3′,方框标记的8个碱基即为残留足迹。

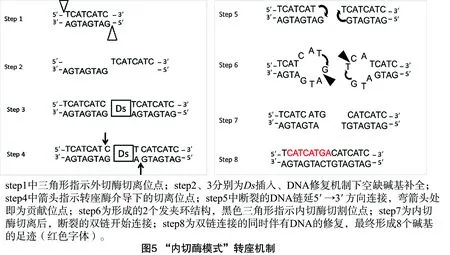
本研究中RT的转座机制属于“内切酶模式”[7,21-24]。由图5可知,首先核酸外切酶延5′→3′的方向,切断水稻序列,Ds得以插入;同时在基因修复机制下,碱基互补配对,空缺碱基得以补全,从而多出8个碱基对;接着Ac提供转座酶,帮助Ds切离(本研究材料Ds在切离的同时带走2个旁侧碱基,属于“不干净”切离);伴随Ds的切离,基因序列按5′→3′方向自发延伸,从而形成2个发夹环结构,这就需要内切酶的参与,内切酶在一定范围内以一定几率切割“发夹环”的不同位点,导致环结构的消除;DNA重新合成、修复,结果产生不同长度和排列的足迹。本研究材料中,内切酶在贡献位点的下一个碱基处切割,修复完成后,出现2个碱基对的颠换。与野生型相比,Ds跳跃的结果是残留8个碱基,并伴有1个(实际2个)碱基对的转换。

3 讨论与结论
由于Ds的插入导致编码假拟氧化还原酶蛋白的基因正常功能改变,出现矮秆突变体(MT)。这种改变有2种可能:(1)Ds参与蛋白表达。Ds可参与该基因(也可能是其他基因)的正常表达,两者形成一种“新的”基因;因为Ds条带的加入导致原有氨基酸链的增加或改变其折叠结构等,产生一种新的蛋白,最终导致原来基因功能的改变。这种蛋白可能参与到水稻生理作用,也可能被其他酶降解,没有发挥作用。(2)Ds不参与表达。只是因为长达4.6 kb的Ds核苷酸链的插入导致该基因表达的中断,使其丧失正常表达功能,合成出其他有用或无用的蛋白。也可能因为Ds的插入,影响附近DNA链的空间结构,从而链式影响到周围相关基因的表达,产生突变体MT。总之,不管哪种可能,都会改变该基因原有功能,导致该基因无法正常编码假拟氧化还原酶蛋白。
RT中出现Ds跳跃,株高得以回复(与WT相差不到 5 cm),同时伴有新性状颖壳杂斑的出现。因为Ds的跳跃,编码假拟氧化还原酶基因得以回复原有结构,但又有一点小差异,多了“CATCATGA”8个碱基。单从株高上分析,因为有Ds在该假拟氧化还原酶蛋白基因上切离,RT株高得以回复,接近野生型。结合MT因为有Ds在该基因的插入,表型矮化的特征,可以说明该编码假拟氧化还原酶基因对株高的维持具有重要作用。现在难以确定的是RT中Ds跳跃后是插在了其他表达基因上,抑或插在非表达区,还是跳跃后被降解消失了,总之,Ds跳跃后的去向还有待研究。目前,使用 TAIL-PCR 的方法还没有检测到新的转座位点,这就难以对该基因的功能作出更具体的判断。因为可能是Ds跳跃后插入新的表达基因,从而产生无法预知的变化,比如RT出现的颖壳带有杂斑就是佐证。
植物矮化常与GA、BR的代谢有关,尤其是GA。GA是植物生长发育过程中一类重要的调节激素,对茎的伸长和植株增高具有重要的促进作用。目前的研究显示,在GA的合成中,有3种酶起到基本作用,GA2氧化酶、GA3氧化酶和GA20氧化酶,这3种酶都具有保守的2OG-Fe(Ⅱ)加氧酶蛋白结构域,属于2OG-Fe(Ⅱ)加氧酶蛋白超家族[11-14],如黄瓜的GA2氧化酶、玉米的GA3氧化酶1、烟草的GA2氧化酶4、粳稻GA3-β羟化酶(即GA3氧化酶)等,都具有保守的2OG-Fe(Ⅱ)加氧酶蛋白结构域。
本研究中的假拟氧化还原酶,同样具有保守的2OG-Fe(Ⅱ)加氧酶蛋白结构域,属于2OG-Fe(Ⅱ)加氧酶超家族,且从上述研究不难推断,该蛋白可能对水稻株高的维持具有重要作用。本研究中的假拟氧化还原酶蛋白是否影响到GA的正常合成还有待进一步的研究和验证,揭示该基因真正的功能和作用机制。

