紫花山奈的组培快繁研究
吴满良,李冬梅,朱根发,刘小飞
(广东省农业科学院环境园艺研究所/广东省园林花卉种质创新与利用重点实验室,广东 广州 510640)
紫花山奈(Kaempferia elegans)又名美山奈,属于姜科(Zingiberaceae)山奈属(Kaempferia)植物,原产于四川;其植株低矮,根茎匍匐,不呈块状,须根细长,不耐霜冻,冬季地上部分枯死[1-5];叶卵形或椭圆形,叶面绿色,具深色羽状彩纹,十分美丽,具有极高的观赏价值;花紫色,唇瓣2深裂至基部,花期6~10月,常作为夏秋季节布置花坛的绿化植物和盆栽观赏植物[1-7]。
姜科植物可采用种子、茎杆扦插、切分根茎、带叶根茎扦插和组织培养的方法繁殖[6-8]。由于紫花山奈不结果,故不能进行播种繁殖;因没有茎杆,也不能用茎杆扦插繁殖[9-13],只能采用切分根茎、带叶根茎扦插和组织培养的方法繁殖[14-16]。因为母本量不足,限制了切分根茎分株和带叶根茎扦插的繁殖速度,而且对母株也有损伤[17-20]。山奈属植物的组织培养,目前仅在海南三七(Kaempferia rotunda)和山奈(Kaempferia galanga)中有成功的报道[8-11]。由于山奈属植株的多样性和其外植体灭菌困难,目前,紫花山奈的相关研究集中在带叶根茎扦插繁殖和光合特性方面[6-7],而其组织培养方面的报道鲜见。鉴于此,本研究选取紫花山奈无菌苗的芽基部为外植体,进行不同激素类型及配比组合对芽基部增殖、丛生芽诱导以及生根的影响,建立了高效稳定的紫花山奈无菌苗芽基部的组培快繁体系,对提高紫花山奈种苗的繁殖速度和在园艺园林上的推广应用具有重要意义。
1 材料与方法
1.1 试验材料
试验于2017年5月在广东省农业科学院环境园艺研究所白云基地组培楼进行,采集紫花山奈的根茎,用自来水清洗干净,剪掉根茎上的须根,消毒后晾干;再放入洗净消毒的河沙中,恒温发芽;洗净根茎芽,取其芽基部。将消毒好的芽基部接种到增殖培养基(MS+6-BA 8 mg/L+NAA 0.1 mg/L+椰汁10%+蔗糖30 g/L+卡拉胶粉9.5g/L)培养(图1A,封二),直至芽基部形成球状(图1B,封二),然后切割增殖的芽基部,接种丛生芽诱导培养基(MS+6-BA 3 mg/L+NAA 0.1 mg/L+椰汁10%+蔗糖30 g/L+卡拉胶粉9.5 g/L)诱导出丛生芽(图1C,封二)。取无菌苗的芽基部为材料,备用。
1.2 试验方法
1.2.1 接种材料处理 在超净工作台上,将紫花山奈无菌苗从瓶中取出,置于消毒的碟子中,用刀片切去叶片、茎和根,只留约1 cm的芽基部。每个芽基部大小接近,接种于芽基部增殖培养中。
1.2.2 芽基部增殖培养 设置6种芽基部增殖培养基,分别为MS+6-BA 8 mg/L+白砂糖30 g/L+卡拉胶粉10 g/L+10%椰汁(A1)、MS+6-BA 10 mg/L+白砂糖30 g/L +卡拉胶粉10 g/L+10%椰汁(A2)、MS+6-BA 12 mg/L+白砂糖30 g/L+卡拉胶粉10 g/L+10%椰汁(A3)、MS+6-BA8mg/L+NAA0.1 mg/L+白砂糖30 g/L +卡拉胶粉10 g/L+10%椰汁(A4)、MS+6-BA10 mg/L++NAA0.1 mg/L+白砂糖30 g/L+卡拉胶粉10 g/L+10%椰汁(A5)、MS+6-BA 12 mg/L+NAA0.1 mg/L+白砂糖30 g/L+卡拉胶粉10 g/L+10%椰汁(A6),pH值均为5.8~6.0。每种增殖培养基接40瓶,每瓶接1个芽基部:培养基灭菌条件125℃,40 min,下同。20 d后观测芽基部增大倍数、启动率、出芽数和污染率:

1.2.3 丛生芽诱导培养 设置6种丛生芽诱导培养基,分别为MS+6-BA 3 mg/L+NAA0.05 mg/L+白砂糖30 g/L +卡拉胶粉10 g/L+10%椰汁(B1)、MS+6-BA 4 mg/L+NAA 0.05 mg/L+白砂糖30 g/L +卡拉胶粉10 g/L+10%椰汁,pH 5.8~6.0(B2)、MS+6-BA 5 mg/L+NAA 0.05 mg/L+白砂糖30 g/L +卡拉胶粉10 g/L+10%椰汁(B3)、MS+6-BA 3 mg/L+NAA 0.1 mg/L+白砂糖30 g/L +卡拉胶粉10 g/L+10%椰汁(B4)、MS+6-BA4 mg/L+NAA 0.1 mg/L+白砂糖30 g/L +卡拉胶粉10 g/L+10%椰汁(B5);MS+6-BA 5 mg/L+NAA 0.1 mg/L+白砂糖30 g/L +卡拉胶粉10 g/L+10%椰汁(B6),pH值均为5.8~6.0。每种丛生芽诱导培养基接40瓶,每瓶接1个芽基部,50 d后观测启动率、出芽数以及污染率。
1.2.4 生根培养 继代丛生芽苗3~5 cm时,切下接种到生根培养基中,每种培养基接种90株。设置7种培养基进行紫花山奈组培苗的生根培养:MS+NAA 0.1 mg/L +香蕉泥10%+活性炭0.5 g/L+白砂糖30 g/L+卡拉胶粉9.5 g/L(C1)、MS+NAA 0.3 mg/L +香蕉泥10%+活性炭0.5 g/L+白砂糖30 g/L +卡拉胶粉9.5 g/L(C2)、MS+NAA 0.5 mg/L +香蕉泥10%+活性炭0.5 g/L +白砂糖30 g/L +卡拉胶粉9.5 g/L(C3)、MS+NAA 0.1 mg/L +香蕉泥15%+活性炭1.0 g/L+白砂糖30 g/L+卡拉胶粉9.5 g/L(C4)、MS+NAA 0.3 mg/L +香蕉泥15%+活性炭1.0 g/L+白砂糖30 g/L +卡拉胶粉9.5 g/L(C5)、MS+NAA 0.5 mg/L +香蕉泥15%+活性炭1.0 g/L+白砂糖30 g/L +卡拉胶粉9.5 g/L(C6)、MS+白砂糖30 g/L +卡拉胶粉9.5 g/L(C7),pH值均为5.8~6.0。20 d后统计生根率、单苗平均根数、根长和污染率:

1.2.5 培养条件 培养室温度设为25~30℃,光照强度为2 000~2 300 lx,光照时间控制为14 h/d。
1.2.6 组培苗的移栽 取出组培苗,洗净根部培养基,0.1%的百菌清溶液浸泡30 min,移栽到体积比1∶1∶1的进口泥炭、红壤、腐叶土基质中。观察长势,统计成活率。

试验数据采用Excel 2016整理,应用SPSS16.0软件的One-Way ANOVA模块进行方差分析和LSD法进行多重比较。
2 结果与分析
2.1 紫花山奈芽基部的继代增殖
从表1和图2(封二)可以看出,培养20 d后,不同浓度6-BA和NAA的培养基对紫花山奈芽基部增大倍数和出芽数有明显的影响。6种培养基的紫花山奈芽基部污染率均在3.13%以下,芽基部增大倍数为1.50~1.89倍,出芽数为0.81~1.74。因此,紫花山柰的有效芽基部继代增殖,6-BA的浓度范围为8~12 mg/L,NAA浓度范围为0~0.1 mg/L。芽基部增大倍数最大且出芽数最低的为A4,因此,A4为紫花山奈的最佳芽基部增殖培养基。
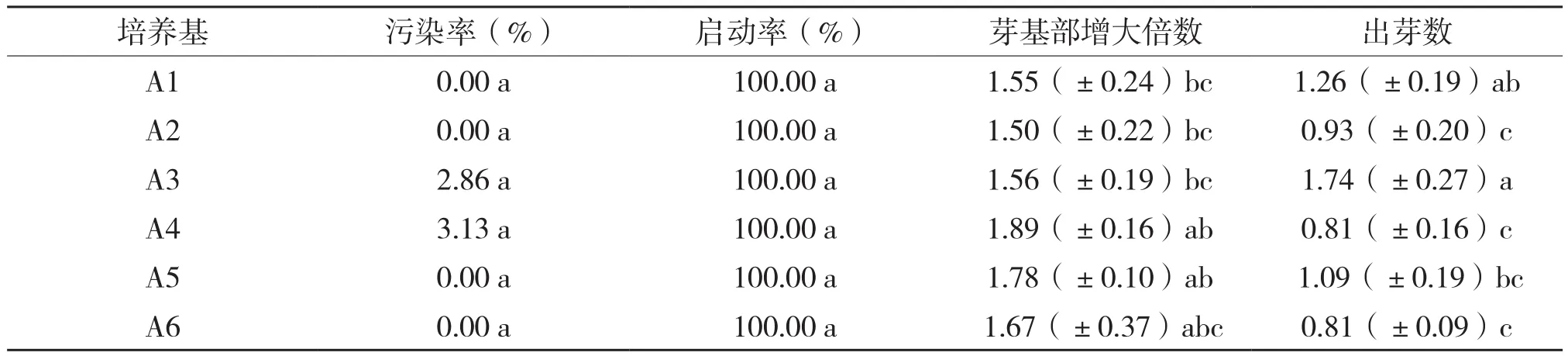
表1 紫花山柰芽基部增殖培养结果
2.2 紫花山奈的丛生芽诱导
由表2可知,6种紫花山奈丛生芽诱导培养基的启动率均在83%以上,污染率在3.33%以下,出芽数a等级的为B1,出芽数为5.53;其次,bc等级的为B3、B4和B5,出芽数分别为3.50,3.30和4.00;c等级的为B2和B6,出芽数分别为3.00、3.04。从图3(封二)还可看出,B1培养基可分化出4~7个丛生芽,叶绿且丛生芽长势好;B3,B4和B5培养基可分化出3~6个丛生芽;B2和B6培养基可分化出2~5个丛生芽。因此,紫花山奈芽基部的丛生芽诱导,6-BA的适合浓度范围为3~5 mg/L,NAA的适合浓度范围为0.05~0.1 mg/L,其中以6-BA 3 mg/L和NAA 0.05 mg/L为最佳,有长势好、数量多的丛生芽。

表2 紫花山柰丛生芽诱导培养结果
2.3 紫花山奈的生根培养
从表3可以看出,C1~C7培养基的生根率均在94%以上,污染率在8.00%以下,平均每株生根数为a等级:C1和C4培养基的生根数分别为4.94、4.71条根;平均根长为a和b等级,C4和C1培养基的根长分别为4.18、3.16 cm,其余均为c等级。由图4(封二)也可以看出,平均每株生根数最多的为C4和C1。因此,紫花山奈生根比较合适的培养基为MS+NAA 0.1 mg/L+香蕉泥10~15%+活性炭0.5~1.0 g/L+白砂糖30 g/L+卡拉胶粉9.5 g/L。
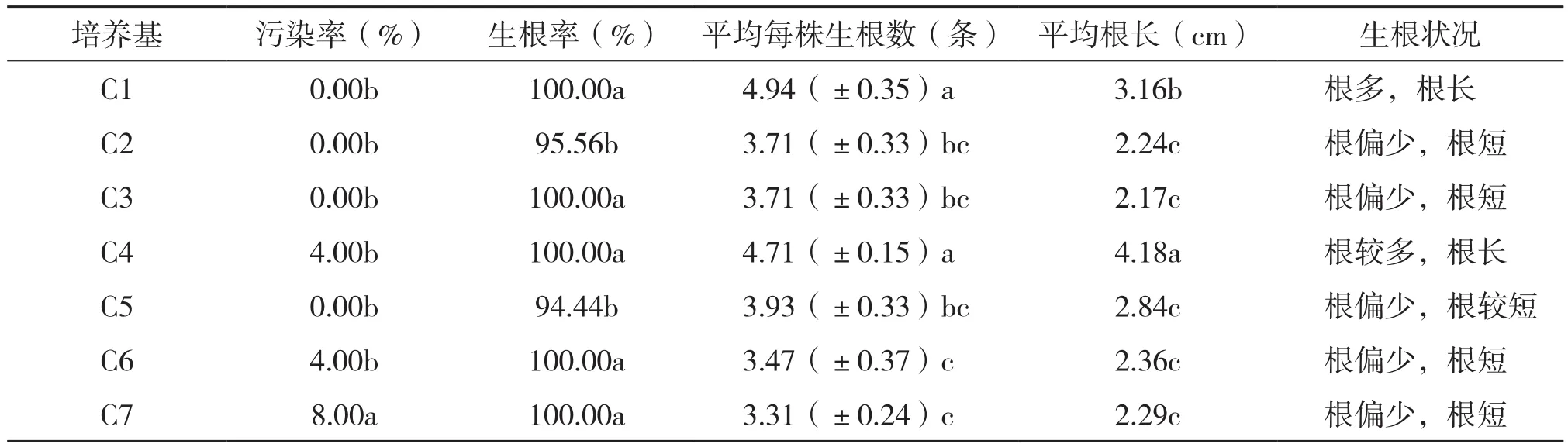
表3 紫花山柰生根诱导培养结果
2.4 紫花山奈组培苗移栽
将紫花山奈的组培苗洗净根部培养基,0.1%的百菌清溶液浸泡30 min,移栽到进口泥炭、红壤、腐叶土的基质中,成活率达80%以上,长势良好,如图3D(封二)所示。
3 结论与讨论
由于姜科植物的多样性,不同姜科植物组培的步骤和培养基也不同。目前,红姜花、白姜花、海南三七、山奈、土田七、姜黄、春秋姜黄和芒果姜等姜科植物采用不同的外植体[8-13],如未成熟花丝、花药、茎尖、叶、叶鞘、块茎芽、幼嫩根茎和根茎芽基部,进行外植体灭菌技术、离体培养条件和培养基配方筛选方面的研究,建立了较好的组织培养快繁体系[14-20]。
山奈属不同种植物在外植体相同的情况下,其组织培养的步骤和培养基也不同,如海南三七根茎芽基部为外植体时,丛生芽诱导的最佳培养基为MS+6-BA 3 mg/L+NAA 0.1 mg/L+3%蔗糖+卡拉胶粉10 g/L+10%椰汁[8];海南三七组培苗的幼芽或茎尖,接种于MS+6-BA3 mg/L+2,4-D 1 mg/L培养基中,20 d左右有愈伤组织产生,30 d左右有绒毛状根生成。但发现,接种到两种培养基(MS+6-BA 2~3 mg/L+NAA 0.1 mg/L)上诱导,均只有10%诱导成苗[9];海南三七无菌苗的假茎基部,在暗培养条件下能获得高质量的愈伤组织,最佳生长调节剂组合为6-BA 2 mg/L+2,4-D 1 mg/L,但从外植体诱导愈伤到分化成苗只需110 d,每块愈伤分化成苗2.38~3.75个,周期长[10];山奈块茎刚萌发的芽为外植体时,适宜的诱导培养基为MS+6-BA 3.0 mg/L+NAA 0.1 mg/L,芽萌发率达100%,分化率为146.67%[11];我们前期研究发现,取紫花山奈根茎上萌发的芽基部为外植体,接种至诱导培养基MS+6-BA 3~5 mg/L+NAA 0.1 mg/L+椰汁10%+蔗糖20 g/L+卡拉胶粉9.5 g/L上,接种60 d后,芽的诱导率为0;本研究通过调整培养基中6-BA和NAA的浓度,先增殖芽基部,切割增殖的芽基部后,再转移至丛生芽诱导培养基,这一过程可有效诱导丛生芽,在短期内获得大量性状稳定的紫花山奈种苗。
本研究结果表明,紫花山柰无菌苗芽基部继代增殖比较合适的培养基为MS+6-BA8~12 mg/L+NAA0~0.1 mg/L+椰汁10%+白砂糖30 g/L +卡拉胶粉10 g/L,最佳的继代增殖培养基为MS+6-BA8 mg/L+NAA 0.1 mg/L+椰汁10%+白砂糖30 g/L+卡拉胶粉10 g/L;丛生芽诱导比较合适的培养基为MS+6-BA3~5 mg/L+NAA 0.05~0.1 mg/L+椰 汁 10%+白 砂 糖 30 g/L+卡拉胶粉10 g/L,最佳的丛生芽诱导培养基为MS+6-BA3 mg/L+NAA 0.05 mg/L+椰汁10%+白砂糖30 g/L+卡拉胶粉10 g/L;生根较佳的培养基为MS+NAA 0.1 mg/L+香蕉泥10~15%+活性炭0.5~1.0 g/L+白砂糖30 g/L+卡拉胶粉9.5 g/L。

图1 紫花山奈无菌苗

图2 紫花山柰芽基部的继代增殖

图3 紫花山柰的丛生芽诱导

图4 紫花山柰的生根培养和组培苗移栽

