激素处理对NtQPT干涉表达烟草种子萌发及生长影响研究
, , , ,2
(1.贵州大学农业生物工程研究院/生命科学学院/山地植物资源保护与种质创新省部共建教育部重点实验室, 贵阳 550025;2.贵州省农业科学院, 贵阳 550006)
喹啉酸核糖基转移酶(quinolinic acid phosphoribosyltransferase,QPT)是烟草烟碱(nicotine)合成的限速酶[1-2]。QPT在催化烟碱重要结构1, 2-二氢吡啶(1,2-dihydropyridine)环形成的过程中,也催化其前体物烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的产生[3],而后者又可作为多种酶的辅酶调节机体的能量代谢、呼吸链电子传递、蛋白翻译后修饰、Ca2+信号通路和基因沉默等生理过程, 并最终影响生物体的生长发育[4-5]。研究表明,QPT基因沉默不仅可引起转基因烟草株高的明显矮化,还会导致部分转基因植株的叶片数、开花数显著减少及花粉发育畸形或不育等现象[6]。植物体中除NAD等初生代谢物会直接影响植物生长发育外, 次生代谢物(如植物激素)也能调节植物的发育和生长[7]。研究表明, 植物体不仅能通过调节体内ABA(abscisic acid)与GA(gibberellin)的平衡促进或抑制种子萌发[8],也可通过调节6-BA(6-benzylaminopurine)和IAA(indoleacetic acid)的比例来调节植物的生长及品质[9]。本研究以QPT干涉表达的T1代转基因烟草种子及烟苗为材料, 分析ABA和6-BA处理对转基因烟草种子萌发及烟苗生长的影响, 同时分析不同激素引起的转基因植株理化性质的动态变化规律, 为探讨QPT基因与ABA或6-BA协同调控转基因烟草种子萌发及烟苗生长提供理论基础。
1 材料与方法
1.1 材 料
普通烟草(NicotianatobacumL.)品种“Xanthi”、T1代超量表达和干涉表达QPT基因烟草种子由贵州大学农业生物工程研究院保存并提供。6-BA和ABA均购于Sigama Aldrich公司; DNA Marker 购于Takara 生物工程公司;植物DNA提取试剂盒购于Tiangen Biotech(Beijing)Co.,Ltd.,超氧化物歧化酶(superoxide dismutase,SOD)购于Suzhou Comin Biotechnology Co.,Ltd.;无水乙醇(分析纯)购于Tianjin Kemiou Chemical Reagent Co.,Ltd.。
1.2 方 法
1.2.1 激素对烟种进行处理
参照秦利军等[10]的方法略有改动,分别对转基因及野生型烟草种子的萌发指标进行统计。挑选饱满、大小一致的T1代QPT超量表达与干涉表达烟草种子和同批繁殖的野生型烟草的种子依次经70%酒精和2.5% NaClO表面消毒后用无菌水清洗3~5次, 分别置于垫有2层灭菌滤纸且分别含有5 mg/L 6-BA和2 mg/L ABA的9 cm培养皿中进行萌发处理(约5 mL激素溶液, 以无菌水作为对照), 每皿播种50粒种子, 每处理设置5 个重复。在25 ℃光照培养箱中培养(光照16 h/黑暗8 h),种子萌发以露白计,记录19 d内烟草种子的发芽率、发芽势及发芽指数等指标。测定指标按下列公司进行计算:
发芽率(%)=第19天发芽种子数/供试种子数×100%;
发芽势(%)=第10天发芽种子数/供试种子数×100%;
发芽指数=∑(Gt/Dt)。
式中,Gt为逐日发芽数,Dt为相应发芽天数。
1.2.2 转基因植株PCR鉴定
剪取T2代烟苗的叶片少量进行GUS化学组织染色, 提取GUS染色阳性植株叶片总DNA用于PCR鉴定。PCR扩增体系(20μL):正反向引物(20μmol/L)各加 1μL,Premix rTaq10μL,DNA 模板1μL,dd H2O 7μL。扩增条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸1 min,35个循环;72 ℃ 延伸7 min,4 ℃保存。特异性检测引物对FQPT/RQPT序列分别为:F-QPT:5’-CGCACAATCC-CACTATCCTT-3’;R-QPT:5’-TTAGAGCTTTGCCGACACCT-3’。
1.2.3 激素对烟苗进行处理及记录
将清水萌发的转基因与非转基因烟草种子移栽至育苗盘,待种子长至大十字期时栽种到花盆中,隔3~5 d浇1次水。烟苗生长到拔节期时分别用6-BA(40 mg/L)和ABA(20 mg/L)进行喷施处理, 每个处理重复3次, 以超量表达QPT烟草和野生型烟草为对照处理。同时, 每实验组各设置3个以清水喷施的空白对照。种植期间隔一定距离, 定期进行灌根浇水以保证烟株生长对水分的需求。激素喷施处理周期为21 d,每周喷3次激素,每株定量喷施10 mL, 并在实验起始的7,14,21 d做烟草形态指标观察和记录。
参照国家烟草专卖局2010年发布的烟草农艺性状调查测量方法(Investigating and measuring methods of agronomical character of tobacco)YC/T 142-2010标准对激素处理烟草植株的农艺性状,包括株高、真叶数、茎围、最大叶长和最大叶宽等指标进行观察、记录,每个测定指标测定3次。
1.2.4 激素处理对烟草理化性质影响
选取拔节期、生长一致的烟草植株进行全株喷施ABA(20 mg/L)和6-BA(40 mg/L)激素溶液, 分别取喷施处理前、喷施后第1、3天烟草植株自上向下第4片真叶进行SOD酶活测定。酶活测定参照Suzhou Comin Biotechnology Co.,Ltd.操作说明以酶标法进行测定, 每组以混样的方式取样(即以3个生物学重复样品做混池),每组重复测定3次,以野生型和超量表达QPT烟草为对照组,清水喷施处理为空白组。
叶绿素含量按邹琦[11]方法测定, 将取好的叶片放在研钵中, 加入少许石英砂与碳酸钙粉, 在加入3 mL 96%乙醇磨成匀浆合并提取液并定容至25 mL棕色容量瓶, 避光保存, 在波长665 nm、649 nm、470 nm测定其光密度, 分别按下式进行叶绿素a(chlorophyll a)、叶绿素b(chlorophyll b)、类胡萝卜素(carotenoid)和叶绿素色素含量计算:
Ca=13.95 D665-6.88 D649;
Cb=24.96 D649-7.32 D665;
Cx=(1 000 D470-2.05 Ca-114.8 Cb)/245;
叶绿素色素含量=提取液体积×色素浓度(C)×稀释倍数/样品鲜重(mg/g)。
1.2.5 数据处理
以Microsoft Excel 2011软件对上述测定的所有原始数据进行平均值和标准误差计算、作图, 以SPSS 17.0软件对各个测定值得显著性进行分析。
2 结果与分析
2.1 激素处理对转基因烟种萌发的影响
从表1结果可知,相比较野生型和超量表达烟草,以5 mg/L 6-BA处理均能显著提高QPT干涉植株种子的GP、GE和GI。萌发统计结果(以种子露白计)表明,5 mg/L 6-BA处理第9天时干涉表达QPT烟草种子基本全部发芽,发芽率高达91.33%,而超量表达QPT和野生型种子到第11天时才完全发芽, 发芽率分别为58.67%和52.67%,且两者差异不显著。6-BA对QPTi烟株种子萌发促进作用相较WT和QPT植株分别提高55.67%和73.40%。与野生型相比,6-BA处理也能促进QPT烟草种子的萌发, 但两者差异不显著;以2 mg/L ABA处理能明显抑制WT和QPT烟草种子的萌发,抑制率分别可达99.33%和94%,相比之下ABA对QPTi种子萌发抑制率为63.4%,说明QPT基因干涉后转基因烟草表现出对ABA的低敏感性,种子萌发相较野生型和超量表达植株影响较小;QPT烟株和WT烟株种子分别在ABA处理后的第14天和第17天才开始萌发,而QPTi烟株种子在激素处理后的第10天就开始萌发。
表1 种子发芽指标测定

激素种子类型发芽率(%)发芽势(%)发芽指数QPT58.67±8.8160±8.7*30.51±3.58*6-BAQPTi91.33±3.53**91.33±3.5**50.98±3.33**WT52.67±5.3352.67±5.325.46±1.26QPT6.00±1.161.33±0.70.51±0.12ABAQPTi36.67±10.41**24.67±7**6.50±2.09*WT0.67±0.670.00±0.000.04±0.036
注:QPT为超量表达烟草植株;QPTi为干涉表达烟草;WT为野生型烟草。以各组中野生型种子萌发指标为对照,N=50,“*”代表p<0.05,“**”代表p<0.01。
2.2 转基因植株的获得与鉴定
以T1代种子萌发的烟草幼苗为材料进行GUS染色及PCR验证,以确定获得QPT超量和QPT干涉表达稳定遗传的转基因烟草植株。剪取萌发至3~5叶期中心叶片进行GUS染色, 超量表达和干涉表达烟草幼叶均染成蓝色, 野生型未出现变化(图1 A);进一步对2种转基因烟草GUS染色阳性的植株进行PCR扩增,分别从超量表达烟草和干涉表达烟草中扩增到大小为750 bp和500 bp的特异性条带(图1 B),说明QPT超量表达片段与QPT干涉片段已经完全整合到烟草基因组中并能进行稳定的遗传。生长后期, 野生型植株生长状态显著优于两种转基因植株(图1 C)。
2.3 激素处理对烟草形态指标的影响
植物激素通过调节其在植株内的和表达水从而影响植物个体的生长发育,研究分别以20 mg/L ABA和40 mg/L 6-BA对转基因和非转基因烟草进行喷施处理以研究不同激素对QPT干涉烟草植株形态的影响。研究结果表明,以清水处理的超量表达和干涉表达QPT烟草在第7、14天和第21天的叶片数、株高、叶宽、叶长和茎围等指标都显著高于野生型植株(表1,表2,表3),但以40 mg/L 6-BA对烟草植株进行处理时, 发现转基因(QPT和QPTi)和野生型植株在各测定各时期(处理第7、14天和第21天)的形态指标均受到一定程度抑制, 其中以第21天时6-BA对野生型烟草的叶片数、株高、叶宽和叶长指标抑制程度最高,QPT烟草次之,QPTi烟草最低; 与QPTi烟株相比较,以40 mg/L 6-BA处理第21天时野生型烟草植株下同。

注:QPT为超量表达烟草;QPTi为干涉表达烟草;WT为野生型烟草;M为5 000 bp DNA Marker Ladder;P 1、P 2为阳性质粒对照;Q 1~Q 3为超量表达烟草植株;q 1~q 3为干涉表达烟草植株。图1 转基因植株鉴定及生长形态观察
表2 激素处理第7天烟草农艺性状测定
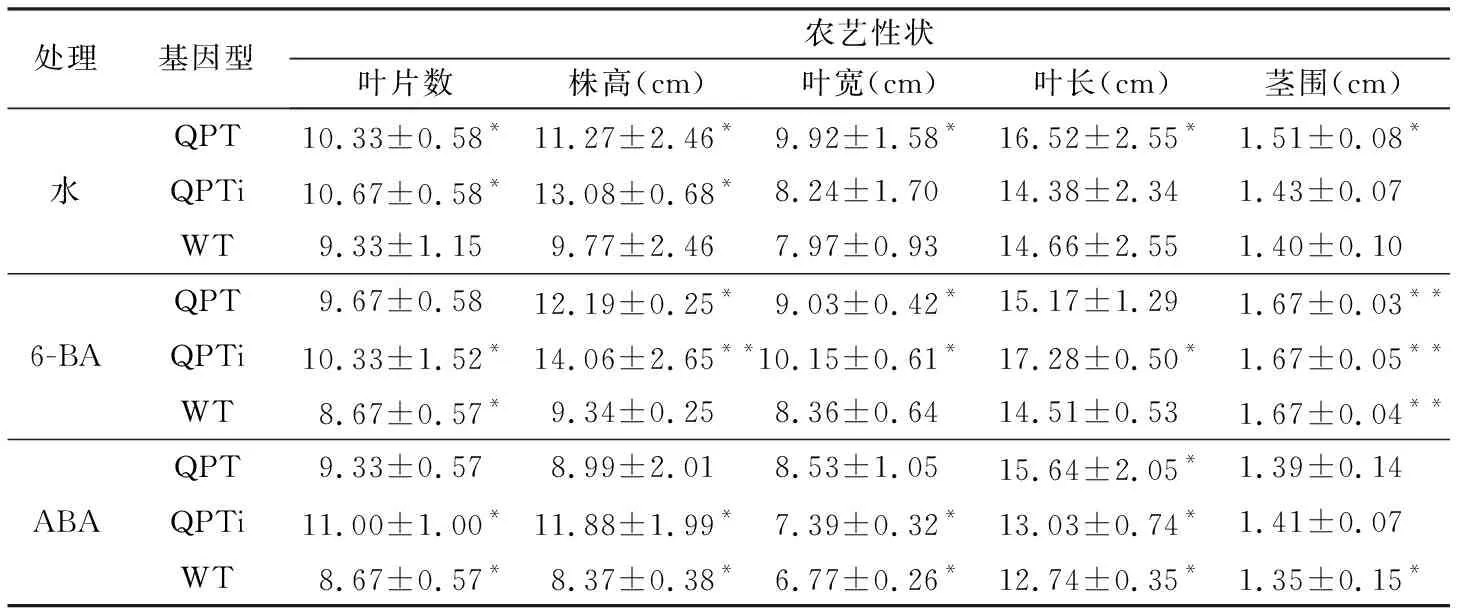
处理基因型农艺性状叶片数株高(cm)叶宽(cm)叶长(cm)茎围(cm)QPT10.33±0.58*11.27±2.46*9.92±1.58*16.52±2.55*1.51±0.08*水QPTi10.67±0.58*13.08±0.68*8.24±1.7014.38±2.341.43±0.07WT9.33±1.159.77±2.467.97±0.9314.66±2.551.40±0.10QPT9.67±0.5812.19±0.25*9.03±0.42*15.17±1.291.67±0.03**6-BAQPTi10.33±1.52*14.06±2.65**10.15±0.61*17.28±0.50*1.67±0.05**WT8.67±0.57*9.34±0.258.36±0.6414.51±0.531.67±0.04**QPT9.33±0.578.99±2.018.53±1.0515.64±2.05*1.39±0.14ABAQPTi11.00±1.00*11.88±1.99*7.39±0.32*13.03±0.74*1.41±0.07WT8.67±0.57*8.37±0.38*6.77±0.26*12.74±0.35*1.35±0.15*
注:n=3,“*”为差异显著(p<0.05),“**”为差异极显著(p<0.01),显著性均与清水对照相比较。
表3 激素处理第14天烟草农艺性状测定

处理基因型农艺性状叶片数株高(cm)叶宽(cm)叶长(cm)茎围(cm)QPT13.33±0.58*22.64±3.58*12.10±0.26*19.92±0.21.84±0.07*水QPTi13.33±0.57*20.91±2.5110.37±1.8517.66±2.38*1.67±0.18WT12.33±1.1520.35±3.7210.57±1.1719.82±2.871.69±0.08QPT13.00±1.00*19.29±3.2410.03±0.6016.81±1.29*1.93±0.156-BAQPTi12.00±1.0021.30±3.2910.78±0.2917.62±0.45*1.84±0.03*WT11.33±0.58*16.74±1.17*9.42±0.55*15.3±0.94**1.93±0.08QPT11.67±0.58*18.25±4.42*9.87±1.26*17.31±2.20*1.71±0.08ABAQPTi13.33±1.52*19.02±1.549.47±0.15*16.17±0.57*1.53±0.32*WT9.67±0.58**14.49±0.96*7.57±0.47**14.19±0.6**1.43±0.11**
叶片数、株高、叶宽和叶长指标的抑制率分别为 81.6%、83.9%、86.7%和87.6%。另外,20 mg/L ABA处理也可抑制3种烟草植株的株高、叶片数和茎围等指标增加,其中以对野生型烟草抑制最为显著。研究结果显示,尽管20 mg/L ABA对烟株的生长也具有抑制作用,但其抑制效果相较40 mg/L 6-BA弱。相较QPTi植株,在ABA处理后第7、14天和第21天时野生型植株的叶片数和株高指标的抑制率分别为78.8%、72.54%、71.1%和70.5%、76.2%、84.5%,表明随着处理天数的推移对这2个差异最为显著的指标抑制也减弱。
2.4 激素处理对烟草理化指标的影响
2.4.1 激素处理对烟草SOD酶活性的影响
SOD酶活测定结果表明,2种激素(20 mg/L ABA和40 mg/L 6-BA)处理前,QPTi植株与WT和QPT植株间酶活均存在显著差异, 但后两者间SOD酶活无显著差异,推测QPT基因的干涉能显著提高干涉植株的氧化保护酶活性。随着激素处理的推移,ABA和6-BA处理引起的SOD酶活都出现先降低后升高的趋势, 但酶活的降幅和增幅在不同株系烟草中有一定差异。激素处理QPT、QPTi、WT植株1 d时,其SOD酶分别下降了32.41%、44.13%和17.83%,而ABA处理的分别下降13.36%、42.78%、10.77%,可知3种烟草株系中以QPTi烟草SOD酶活性对2种激素的应答最为显著,降幅也最大。但当激素处理3 d时,SOD酶活在WT、QPT和QPTi植株中都表现出不同程度的增加,相较处理1 d时SOD酶活,6-BA处理引起超量表达、干涉表达和野生型植株中酶活性分别上升46.03%、46.18%和32.06%,而ABA处理引起的SOD酶活增加分别为31.80%、29.51%和15.51%。
表4 激素处理第21天烟草农艺性状测定

处理基因型农艺性状叶片数株高(cm)叶宽(cm)叶长(cm)茎围(cm)QPT16.67±0.58*30.50±3.5912.79±0.70*21.72±0.89*1.99±0.03*水QPTi16.00±0.00*26.69±3.31*11.16±1.9618.78±1.63*1.82±0.13WT14.67±1.5228.68±3.9311.62±1.1220.73±1.981.84±0.09QPT16.33±0.58*24.74±5.02*10.49±0.97*17.29±1.23*2.12±0.15**6-BAQPTi15.33±2.3025.64±3.34*11.24±0.4717.76±0.431.93±0.02*WT13.33±0.58*21.50±1.82*9.75±0.2*15.55±0.60**2.08±0.14**QPT14.00±0.0025.72±4.6*11.57±0.6720.10±1.441.95±0.04*ABAQPTi15.00±1.0022.53±3.02*9.76±0.2*18.53±0.5*1.67±0.06*WT10.67±2.08**19.04±1.06**8.59±1.02**15.57±1.84**1.52±0.09**

注:QPT为超量表达烟草;QPTi为干涉表达烟草;WT为野生型烟草。下同。图2 激素处理对烟草SOD酶活性的影响

图3 激素处理对烟草Ca和Cb含量的影响
2.4.2 激素处理对烟草叶绿素含量的影响
激素ABA和6-BA处理对3种烟草株系的叶绿素a(Ca)和叶绿素b(Cb)均有一定程度影响。就以40 mg/L 6-BA处理而言,该激素对干涉植株Ca含量的抑制程度要高于野生型和超量表达植株。6-BA喷施处理3种烟草植株,在处理第1天时QPT、QPTi和WT植株分别下降16.75%、22.7%和15.35%,到第3天时Ca含量在这3类烟草植株中都有一定程度回升;与6-BA处理结果相同,ABA处理也可引起QPTi、QPT和WT烟株中Cb含量显著下降,其中对QPTi株系Ca含量的影响较其他2个株系显著;同时对激素处理后烟草中Cb测定表明,6-BA处理后Cb含量总的也呈下降趋势,其中以WT降幅最大,达39.63%,QPT和QPTi分别为24.5%、22.08%。但QPTi植株仅在处理第1天时下降幅度最大,为25.08%,之后开始Cb含量开始增加,到处理第3天时增加了4.03%(与处理第1天时比较),而QPT和WT中Cb含量持续下降;短期内(1 d)ABA处理对WT和QPTi植株的Cb含量影响并不大,但对QPT烟株中的Cb影响较显著,到第3天时QPT中Cb含量总降幅为29.09%。

图4 激素处理对烟草Cx和Ct含量的影响
进一步对烟草的类胡萝卜素含量(Cx)和叶绿素总含量测定结果表明,20 mg/L ABA和40 mg/L 6-BA处理后烟草的类胡萝卜素(Cx)合成受到抑制,进而引起Cx含量下降,其中以6-BA处理对Cx含量抑制影响效应高于ABA处理。QPT与QPTi植株中Cx含量的降幅相当且较大,分别为32.15%和31.97%,而WT植株Cx含量下降较低,仅为20.23%;ABA处理引起的QPTi、WT和QPT烟株Cx含量下降分别18.42%、16.15%和14.90%,相较6-BA处理显著低,在3 d时又有一定程度的增加。2种激素引起的植株叶绿素总含量(Ct)总体呈下降趋势,同样以6-BA处理的烟苗影响较大,其中QPTi烟株对6-BA最为敏感,处理后第1天时降幅即达到23.01%,第3天时又下降7.05%,而QPT和WT中Ct含量总体降幅不及QPTi显著,但两者下降趋势一致。以上研究,一方面高浓度细胞分裂素(6-BA)对烟株生长有一定的抑制作用,另一方面QPT基因干涉后通常会表现出对高浓度植物激素具有较敏感的效应,推测QPT具有调节植物在应答高浓度植物激素胁迫生长的代谢过程中具有一定的延缓效应。
3 讨论与结论
QPT不仅是催化烟草烟碱合成的限速酶,也是催化生物体众多酶的辅酶NAD从头合成的关键酶,对植物体的生长发育起着重要的调控作用[12-13]。另外,植物激素对植物种子萌发[14]、生长发育[15]以及品质[16]也同样具有显著的影响。本研究以外源激素对种子和种苗进行处理,分析QPT超量表达及干涉表达转基因烟草材料对激素的应答效应,以探讨激素调控下QPT对烟草萌发生长的调控作用。一方面,低浓度5 mg/L 6-BA能显著促进QPTi种子的萌发,萌发指标发芽率、发芽势、发芽指数与WT、QPT相比呈极显著,QPTi种子的发芽率与WT、QPT相比分别增加73.40%、55.67%,6-BA是一种植物细胞分裂素,具有促进植物芽分化、提高种子活力的功能[17]。但而高浓度40 mg/L 6-BA对QPT、QPTi和WT烟草均产生一定程度的抑制作用,农艺性状如株高、叶宽、叶长等生长都受到影响,其中以对QPT和WT的叶长指标的抑制最显著,分别为15.59%和33.34%,以上结果与成丹等[18]研究不同浓度6-BA对大豆生长萌发影响的结果相似。另一方面,低浓度ABA和高浓度ABA可分别抑制种子萌发和烟株生长。当以2 mg/L ABA处理的烟草种子时,相比较QPTi植株,WT种子受抑制程度最大为98.2%,QPT种子其次,为82.64%;当以20 mg/L ABA处理烟草时,ABA又会显著抑制QPTi和WT的株高、叶长、叶宽、茎围等形态指标生长,其中以对WT植株的抑制程度最大,QPTi次之,对QPT植株抑制程度最小,ABA对前两者株高指标的抑制率分别为33.59%和21.42%。ABA是一种植物生长抑制剂,具有调控叶片衰老、减缓不良环境胁迫、影响种子萌发的作用[19]。王熹等[20]报道了外源植物激素ABA(脱落酸)抑制水稻种子发芽的实质是延缓种子发芽,ABA的处理引起种子体内代谢过程缓慢并最终使得种子萌发率下降,推测本实验中由于统计种子萌发天数的限制导致短期内ABA处理的种子萌发率低。另外,本实验结果与匡勇等[21]报道的脱落酸(ABA)对植物生长发育具有促进作用结论不同,可能是本研究所选的ABA处理浓度仍较高,导致表现出抑制烟草种子萌发的效应。另外,激素处理前QPTi植株SOD酶显著高于另外两种植株,推测QPTi烟草由于QPT基因干涉导致烟碱含量下降,而后者在抗病、抗虫方面具有显著的作用,故其遭到虫害及不良环境的可能性增高,导致QPTi植株处于较高的SOD酶活性。激素处理后所有烟草株系均表现出先降后升的趋势,其中对转QPTi烟草的影响较大,6-BA与ABA处理1 d分别下降44.13%、42.78%,各激素处理后SOD酶活性在第3天后QPT、WT、QPTi的SOD酶活性能呈现出一致性。激素处理的烟苗各叶绿素含量变化有一定差异,且激素处理对QPTi总叶绿素含量影响也是最大的,其下降趋势高于QPT和WT植株。说明QPT基因的正常或超量表达对应答高浓度激素介导的生长抑制作用具有一定的补偿作用,以消除该抑制效应引起的植物生长延滞现象。

