长链非编码CCAT1靶向miR-219a对宫颈癌Hela细胞生长、侵袭和迁移的调节作用
王圣坦,朱根海,洪 澜,吴秀容,纪 武
宫颈癌是女性常见恶性肿瘤之一[1]。据统计,全球每年宫颈癌新发病例可达500 000人,每年宫颈癌死亡人数约为233 000人,严重威胁女性的生殖健康[2]。近年来巴氏涂片筛查法的广泛应用在一定程度上降低了宫颈癌死亡率,但宫颈癌患者的预后仍不容乐观[3]。基因的改变是癌症发生的根本原因,因此,从基因水平上深入探究宫颈癌的发病机制将有利于宫颈癌早期诊断和后期的治疗。长链非编码RNA (long non-coding RNA,LncRNA)是近年来癌症相关研究的一大热点。研究[4-5]表明,结肠癌相关转录因子1 (colorectal cancer associated transcript 1,CCAT1) 在多种癌细胞中均呈高表达状态,能够促进癌细胞增殖、迁移,抑制癌细胞凋亡。沉默CCAT1表达可抑制宫颈癌细胞增殖,诱导癌细胞凋亡,但其对宫颈癌细胞作用的机制还未见报道[6]。研究[7]表明,CCAT1调控细胞增殖、迁移及凋亡的机制与调控其下游微小型RNA (microRNA,miRNA)的表达有关。该研究将采用shRNA沉默CCAT1表达以探究CCAT1对宫颈癌Hela细胞增殖及迁移的作用及其与miR-219a的关系。
1 材料与方法
1.1试剂与仪器RPMI 1640细胞培养液 (货号:11875-093)、胎牛血清 (货号:26400044) 和胰蛋白酶 (货号:25200114) 购自美国Gibco公司;CCAT1 shRNA (sh-CCAT1) 慢病毒载体构建由汉恒生物科技公司完成;miR-219a mimic和miR-219a inhibitor购自美国Invitrogen公司;BCA试剂盒 (货号:C0037) 和CCK-8试剂盒 (货号:P0010) 购自上海碧云天生物技术公司;TRIzol试剂盒、Prime Script反转录试剂盒和SYBR Premix Ex Taq II试剂盒购自日本TaKaRa公司;Ki67 (货号:sc-23900)、半胱天冬酶(Caspase-3,货号:sc-56053)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9,货号:sc-21733)一抗和HRP标记的山羊抗小鼠二抗 (货号:sc-2005) 购自美国Santa Cruz公司;细胞培养箱购自美国ThermoFisher公司;倒置显微镜购自日本Nikon公司;PCR反应扩增仪购自美国ABI公司;电泳槽、半干转膜仪和凝胶成像系统购自美国Bio-Rad公司。
1.2细胞培养宫颈癌细胞(Hela细胞)购自中国科学院细胞库。用含10%胎牛血清的RMPI 1640培养基进行培养。培养条件为37 ℃、5%CO2。3 d传代1次。
1.3细胞转染将细胞传代培养于6孔板中,培养24 h后分别或同时加入sh-CCAT1慢病毒载体、miR-219a inhibitor、miR-219a mimic和不含目的基因的载体 (miR-219a mock),根据转染试剂盒说明书进行转染,转染24 h后收集细胞,进行后续检测。
1.4RT-PCR检测用TRIzol试剂于冰上提取各组细胞总RNA,用Nanodrop 2000检测RNA纯度并选出纯度较高的RNA,根据反转录试剂盒说明书合成cDNA,用PCR仪进行扩增。用SYBR Premix Ex Taq II试剂盒进行定量分析。实验所用到引物均通过Primer 3进行设计。CCAT1上游引物:5′-TTT ATGCTTGAGCCTTGA-3′,下游引物:5′-CTTGCCT GAAATACTTGC-3′;miR-219a上游引物:5′-CTC GCTTCGGCAGCACA-3′;下游引物:5′-GTCGTATC CAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATA CGACAGAATT-3′;GAPDH 上游引物:5′-TCCAA AATCAAGTGGGGCGA-3′;下游引物:5′-TGATGACC CTTTTGGC TCCC-3′。
1.5荧光素酶报告实验通过生物信息预测has-miR-219a上有LncRNA CCAT1连续结合位点,用RT-PCR扩增具有两者结合位点的片段并将该片段插入pMIR-REPORT 荧光素酶载体中,构建has-miR-219a野生质粒,再利用点突变技术对结合位点进行突变,构建has-miR-219a突变质粒。同时,将CCAT1插入到pMIR-REPORT 荧光素酶载体中,用不同量has-miR-219a野生质粒(50 nm,100 nm)、has-miR-219a突变质粒 (Mutant组) 或荧光素酶载体 (mimic-NC) 和CCAT1分别或同时转染细胞,根据Dual Luciferase报告基因试剂盒说明书于避光环境下测定荧光素酶活性。
1.6CCK-8检测将细胞分为sh-Ctrl组、sh-CCAT1组、miR-219a inhibitor组和sh-CCAT1 + inhibitor组,sh-Ctrl组用不含目标片段的慢病毒处理,sh-CCAT1组加入sh-CCAT1进行转染,miR-219a inhibitor组加入miR-219a inhibitor进行处理,sh-CCAT1 + inhibitor组则用sh-CCAT1和miR-219a inhibitor同时转染细胞,分别于转染后的第1、2、3、4、5天用CCK-8试剂盒对细胞增殖速度进行检测。
1.7流式细胞术细胞转染48 h后用0.25%胰酶收集细胞,1 000 r/min离心4 min后,用缓冲液重悬沉淀,并将细胞密度调至5×105个/ml,随后分别加入Annexin V和PI试剂避光孵育15 min,用流式细胞仪检测Hela细胞凋亡程度。
1.8Transwell实验用sh-CCAT1和miR-219a inhibitor处理细胞后,收集细胞,将细胞浓度调整为5×104个/ml。将细胞接种于用基质胶预包被的Transwell小室上层,用无血清培养液培养,小室下层则加入含5%胎牛血清的RMPI 1640培养液,继续培养48 h后用苏木精对小室下层细胞染色,每孔随机选取3个视野进行计数统计。
1.9Westernblot检测用含有蛋白酶抑制剂的RIPA裂解液于冰上提取各组细胞蛋白,用BCA试剂盒检测蛋白浓度,用10% SDS-PAGE分离蛋白并将蛋白转移至PVDF膜。用脱脂牛奶封闭后,加入一抗 (Ki67,1 ∶1 400; Caspase-3,1 ∶1 000; MMP-9,1 ∶1 000) 于4 ℃孵育膜过夜,第2天弃去一抗并清洗后加入HRP标记的山羊抗小鼠二抗于室温封闭1 h,滴加化学发光显色液用凝胶成像系统进行曝光显影。

2 结果
2.1sh-CCAT1对宫颈癌细胞CCAT1表达的影响实验结果表明,CCAT1在宫颈癌细胞Hela中呈高表达状态,sh-CCAT1能显著降低Hela细胞CCAT1的表达水平,与sh-Ctrl组比较差异有统计学意义 (F=4.12,P<0.001),表明sh-CCAT1转染成功。见图1。
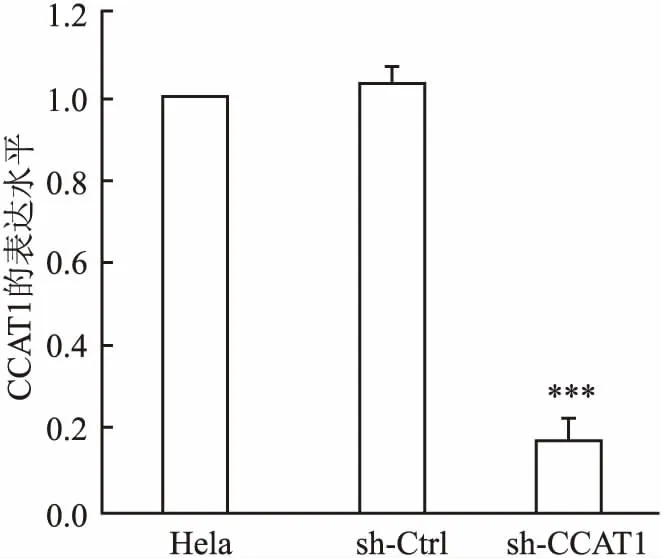
图1 CCT1对宫颈癌细胞CCAT1表达的影响与sh-Ctrl组比较:***P<0.001
2.2sh-CCAT1对宫颈癌细胞miR-219a表达的影响sh-CCAT1能显著升高Hela细胞miR-219a的表达水平 (F=25.45,P<0.05),miR-219a inhibitor可明显抑制miR-219a表达 (F=1.24,P<0.05),sh-CCAT1能明显减弱miR-219a inhibitor对miR-219a的抑制作用 (F=25.63,P<0.05);此外,CCAT1能显著抑制宫颈癌细胞miR-219a表达 (F=1.02,P<0.05),还能明显减弱miR-219a mimic诱导miR-219a表达的作用 (F=1.96,P<0.05)。见图2。
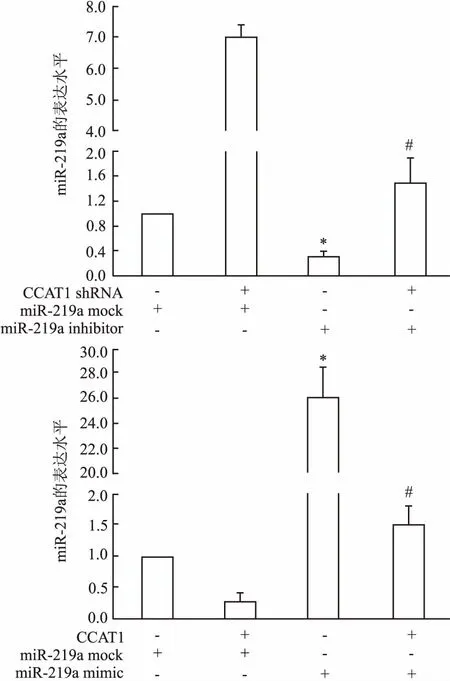
图2 sh-CCAT1对宫颈癌细胞miR-219a表达的影响与miR-219a mock组比较:*P<0.05;与miR-219a组比较:#P<0.05
2.3CCAT1与miR-219a的靶向关系荧光素酶报告实验结果表明,miR-219a野生质粒能显著减弱带有CCAT1片段荧光素酶活性,并具有量效关系 (F=1.13,P<0.05)。结合位点突变后,miR-219a对CCAT1荧光素酶活性的调控作用消失,表明CCAT1与miR-219a存在靶向关系。见图3。
2.4sh-CCAT1对宫颈癌细胞生存能力的影响与sh-Ctrl组比较,细胞转染后第4、5 天,sh-CCAT1组Hela细胞增殖速度明显降低(F=2.78,P<0.05),miR-219a inhibitor组细胞增殖速度明显升高 (F=1.05,P<0.05);与sh-CCAT1组比较,sh-CCAT1+inhibitor组细胞增殖速度明显升高 (F=1.18,P<0.05),见图4。同时,sh-CCAT1组细胞Ki67蛋白表达水平明显低于sh-Ctrl组 (F=2.25,P<0.05),miR-219a inhibitor组Ki67表达水平明显高于sh-Ctrl组 (F=0.28,P<0.05);sh-CCAT1 + inhibitor组Ki67表达水平也显著升高,与sh-CCAT1组比较差异有统计学意义 (F=4.13,P<0.05)。见图5。此外,沉默CCAT1能显著诱导Hela细胞凋亡 (9.7 ± 0.06) 及凋亡相关蛋白Caspase-3的表达 (F=4.02,P<0.05),miR-219a inhibitor能显著抑制Hela细胞凋亡 (0.8 ± 0.2) 及Caspase-3的表达 (F=9.00,P<0.05),并且还可明显减弱sh-CCAT1对细胞凋亡 (3.4 ± 0.4) 和Caspase-3表达的诱导作用 (F=4.01,P<0.05),见图5、6。

图3 CCAT1与miR-219a的靶向关系1: mimic-NC组;2:miR-219a (50 nm)组;3: miR-219a (100 nm) 组;4:Muant组;与mimic-NC组比较:*P<0.05,**P<0.01
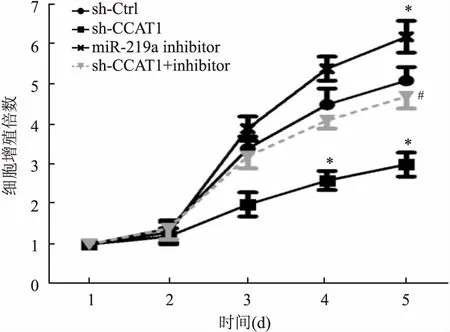
图4 sh-CCAT1对宫颈癌细胞增殖的影响与sh-Ctrl组比较:*P<0.05;与sh-CCAT1组比较:#P<0.05
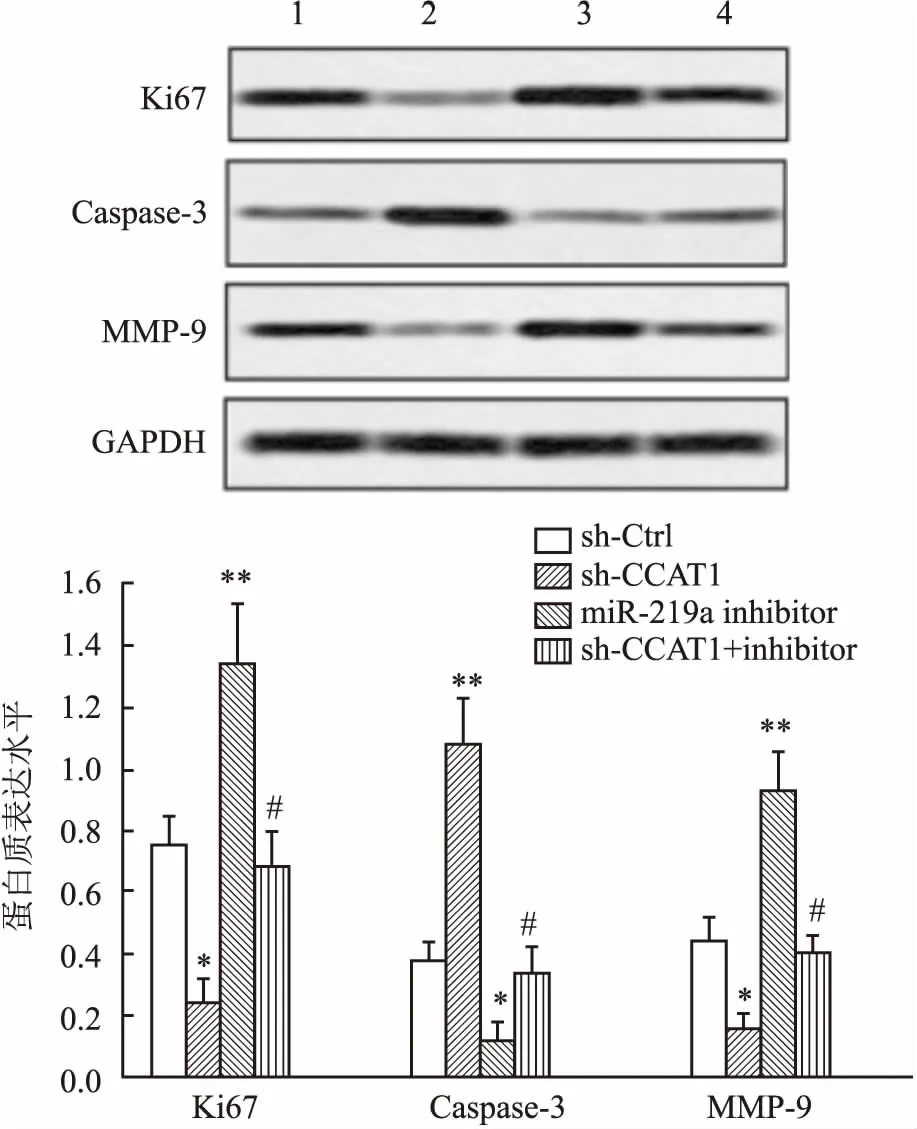
图5 sh-CCAT1对细胞增殖、凋亡和迁移相关蛋白表达的影响1:sh-Ctrl组;2: sh-CCAT1组;3: miR-219a inhibitor 组;4: sh-CCAT1 + inhibitor;与sh-Ctrl组比较:*P<0.05,**P<0.01;与sh-CCAT1组比较:#P<0.05
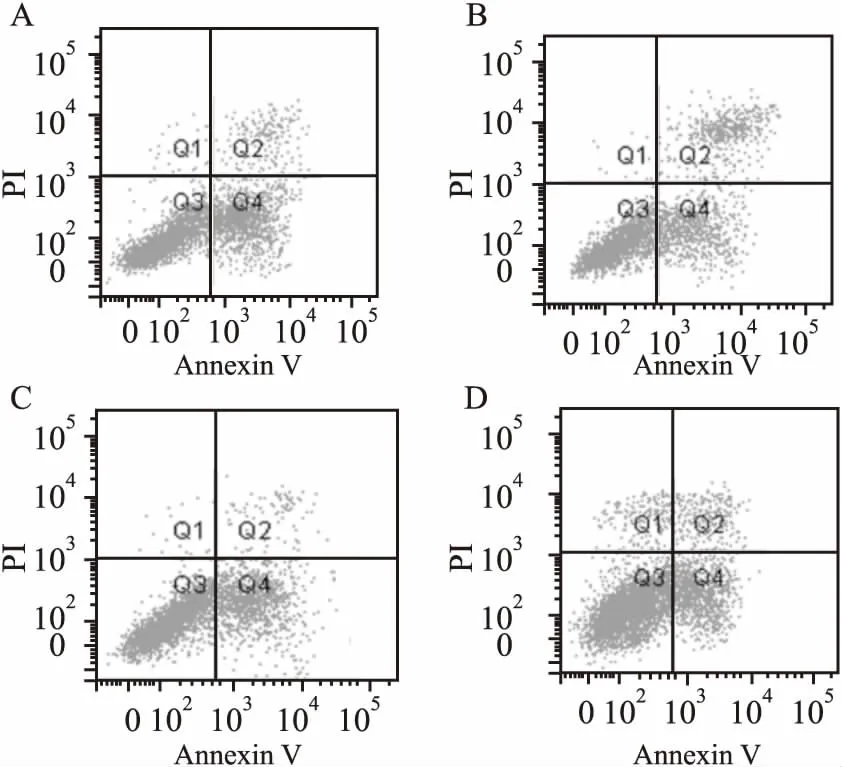
图6 sh-CCAT1对Hela细胞凋亡的影响A:sh-Ctrl组;B: sh-CCAT1组;C: miR-219a inhibitor 组;D: sh-CCAT1 + inhibitor组
2.5sh-CCAT1对宫颈癌细胞侵袭迁移能力的影响与sh-Ctrl组比较,sh-CCAT1组侵袭细胞数量明显减少 (F=4.00,P<0.05),miR-219a inhibitor组侵袭细胞数明显增多 (F=2.25,P<0.05);与sh-CCAT1组比较,sh-CCAT1 + inhibitor组侵袭细胞数明显增多 (F=4.23,P<0.05),见图7。同时,sh-CCAT1组细胞迁移相关蛋白MMP-9表达水平与sh-Ctrl组比较明显降低 (F=4.08,P<0.05),miR-219a inhibitor组MMP-9表达水平明显升高 (F=2.25,P<0.05); sh-CCAT1 + inhibitor组MMP-9的蛋白表达水平也显著高于sh-CCAT1组,差异有统计学意义 (F=2.25,P<0.05),见图5。

图7 sh-CCAT1对宫颈癌细胞侵袭迁移能力的影响 ×100A: sh-Ctrl组;B: sh-CCAT1组;C: miR-219a inhibitor 组;D: sh-CCAT1 + inhibitor组;与sh-Ctrl组比较:***P<0.001;与sh-CCAT1组比较:##P<0.01
3 讨论
LncRNAs是一类不具蛋白质编码功能的RNA。近年来研究[8]表明,LncRNAs参与了机体基因表达的调控,其异常表达与疾病的发生发展密切相关,尤其是癌症。宫颈癌是女性常见的生殖系统癌症[9]。研究[10-12]表明,LncRNA GAS5、MEG3和XLOC 010588等在宫颈癌中表达降低。HOTAIR、EBIC、CCHE1和CCAT1等在宫颈癌细胞中表达明显升高,其高表达能够促进癌细胞的增殖,抑制癌细胞凋亡[6,13]。其中,CCAT1是一类位于转录因子C-Myc附近的LncRNA,其主要参与细胞周期和癌症发生发展的调控[14]。正常细胞中,只有肝脏细胞和小肠细胞中可以检测到微量的CCAT1[15]。本研究首先采用RT-PCR检测了CCAT1在宫颈癌细胞Hela中的表达情况,实验结果显示CCAT1在宫颈癌Hela细胞中基因表达水平明显升高,进一步证明CCAT1可能是一类致癌基因。
研究[16]表明,LncRNAs与miRNA之间存在相互调控作用。LncRNAs与miRNAs之间的相互调控可影响细胞的生长、凋亡及癌症发生和转移[17]。LncRNAs可通过抑制miRNAs的表达抑制基因沉默复合物的形成,从而减弱miRNAs的基因沉默功能[17]。研究[7]表明,CCAT1可通过下调miR-181b的表达促进胶质瘤细胞增殖和侵袭,沉默CCAT1可促进miR-181b的表达。本研究首先通过生物信息预测显示CCAT1与miR-219a可能存在靶向调控关系。进一步研究表明,CCAT1过表达能显著抑制Hela细胞miR-219a的表达,miR-219a mimic 能明显减弱CCAT1对miR-219a的抑制作用。敲除CCAT1能明显升高宫颈癌Hela细胞miR-219a的mRNA水平,提示CCAT1可能靶向调控宫颈癌Hela细胞miR-219a的表达。荧光素酶报告实验也进一步表明CCAT1和miR-219a之间存在靶向调控关系。
miRNAs可以调控多个生物学过程,包括细胞增殖、存活、凋亡和转移。miR-219a是一类抑癌基因,在多种癌细胞中均呈低表达状态,上调miR-219a表达能抑制成神经管细胞瘤、肝癌、乳腺癌等癌细胞增殖[18-20]。本研究显示沉默CCAT1能显著抑制Hela细胞增殖,并能抑制增殖标记蛋白Ki67的表达,同时sh-CCAT1还能诱导宫颈癌细胞凋亡及凋亡相关蛋白Caspase-3的表达,miR-219a inhibitor能明显减弱sh-CCAT1对细胞增殖和凋亡的调控作用,提示沉默CCAT1表达后,CCAT1对miR-219a的抑制作用消失,miR-219a表达显著抑制了宫颈癌细胞增殖。表明CCAT1高表达可通过下调miR-219a表达促进宫颈癌Hela细胞增殖、抑制凋亡。
癌细胞侵袭和转移是多类癌症的生物学特性,并且与癌症的发展密切相关。已有研究[21]表明,CCAT1能促进癌细胞侵袭和迁移。miR-219a能抑制癌细胞转移[19]。本研究表明,沉默CCAT1能显著减弱宫颈癌Hela细胞侵袭迁移能力,抑制miR-219a表达能明显促进癌细胞迁移,并且还能明显减弱sh-CCAT1对Hela细胞侵袭迁移能力的抑制作用,表明CCAT1能促进宫颈癌Hela细胞侵袭和迁移,并且其作用机制与其下调miR-219a的表达有关。
综上所述,沉默CCAT1能抑制宫颈癌Hela细胞增殖和迁移,同时还能诱导癌细胞凋亡,其机制与下调miR-219a的表达有关。本文首次探究了CCAT1对宫颈癌Hela细胞侵袭迁移能力的影响,发现CCAT1对宫颈癌Hela细胞作用的机制与抑制miR-219a的表达有关,可能为宫颈癌的治疗提供了新的潜在治疗靶标。

