薄层色谱法与高效液相色谱法对18F-FDG放射化学纯度测定的比较研究
雷震山 陈立光 张勤国 梁明泉 邓庆荣
正电子发射断层显像(positron emission tomography, PET)是一种先进的核医学影像技术, 而计算机断层摄影术(computed tomography, CT)是一种X线断层成像技术, 并已在临床广泛应用。PET/CT是二者的有机结合, 是近年发展起来的先进核医学技术, 有广阔的应用前景。PET/CT通过影像记录细胞增殖的标记分子, 从而预测肿瘤和心脏、脑部疾病的个性化治疗反应[1-3]。18F-FDG是目前临床上常用的正电子放射性药物, 可用于肿瘤、心肌存活以及中枢神经系统疾病的诊断。18F-FDG大部分由医院自行制备, 经过在国内近20年的临床试用, 2015年版《中国药典(二部)》[4]开始将其收载为18F-FDG。随着我国PET/CT扫描仪普及以及回旋加速器药物生产系统投入使用,18F-FDG的制备、药品质量控制和用药安全越来越受到国家药监部门的重视。作为正电子类放射性核素标记的放射性药物, 在所用质量控制指标中18F-FDG的放化纯度是最重要的指标, 其放化纯度的高低严重影响着PET/CT扫描的图像质量, 从而影响影像医学专家的诊断。《中国药典(四部)》[5]明确规定18F-FDG的放化纯度>90%,检测方法参照TLC(通则0502)试验。文献中常用TLC、HPLC进行检测[6-10], 本研究拟探讨一种快速准TLC方法用于检测放化纯度, 并对比HPLC、TLC 方法在检测18F-FDG放化纯度的差异。报告如下。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 Eclipse RD 型Cyclotron 回旋加速器(西门子公司);药物生产系统(发明专利申请号:20171068609.4);CRC-15R 型活度计(美国CAPINTEC公司);HPLC(Agilent 1200 , Agilent公司, 配备Binary 双泵, Variable Wavelength检测器, 7725i带传感器进样器), 分离柱为高效糖柱(High Performance Carbohydrate Column, 60 A, 4 μm);PET metabolite Dual BGO型流动放射性活度检测器(Bioscan公司);MiniGita薄层色层(TLC)仪(Raytest 公司)。
1.1.2 试剂 H218O(丰度95%, ABX公司);2-三氟甲基磺酰基-β-D甘露糖(三氟甘露糖, Sigma-Aldrich公司);Kryptofix2.2.2(K2.2.2), 无水乙腈(Sigma-Aldrich公司);硅胶板(Whatman PE Silg/UV, Whatman公司 );QMA 柱、Alumin-N 柱、C-18柱(均为Waters公司);AG50树脂和AG11A8树脂(50-100目, Bio-Rad公司)。HPLC级甲醇、乙醇、乙腈(均为德国Merk公司);层析纸(英国Whatman);硅胶纸(上海造纸研究所)。
1.2 方法
1.2.118F-FDG的合成18F-FDG的制备包括标准的六个步骤。①首先是18F-负离子的产生, 从O-18富氧水开始, 通过p-n核反应产生18F-负离子。②俘获和释放18F-负离子。③通过乙腈和水的共沸原理移除反应体系中的水分形成反应活性18F-负离子。④反应活性放射性18F-负离子和2-三氟甲基磺酰基-β-D甘露糖发生亲核反应, 产生18F-负离子辐射标记的甘露糖三氟磺酸酯。⑤水解移除乙酰基保护基团。⑥纯化产物, 这一步移除各种中间产物并作无菌、无热源等纯化处理。
1.2.218F-FDG产品的TLC分析 按照《中国药典(二部)》2015版方法进行。取Whatman PE Silg/UV硅胶板(200 mm×200 mm)裁成高100 mm、宽10 mm, 并用铅笔在一侧轻轻画上距离底端距离为10 mm 的记号线, 在记号线的中央做标识作为点样标识点;以乙腈-水(95∶5)为展开剂展开, 将晾干后的硅胶G板放置于MiniGita薄层色谱仪中, 将点样标识点所在的刻度线和薄层色谱仪的0刻度线重合。启动MiniGita TLC软件对硅胶G板的放射性分布进行检测, 扫描时间为10 min, 能量范围:450~750 keV;采用GINA软件分析图谱的Rf值和峰面积, 软件自动计算出18F-FDG放化纯度。
1.2.318F-FDG产品的HPLC分析 HPLC选择高效糖柱作为分离柱;流动相为V(乙腈):V(水)=85∶15, 手动调节流动相流速为1.0 ml/min, 分析时间设定为15 min。分析时使用WINFLOW软件, 设置启动方式为“外部手动”;测量样品池体积为30 μl;选择核素能峰为511 keV;开启一个高能放射性测量通道及一个非放射性测量通道, 显示屏会同时出现两个侯命的测量坐标系。进样后扳动进样阀。两个测量系统开始工作, 分别采集经过高效糖柱分离后放射性及非放射性信号, 显示屏上同时观察两个峰谱。
2 结果
2.1 TLC分析18F-FDG产品的放化纯度 TLC的支持体为硅胶G薄层板, 以乙腈-水(95∶5)为展开剂, 展开完毕后用TLC扫描, 测定放射性分布,18F-FDG的Rf=0.435, 符合2015版药典标准0.4~0.6的范围, 测得其放化纯度为99.82%,符合2015版药典规定放化纯度≥90%的标准。见图1。
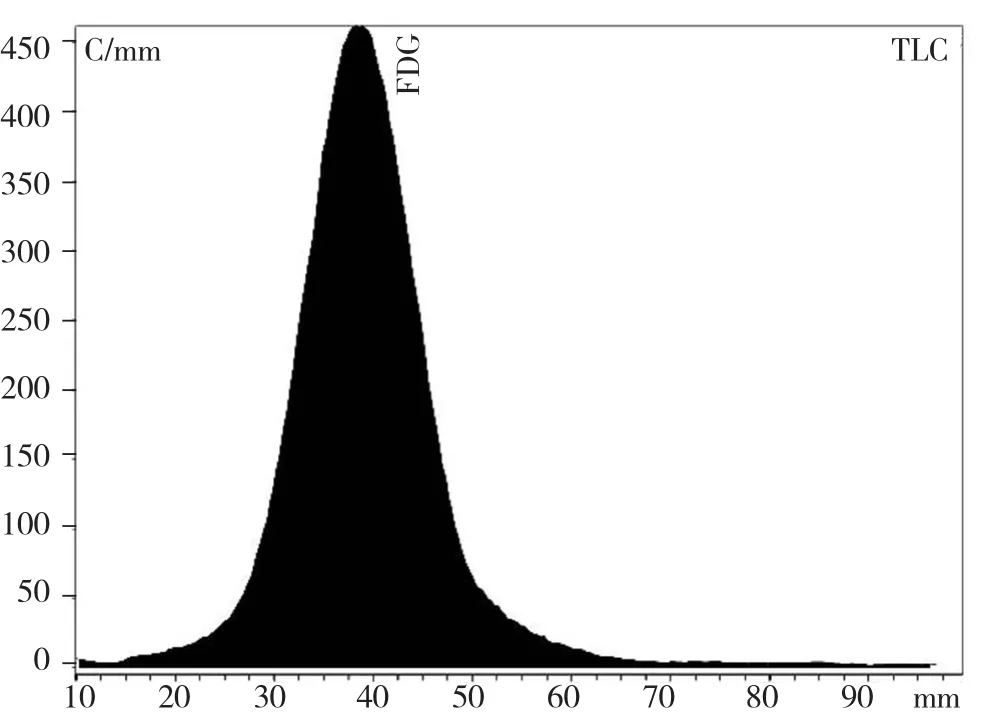
图1 18F-FDG的TLC分析图
2.2 HPLC法测定18F-FDG放化纯度
2.2.1 乙睛浓度和流速对18F与18F-FDG保留时间的影响手动设定流动相流速为1.0 ml/min, 改变流动相的浓度, 对18F与18F-FDG在分离柱的保留时间进行分析, 确定50%和85%的乙腈能有效分离组份。因50%的乙腈浓度在分离柱上的阻力较大, 故选择85%的乙腈作为流动相, 用85%乙腈作流动相时18F-FDG的放化纯度分析时间在15 min左右。通过增加流速进行对比分析, 随着流动相的加快,18F与18F-FDG的保留时间均减少, 均能有效地分离组分。
2.2.2 HPLC对18F-FDG放化纯度的分析 流动相为85%的乙睛, 流速为1 ml/min。tR=6.6 min处有一放射性峰, 为游离的18F。见图2。18F与18F-FDG混合后的HPLC谱上有2个放射性峰, 第1个为游离的18F, tR=6.5 min, 第2个峰为产品18F-FDG, tR=9.2 min。用计算机自动积分计算,18F-FDG的放化纯度>98%,18F放射性峰与单独进样的18F的保留时间微少的区别。见图3。其原因可能是进样样品中不同组份的存在, 影响了化合物在柱子上的分离系数, 从而影响了保留时间。在经过多批次的检测试验表明, 用HPLC方法分析18F-FDG放化纯度批间稳定性良好,18F与18F-FDG的保留时间不变。

图2 18F的HPLC分析图
3 小结
①采用硅胶G薄层板作为TLC的支持体, 以乙腈-水(95∶5)为展开剂, TLC可有效测定18F-FDG的放化纯度。18F-FDG的Rf=0.435, 符合2015版药典标准0.4~0.6的范围,测得其放化纯度为99.82%, 符合2015版药典规定放化纯度≥90%的标准。②采用V(乙腈):V(水)=85∶15作为HPLC流动相, 高效糖柱为分离柱, 流速为1.0 ml/min, HPLC可有效测定18F-FDG放射化学纯度, 测得其放化纯度>98%, 符合2015版药典规定放化纯度≥90%的标准。时间约15 min左右。
总之, TLC和HPLC两种方法都能有效的测定18F-FDG的放化纯度, 而TLC 法方法简便, 适用于常规检验。

图3 18F与18F-FDG的HPLC分析图

