商陆离体再生体系的构建
邓雯韬,田 宇,谢 琴,肖英粟,苏 益,蔺万煌
(湖南农业大学植物激素与生长发育湖南省重点实验室,湖南 长沙 410128)
商陆(PhytolaccaacinosaRoxb) 为商陆科商陆属多年生宿根草本植物,是一种传统的药用植物[1-3],也被用于环境修复[4-7]、病虫害防治[8]和印染业[9]等多个领域。我国野生商陆资源丰富,分布广泛,具有很高的利用和开发价值。商陆具有富集土壤中多种金属离子的作用[10-16],利用商陆矿质营养遗传资源对改善作物营养特性和土壤修复具有重要意义。开展商陆离体再生体系研究,为商陆矿质营养相关基因功能分析及其遗传转化体系的构建奠定基础。
1 材料与方法
1.1 试验材料
商陆种子的采集,于2016年秋季在湖南农业大学校园周边荒地采集成熟的商陆浆果,置于水盆中用纱布将浆果中的种子挤出,弃果皮和上浮的种子,收集下沉饱满的种子于自然条件下风干,存放4 ℃冰箱中保存备用。
1.2 试验方法
1.2.1 离体培养条件
试验以 MS 为基本培养基,根据试验目的分别添加不同浓度的植物生长调节剂组合。培养基中琼脂浓度为0.7%-0.8%,蔗糖浓度为3%,pH为5.8。经121 ℃高压湿热灭菌25 min,培养瓶为100 mL三角玻璃瓶,培养温度为(23±2)℃,光照强度为2 000 Lx,每天光暗周期为14 h/10 h。
1.2.2 外植体的获取
参考吴豪杰等的方法[17],取成熟饱满的商陆种子,用浓硫酸浸泡处理15 min后,以无菌水冲洗4~6次以除去残留的硫酸,再将种子接种于含MS培养基的培养皿中发芽。首先在黑暗条件下培养3 d,种子萌发后再置于光照下培养2~3周,获得六叶期的无菌苗作为商陆离体培养的外植体。
1.2.3 愈伤组织的诱导
分别切取商陆无菌苗的叶片(大小约5 mm×5 mm)、叶柄(长约3~5 mm)、幼茎(长约3~5 mm)、茎节(带腋芽的茎段,长约3~5 mm)和顶芽(长约5~8 mm),接种到含有不同浓度组合的植物生长调节剂的MS培养基中(表1)进行愈伤组织诱导培养。观测20 d后愈伤组织生长情况,统计出愈率。
出愈率(%)=长出愈伤组织的个数/接种外植体总数×100%

表1 愈伤组织诱导培养基中植物生长调节剂组成Tab.1 The composition of plant growth regulators in callus induction medium
1.2.4 丛生芽的诱导
分别挑选以幼茎、茎节、叶片、叶柄和顶芽为外植体诱导出来且生长状况良好的愈伤组织,接种于芽分化培养基中(如表 2)。观测20 d后丛生芽的生长情况,统计能诱导丛生芽的愈伤组织个数。
丛生芽诱导率(%)=芽分化的外植体个数/接种愈伤组织总数×100%
1.2.5 生根诱导
当丛生芽长至1.5 cm以上时,切下不定芽,分别接种于表3 所示的培养基中进行生根诱导,观测15 d后试管苗的不定根生长情况,统计生根率。
生根率(%)=生根的试管苗个数/接种的不定芽总数×100%
2 结果与分析
2.1 商陆外植体的选择和愈伤组织的诱导
选取不同的外植体分别接种于愈伤组织诱导培养基中(见表1)。在培养5 d后可观察到叶柄、幼茎、茎节和顶芽的切口处有愈伤组织长出,培养8 d后在叶片切口边缘有愈伤组织长出。愈伤组织生长状况表明,商陆外植体以幼茎和顶芽出愈时间早,愈伤组织生长良好,而茎节和叶柄诱导的愈伤组织容易褐化变质,以叶片诱导愈伤组织则出愈时间较迟,愈伤组织生长缓慢。
观测统计培养20 d的愈伤组织生长情况,如表4所示。试验结果表明,在植物生长调节剂一定浓度范围内,在同一培养基中诱导的幼茎和顶芽的愈伤组织生长基本一致,愈伤组织生长质量较好,并以培养基②和③的出愈率最高,达到100%。培养基⑤和⑦产生的愈伤组织质地较硬,颜色为绿色。综合考虑出愈时间、出愈率、愈伤组织生长质量和植物生长调节剂用量,笔者认为培养基③,即MS+6-BA 0.5 mg/L+2.4-D 0.5 mg/L为本试验中诱导愈伤组织最适宜培养基。
2.2 不同植物生长调节剂组合对丛生芽诱导的影响
将各外植体诱导出的愈伤组织接种于不同的芽分化培养基中,观察在不同植物生长调节剂浓度组合培养基中芽分化情况。如图1所示,在本试验所用各种培养基方案中,以幼茎、茎节、叶片和叶柄为外植体诱导的愈伤组织均无不定芽的产生,尽管幼茎和叶片诱导的愈伤组织生长良好,但仍未观察到丛生芽的产生。只有以顶芽诱导的愈伤组织才出现芽的分化(图1a),并以培养基⑩(MS+6-BA 2.0 mg/L+NAA 0.25 mg/L)中最易分化出丛生芽,出芽率高达98%。进一步试验观察发现,在以顶芽诱导的愈伤组织生长过程中,原外植体顶芽也会继续生长。只有带顶芽的愈伤组织转接到芽分化培养基后才有丛生芽的分化,而不带顶芽的愈伤组织未发现有芽的分化,即使该愈伤组织由顶芽诱导产生。
2.3 不同植物生长调节剂对试管苗生根的影响
待丛生芽生长至1.5 cm高以上时,从芽基部切下,接种于到生根培养基中进行生根诱导。 结果如表5所示,应用NAA或IBA分别添加到MS、1/2 MS基本培养基中,都能诱导试管苗生根。除培养基生根率较低外,其他各处理的生根率均达到70%以上,且以培养基、和的生根率最高,达到100%。在NAA 0.3~0.8 mg/L浓度范围内诱导的根生长健壮,气生根较少,当NAA浓度为1.5 mg/L时,可在培养基表面生长较多的气生根,且诱导生根时间提前。在相同的浓度条件下,与IBA相比,NAA诱导产生的根更健壮,IBA诱导产生的气生根多且根生长缓慢。综合分析表明,以培养基(1/2 MS+NAA 0.3 mg/L)对商陆试管苗生根较为适宜,其试管苗生根情况如图2。
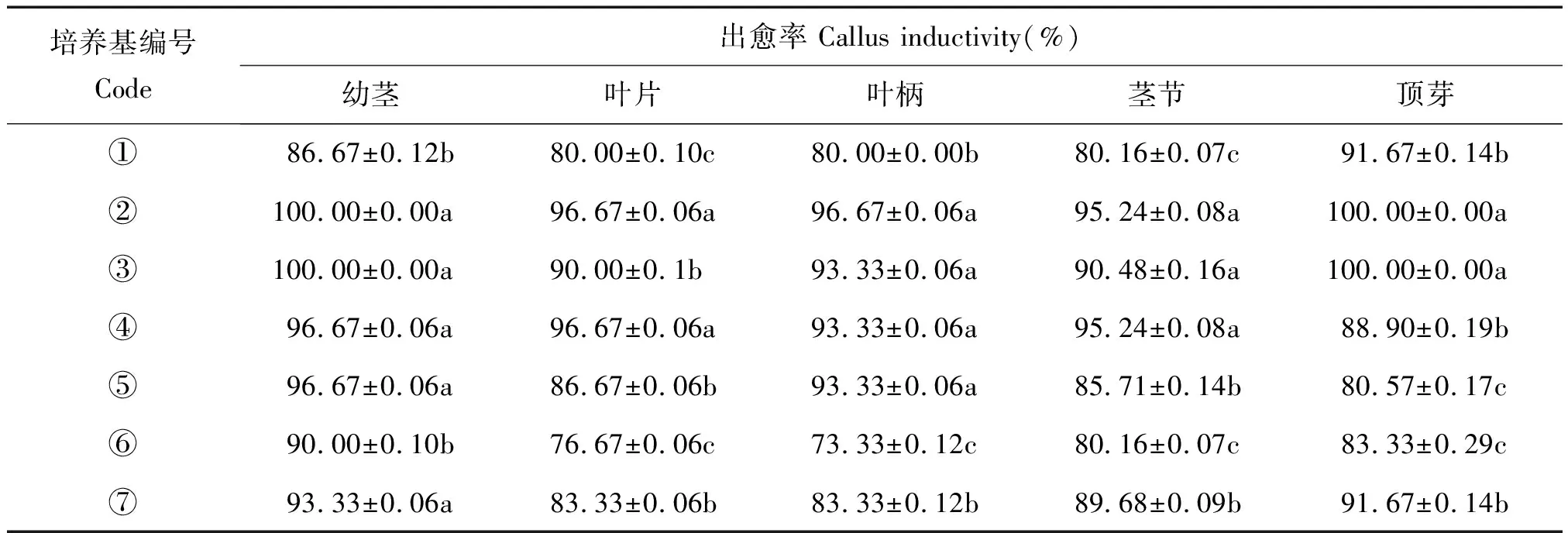
表4 不同植物生长调节剂浓度组合对愈伤组织诱导的影响Tab.4 Effects of different plant growth regulators ratios on callus induction
注:培养基编号①~⑦参见表1;小写字母表示α= 0.05水平不同基本培养基处理间差异性显著。

图1 丛生芽的分化Fig.1 Differentiation of cluster buds a.顶芽诱导的愈伤组织分化出丛生芽;b.幼茎诱导的愈伤组织;c.茎节诱导的愈伤组织;d.叶片诱导的愈伤组织;e.叶柄诱导的愈伤组织a.Cluster buds induced from apical buds callus;b.Callus from young stem;c.Callus from stem node;d.Callus from lamina;e.Callus from petiole
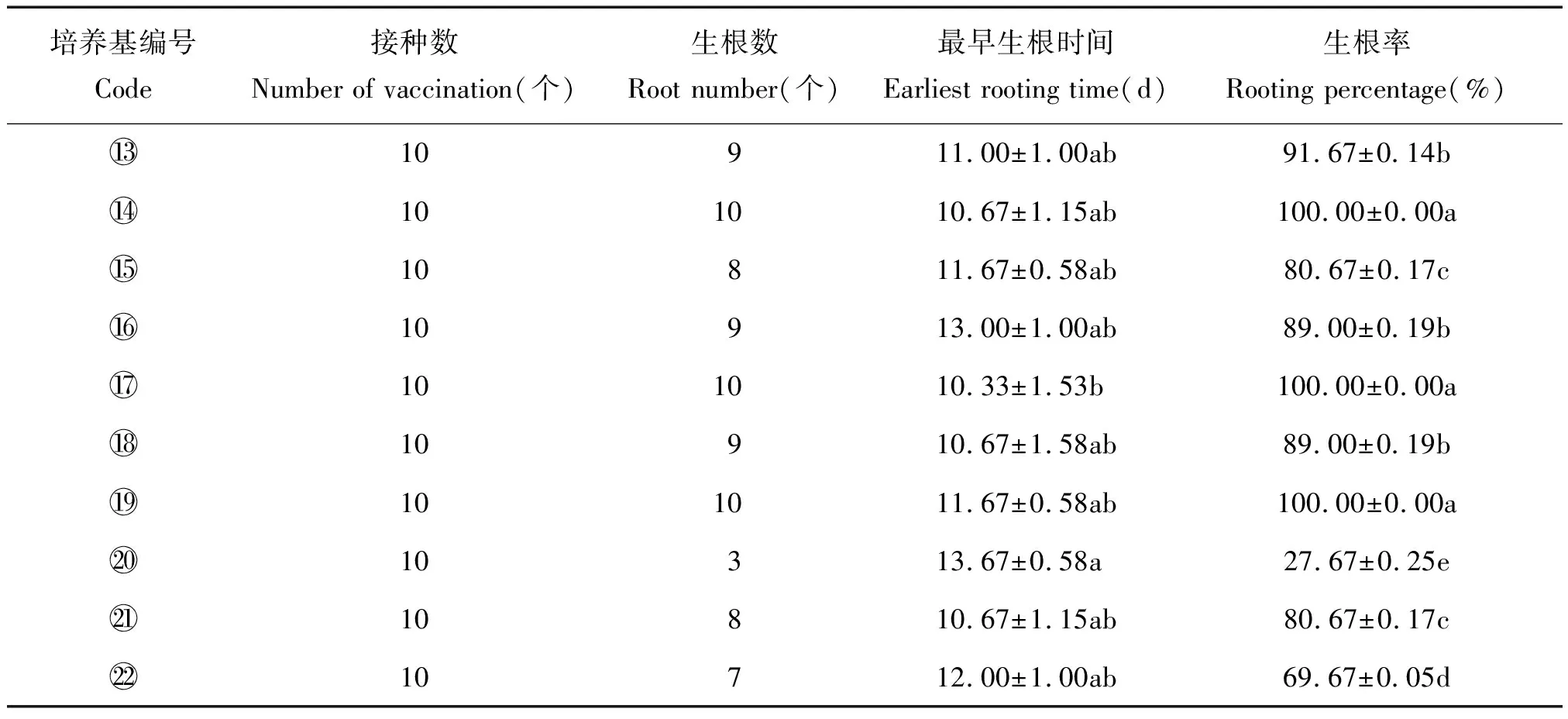
表5 不同植物生长调节剂配比对诱导生根的影响Tab.5 Effects of different plant growth regulators ratios on induced rooting
注:培养基编号~参见表3;小写字母表示α=0.05水平不同基本培养基处理间差异性显著。

图2 商陆试管苗生根诱导Fig.2 Plantlets rooting induction of Phytolacca acinosa Roxba.培养基诱导生根的正面培养照片;b.表示培养基诱导生根的底部照片a.A positive photo of rooting induction in medium No.17; b.A bottom photo of rooting induction in medium No.17
3 讨论
本试验进行了商陆外植体的筛选、愈伤组织诱导、丛生芽分化和生根诱导等。试验结果表明,以顶芽和幼茎作为外植体诱导产生愈伤组织质量最佳,其出愈时间早,诱导愈伤组织的适宜培养基为MS+6-BA 0.5 mg/L+2.4-D 0.5 mg/L,诱导率达到100%;丛生芽只能从以顶芽产生的愈伤组织中分化出来,丛生芽分化培养基为 MS+6-BA 2.0 mg/L+NAA 0.25 mg/L,诱导率达98%;生根培养基以1/2 MS+NAA 0.3 mg/L为宜,诱导率是100%。
本试验在诱导愈伤组织的培养基中添加6-BA和2.4-D,在适宜的浓度范围内可以诱导产生良好的愈伤组织,而2.4-D与KT、6-BA组合也能诱导愈伤组织,与吴豪杰等人[17]所用6-BA 2.0 mg/L+IBA0.4 mg/L不同,而高利臣等[18]主要以6-BA、GA3和 LH的组合以及6-BA、IBA和 LH的组合,张丽珍等[19]得出的最佳叶片诱导愈伤组织培养基是IBA2 mg/L+2,4-D 3 mg/L,邹利娟等[20]诱导愈伤组织培养基为MS+NAA 0.2 mg/L+6-BA 1.0 mg/L;丛生芽的分化与高利臣等[21]选用的外植体茎尖有相似之处,但适宜芽分化培养基存在差异。
在研究中我们还发现,诱导愈伤组织分化时,培养温度不宜高于25 ℃,或低于20 ℃。温度过高诱导出来的愈伤组织容易玻璃化,温度过低出愈时间推迟。此外,由于商陆外植体本身含有较多的酚类物质,在愈伤组织诱导过程中易发生褐化现象,特别是幼茎、茎节和叶柄作为外植体时更易产生褐化现象,所以在接入到芽分化培养基时需要将褐化部分切除。
此外,幼茎、叶柄均可诱导出生长状况良好的愈伤组织,但是笔者在本试验中发现只有顶芽诱导的愈伤组织才能有丛生芽的分化,推测可能是顶芽产生了特定的植物激素促进了愈伤组织丛生芽的分化,这一推测有待进一步验证。

