基因芯片技术检测临床常见致病性念珠菌和新型隐球菌及ERG11基因点突变的实验分析
王敬华, 虞培娟, 葛 平, 章强强, 肖艳群, 王庆忠, 徐 蓉, 陈 蓉,刘学杰, 蒋玲丽, 王雪亮, 王华梁
(1.上海市临床检验中心,上海 200126;2.苏州大学附属第二医院检验科, 江苏 苏州 215004;3. 复旦大学附属华山医院皮肤科,上海 200040)
近年来,随着社会人口老龄化进程的加快,各种原因导致的免疫力低下患者数量不断增加,深部真菌感染特别是深部丝状真菌感染的发病率正逐年增加,在某些特定人群中其发病率甚至高于酵母[1-2]。临床实践表明,不同真菌对抗真菌药物的敏感性存在较大差异[3],甚至部分真菌对常用抗真菌药物天然耐药或不敏感,致使真菌引起的深部感染死亡率很高[4]。临床实验室现行真菌检测方法相对滞后,急需一种能够快速诊断病原性真菌感染的检测方法[5-7]。目前,基因芯片技术已被成功应用于细菌和病毒等病原微生物的核酸突变检测及基因组多态性分析[8-11]。本研究尝试将基因芯片技术用于病原性真菌的快速鉴定和耐药性检测。
1 材料和方法
1.1 材料
1.1.1 菌株 (1)标准菌株:白念珠菌[CMCCC(F)Cla]、热带念珠菌[CMCCC(F)C2a]、克柔念珠菌[CMCCC(F)C6a]、近平滑念珠菌[CMCCC(F)C4a]、光滑念珠菌[CMCCC(F)Y10]、新型隐球菌[CMCCC(F)D2q]购于中国微生物菌种保藏管理委员会医学真菌中心;白念珠菌标准菌株(ATCC 90028)由上海交通大学医学院附属瑞金医院项明洁教授惠赠。(2)临床菌株:收集2013年8—2014年3月临床实验室分离的念珠菌和新型隐球菌共205株,其中上海长征医院临床微生物室120株、复旦大学附属中山医院微生物科26株、复旦大学附属华山医院皮肤科36株、苏州大学附属第二医院微生物室23株,包括白念珠菌126株、热带念珠菌26株、光滑念珠菌10株、克柔念珠菌16株、近平滑念珠菌22株,新型隐球菌5株。
1.1.2 主要仪器和试剂 (1)主要仪器:本研究应用上海交通大学系统生物医学研究院仪器共享服务平台,主要仪器包括SmartArrayer 48 微阵列芯片点样系统(北京博奥晶典生物技术有限公司)、GenePix 4000B激光共聚焦生物芯片扫描仪(美国Axon Instrument公司)。(2)主要试剂:真菌基因组DNA提取、纯化试剂盒购于北京索莱宝科技有限公司,TaKaRa Taq(Code No.R001A)、dNTPmix和10×buffer、DL2000 DNA Marker(Code No.3427A)、6×loading buffer、TaKaRa pMD 18-T Vector Cloning Kit购于大连宝生物工程有限公司,醛基化玻璃芯片购于上海艮驰生物科技有限公司。实验中所用引物和探针分别由生工生物工程(上海)股份有限公司和上海基康生物技术有限公司合成, 其中反向引物的5' 端以3-NHS-磺基花青酯为荧光标记物,而探针合成后在其3' 端进行氨基化修饰。
1.2 菌株准备和药物敏感性试验
1.2.1 菌株准备 试验前所有菌株被接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,35 ℃培养18~24 h,收集菌落备用。同时,选用上海博赛科技有限公司CROMagar念珠菌显色板和法国生物梅里埃公司Vitek 2 Compact自动化微生物鉴定仪及其配套的鉴定卡对临床分离菌株重新鉴定。
1.2.2 体外药物敏感性试验 采用微量稀释法,参照美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)M27-A3文件[12]进行126株临床分离致病性念珠菌的体外药物敏感性试验,以白念珠菌(ATCC 90028)为质控菌株,用无菌蒸馏水将氟康唑原粉(美国辉瑞制药有限公司,批号UK-49858)溶解成2 000 μg/mL储存液,储存液用RPMI-1640液体培养基做倍比稀释,加入96孔微量板(100 μL/孔)中,调节药物含量为0.25~128 μg/mL,35 ℃培养48 h,用肉眼观察法阅读结果。最低抑菌浓度(minimum inhibitory concentration,MIC)解释标准:≤2 μg/mL为敏感,4 μg/mL为剂量依赖性敏感, ≥8 μg/mL为耐药。只有当生长对照菌株生长良好,且质控菌株的MIC在CLSI M27-A3方案制定的范围内,才可判定氟康唑对白念珠菌的MIC。
1.3 基因芯片制备
1.3.1 探针设计 在内转录间区2 (internal transcribed spacer-2,ITS-2)通用引物及ERG11基因特异性引物扩增区找出适合作为探针的所有序列,将候选序列递交到GenBank进行Blast比较,筛选出Tm值最接近、特异性最好的一段寡核苷酸进行探针合成[10]。共设计3类探针,第1类为真菌共有探针,能够与所有真菌杂交;第2类是致病真菌种特异性探针,其作用是将致病真菌鉴定到种;第3类为阳性对照探针。本研究所用探针序列见表1。本研究共设计18种真菌特异性探针,本文仅报道其中6种真菌的研究结果,其他探针将根据具体研究内容另文报道。
1.3.2 点样 配置终浓度为50 μmol/L的探针溶液,每个探针溶液取5 μL,分别溶于5 μL 6×柠檬酸钠(saline sodium citrate,SSC)中,然后依次转移到一块崭新的384孔板中,用Smart Arrayer 48微阵列芯片点样系统点样至醛基化载玻片上,点心间距为500 μm。点样时保持湿度90%,温度23 ℃。点样后的芯片在使用前于室温放置至少24 h。应用自动点样仪制备多张用于常见致病真菌检测的基因芯片。每张芯片含有l6个相同的阵列,每个阵列为9×9个探针点。各种探针在芯片上的对应位置见表2。

表1 本研究所用的探针序列
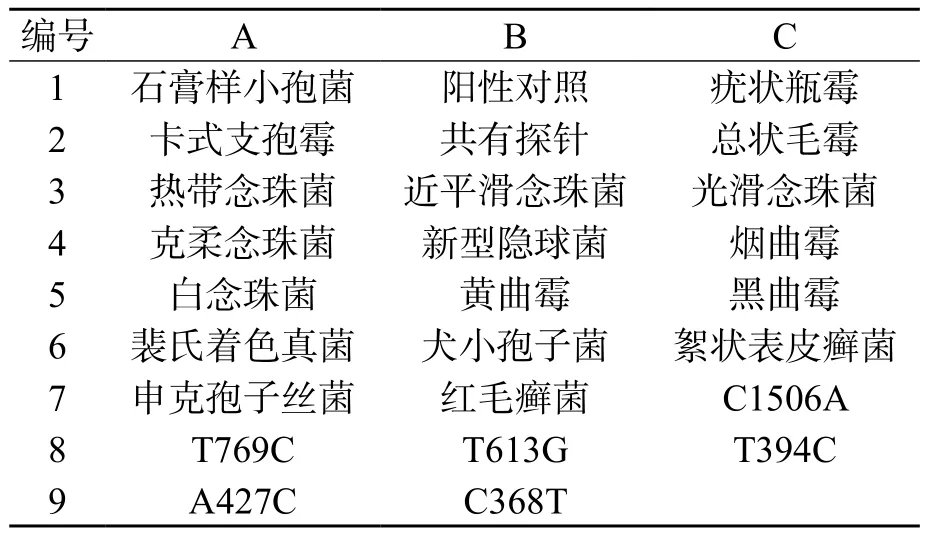
表2 寡核苷酸探针在芯片上的对应位置
1.3.3 化学封闭 封闭芯片上未与寡核苷酸结合的醛基[10]:用0.2%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(25 ℃)洗涤5 min;纯水(25 ℃)洗涤5 min;纯水(95 ℃)洗涤2 min;迅速将玻片放入封闭液(1.3 g NaHB4溶于375 mL磷酸盐缓冲液中,再加入125 mL无水乙醇)洗涤5 min;0.2%SDS(25 ℃) 洗涤1 min;纯水(25 ℃)洗涤1 min。
1.4 聚合酶链反应(polymerase chain reaction,PCR)扩增真菌ITS-2、ERG11基因
1.4.1 真菌基因组DNA模板制备 将试验菌株接种于PDA培养基上培养18~24 h,收集菌落至灭菌去离子水。采用真菌基因组DNA提取、纯化试剂盒提取真菌基因组DNA,按照操作说明书进行操作。
1.4.2 引物合成 合成真菌rDNA ITS-2扩增通用引物,针对已被证实存在于白念珠菌ERG11基因中、可导致菌株对氟康唑耐药的6种常见点突变(C368T、T394C、A427C、T613G、T769C、C1506A),分别设计能够识别耐药株所含突变点的特异性引物,要求每对引物仅可以扩增含有其对应突变点的耐药菌(突变株)相应序列,而敏感株(野生型)因不含有该突变点而不会被扩增,并控制扩增序列的长度约为250 bp(表3),使每对引物扩增出相对独立的一段序列,在该段序列的互补链上,筛选出Tm值最接近、特异性最好的一段寡核苷酸进行探针合成(表1)。同时,设计不含针对突变点的普通引物作为实验对照。针对6种突变序列,人工合成6条5' 端以Cy3标记、约50 bp的互补的寡核苷酸链作为阳性对照。
1.4.3 PCR扩增真菌ITS-2、ERG11基因 PCR扩增真菌ITS-2、ERG11基因按照参考文献[13]进行操作。
1.4.4 ERG11基因的克隆、测序 设计2对引物,即ERG11-1和ERG11-2,分别扩增耐药株ERG11基因728和815 bp片段[14]。按照试剂盒说明书,将PCR产物与pMD18-T载体连接,构建pMD18-T-ERG11质粒,转入感受态细菌构建克隆,每个菌株挑取10个克隆,委托生工生物工程(上海)股份有限公司进行测序。
1.5 基因芯片杂交
1.5.1 芯片杂交 分别取扩增产物2和8 μL与杂交液(美国Unihyb Telechem公司)混合,加热到98 ℃变性5 min,然后置于冰上,5 min后取出,将混合液转移至芯片杂交区域。将芯片置于杂交盒中55 ℃保温1 h。杂交后的芯片依次在洗液A(1×SSC,0.2%SDS)、洗液B(0.2×SSC)、洗液C(0.1×SSC)中各洗1 min。1.5.2 杂交结果的检测与分析 芯片用GenePix 4000激光共聚焦生物芯片扫描仪以激发波长540 nm、发射波长570 nm扫描,产生精度为10 μm l6位Tiff图像。应用GenePixPro软件对结果进行分析。

表3 本研究所用的引物序列
2 结果
2.1 临床分离菌株的鉴定及药物敏感性试验
采用CRO Magar念珠菌显色板和Vitek 2 Compact自动化微生物鉴定仪重新鉴定205株临床分离菌株,其中白念珠菌126株、热带念珠菌26株、光滑念珠菌10株、克柔念珠菌16株、近平滑念珠菌22株、新型隐球菌5株;采用微量稀释法,184株念珠菌中检出耐药株17株,包括白念珠菌12株(含实验室前期保存的耐药菌株6株)、热带念珠菌2株、近平滑念珠菌2株、光滑念珠菌1株。本研究未检测克柔念珠菌(天然耐药)和新型隐球菌对氟康唑的耐药性,白念珠菌、热带念珠菌、近平滑念珠菌、光滑念珠菌对氟康唑的耐药率分别为5.0%(6/120)、7.7%(2/26)、9.1%(2/22)和10.0%(1/10)。
2.2 PCR扩增真菌ITS-2、ERG11基因
采用真菌rDNA ITS-2基因扩增通用引物,PCR扩增白念珠菌、热带念珠菌、光滑念珠菌、近平滑念珠菌、克柔念珠菌及新型隐球菌ITS-2,见图1。采用ERG11-1和ERG11-2 2对引物,成功扩增ERG11基因的2个片段(728和815 bp),见图2。
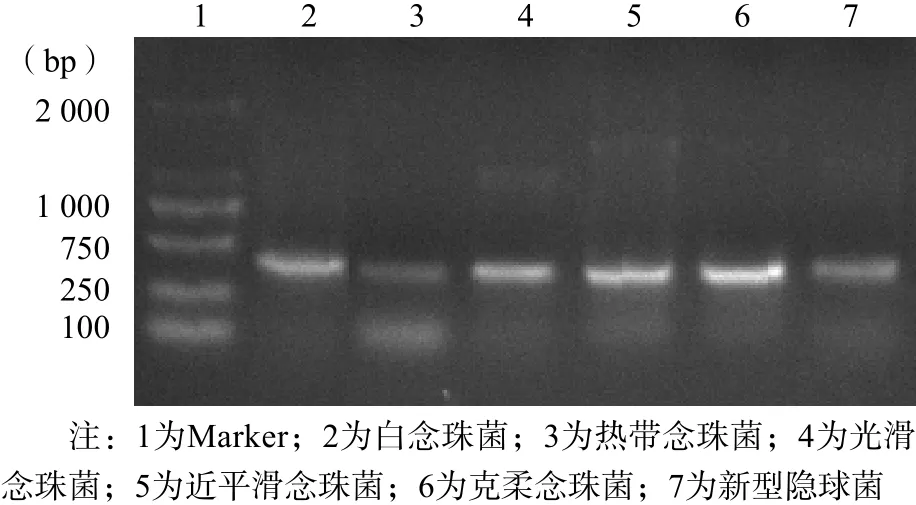
图1 PCR扩增真菌ITS-2
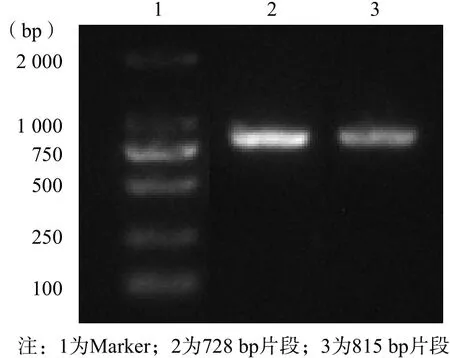
图2 PCR扩增ERG11基因
2.3 不对称荧光PCR扩增真菌ITS-2基因
以普通PCR为对照,采用不对称荧光PCR,扩增真菌ITS-2基因[13]。限制性引物(P1)按照1∶30、1∶40、……1∶90稀释,分别与荧光标记引物(P2)配对,构建不对称荧光PCR,扩增ITS-2基因单链DNA。随着限制性引物(P1)浓度逐渐降低,ITS-2基因双链DNA的合成逐渐减少,而单链DNA合成逐渐增加。见图3。
图3 不对称荧光PCR扩增真菌ITS-2基因
2.4 PCR扩增ERG11点突变
采用本研究设计的6对能够识别ERG11耐药点突变的特异性引物,分别扩增野生菌株、耐药菌株,并以普通引物为对照。本研究从12株耐药白念珠菌株中成功扩增出4个含有点突变的序列,且4对引物(C368T、T394C、T613G、T769C)仅扩增含有其对应突变点的耐药菌相应序列,野生株未被扩增,用不针对相应突变点的普通引物,可以成功扩增出敏感株(野生株)的相应PCR片段。见图4。
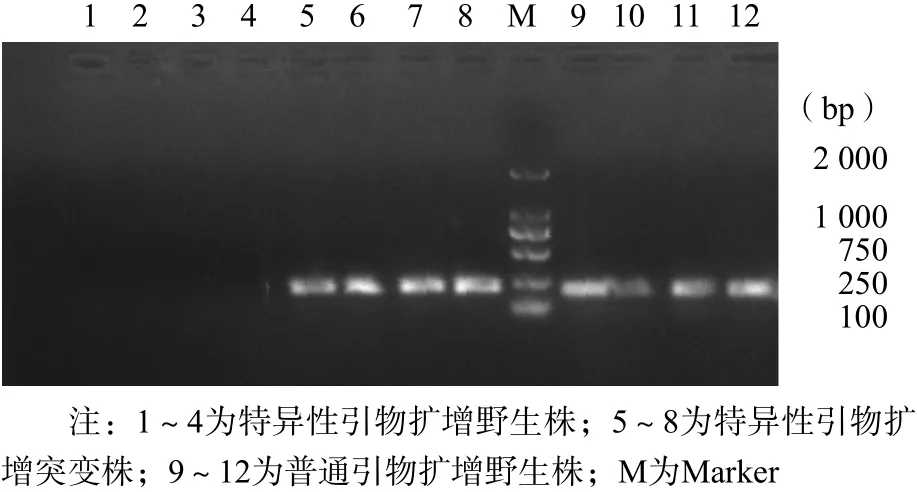
图4 PCR扩增ERG11点突变
2.5 ERG11点突变测序结果
将PCR扩增产物送生工生物工程(上海)股份有限公司进行测序,在12株白念珠菌耐药菌株中共发现4个突变点,即C368T、T394C、T613G、T769C。见图5。
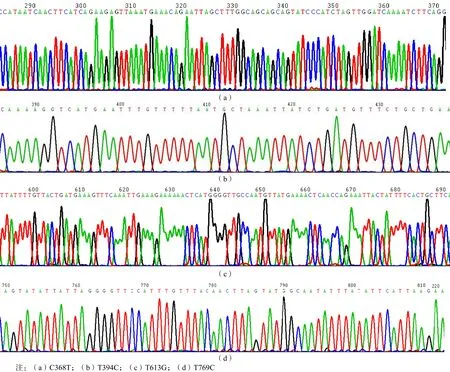
图5 ERG11点突变测序结果
2.6 5种念珠菌和新型隐球菌芯片杂交
将5种念珠菌和新型隐球菌ITS-2基因不对称荧光PCR扩增产物与基因芯片上的特异性探针进行杂交,本研究制备的基因芯片,能够成功鉴定出临床分离到的5种念珠菌和新型隐球菌。见图6。

图6 5种念珠菌和新型隐球菌芯片杂交结果
2.7 基因芯片技术检测白念珠菌ERG11基因点突变
基因芯片技术检测标准菌株白念珠菌(ATCC 90028)、临床分离耐药菌株(zs113、cz10、cz143、fey41、hs60、hs74、cz159)ERG11基因点突变,结果见图7。其中,标准菌株白念珠菌(ATCC 90028)未检出任何点突变,在编号为zs113、cz10、cz143、fey41、hs60、hs74、cz159的真菌临床分离菌株依次检出C368T、T769C、T613G、T394C、T394C/C368T、T394C/C368T、C368T/T613G点突变。

图7 基因芯片技术检测白念珠菌ERG11基因点突变
3 讨论
本研究收集临床分离的真菌共205株,其中念珠菌200株、新型隐球菌5株。经CROMagar念珠菌显色平板和Vitek 2 Compact自动化微生物鉴定仪重新鉴定,其中白念珠菌126株、热带念珠菌26株、近平滑念珠菌22株、光滑念珠菌10株、克柔念珠菌16株。采用微量稀释法检测念珠菌对氟康唑的药物敏感性,除克柔念珠菌对氟康唑天然耐药外,白念珠菌、热带念珠菌、近平滑念珠菌、光滑念珠菌对氟康唑的耐药率分别为5.0%(6/120)、7.7%(2/26)、9.1%(2/22)和10.0%(1/10)。其中,热带念珠菌、近平滑念珠菌、光滑念珠菌耐药株检出率略高于文献[15],可能与本次药物敏感性试验菌株数较少有关。
采用常规PCR成功扩增出6种临床分离真菌ITS-2;将限制性引物(正向引物P1)按照1∶80~1∶90稀释后,与3-NHS-磺基花青酯标记的反向引物P2组成不对称荧光PCR,可以成功扩增出ITS-2单链DNA;采用2对引物,成功扩增ERG11基因728 和815 bp 2个片段, 经构建pMD18-T-ERG11质粒测序,在12株耐氟康唑的白念珠菌中共发现4种突变点(C368T、T394C、T613G、T769C)。
采用序列特异的寡核苷酸(氨基化探针)点样于醛化玻璃芯片上,制备寡核苷酸芯片,与不对称荧光PCR扩增的205株临床分离菌株ITS-2基因单链DNA杂交,5种临床常见致病性念珠菌和新型隐球菌均能被准确鉴定,说明该试验方法具有很好的特异性。
本研究通过改变局部碱基(突变点局部1~2个碱基错配),设计能够识别ERG11基因特定点突变的特异性探针,可以特异性地扩增出携带该突变点的突变株(耐药株)约250 bp的ERG11片段,而野生株(敏感株)ERG11基因则完全未被扩增,采用正常引物(碱基完全匹配引物)则可扩增出野生株ERG11基因的此段正常序列,提示该引物具有很好的识别相应点突变的特异性,其不对称荧光PCR产物能够与点样于芯片的互补寡核苷酸序列(探针)杂交,从而被GenePix4000激光共聚焦生物芯片扫描仪识别,呈现杂交阳性结果。
应用GenePixPro软件,对GenePix4000激光共聚焦生物芯片扫描仪保存并生成的Tiff格式的图像文件进行分析,发现在采用基因芯片技术鉴定临床分离菌株和检测ERG11点突变时,二者的背景荧光强度与每个像素点的荧光强度信噪比存在较大差异,前者的信噪比<10%,而后者的信噪比均值为21.5%,具体原因不详。基因芯片技术用于临床常见病原性真菌鉴定,方法比较成熟,鉴定结果可靠。通过与PCR结果的比较,基因芯片技术可以用于ERG11点突变检测,结果可靠,但试验条件尚有待于进一步优化,以降低其信噪比。

