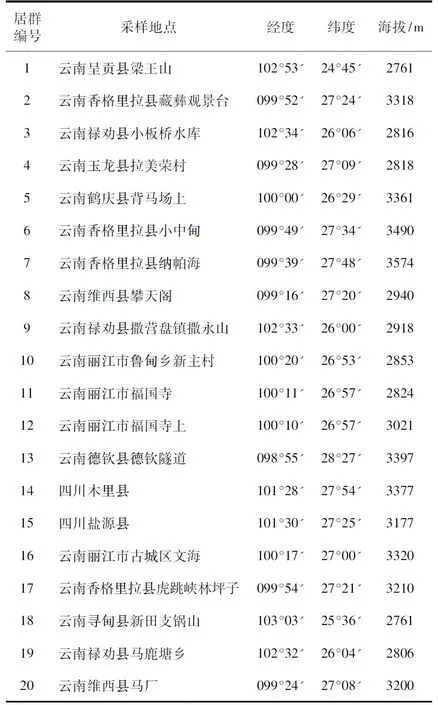
高海拔地区珠子参居群叶片抗氧化酶活性和丙二醛含量的变化△
左应梅,许宗亮,杨维泽,杨绍兵,杨天梅,杨美权,张金渝
(云南省农业科学院 药用植物研究所,云南 昆明 650200)
珠子参PanaxjaponicusC.A.Meyer varmajor(Burk.)C.Y.Wu et K.M.Feng)又名扣子七,属五加科人参属植物,其根茎为药材珠子参,具有活血散瘀,补血止血,消肿止痛等类似三七的功效。珠子参主要分布在陕西、四川、云南、湖北、甘肃、贵州、西藏等地,是秦巴山区特色中药材“太白七药”之一,现代药理实验证明其具有提高免疫功能、增强造血功能、抗肿瘤、抗心律不齐及抗炎等作用[1]。目前,珠子参的研究主要集中在资源分布、化学成分、药理作用、临床应用及分子生物信息学等方面[2-7]。有关生理生态特性方面的研究较少,左应梅等研究表明,相同栽培条件下珠子参不同居群的光合特性、保护酶活性、丙二醛含量(MDA)和叶绿素含量存在一定差异[8];黄文静等研究表明,三年生珠子参地上部分生长旺盛,叶绿素含量和保护酶活性较高,对光能的捕获、有机物的同化、以及对环境的适应能力高于二年生和苗期珠子参[9];30%遮阴处理下珠子参株高、主茎粗、果实数、根茎直径、叶绿素含量、SOD和POD活性增加,地下根茎节间长度和叶片MDA含量减小[10]。而珠子参对海拔高低的生理响应和自身抗氧化适应方面的研究鲜见报道。
本研究拟通过测定20个居群珠子参的过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量,探讨各类居群的CAT、POD和SOD活性和MDA含量随海拔梯度的变化规律,探明珠子参不同类群的抗氧化能力对海拔的响应特性,为珠子参的野生驯化、优良品种的选育及栽培的生态适应性提供理论基础。
1 材料和方法
1.1 材料
本研究材料共20个居群珠子参,其采集地点及地理位置见表1。采样时间为2016年7月~8月。每个采样点采取具有代表性的10个植株,所采植株大小基本一致,地下根茎个数为5~6个的代表性正常成熟植株。将叶片装于自封袋,密封后迅速放入-80 ℃液氮保存。
1.2 方法
1.2.1 保护酶活性测定
酶液提取参照高俊凤的方法[11],略有改进,即称取新鲜珠子参叶片约0.5 g于预冷的研钵中,加适量预冷的0.05 mol·L-1(pH 7.8)磷酸缓冲液、少量石英砂和聚乙烯吡咯烷酮于冰浴上研磨成浆,转移到刻度离心管,用磷酸缓冲液冲洗研钵2~3次,使终体积为8 mL。将提取液在4 ℃下12 000 r·min-1离心15 min,上清液用于CAT、POD、SOD活性测定及MDA含量测定。
SOD总活性采用NBT(淡蓝四唑)光还原法测定,以抑制NBT光还原反应50%所需的酶量为一个酶活性单位(U),活性以U·g-1FW表示;POD活性采用愈刨木酚显色法测定,以每分钟OD470变化0.01为一个过氧化物酶活性单位(U),活性以U·g-1FW·min-1;CAT活性采用紫外吸收法测定以1 min内OD240降低0.01为一个酶活性单位(U),活性以U·g-1FW·min-1表示[11]。
1.2.2 丙二醛含量性测定
MDA含量测定参照Zhang和Kirkham[12]的方法。取上述酶提取液1.5 mL,加入2.5 mL0.5%的硫代巴比妥酸(用5%三氯乙酸配制),沸水中加热20 min,冰浴速冷,离心,取上清液于分光光度计上分别测定450、532和600 nm处的吸光值,计算MDA含量,含量以nmol·g-1FW表示。
1.3 数据统计分析
采用Microsoft Excel 2007软件对数据进行处理和绘图,采用JMP7统计分析软件对数据进行差异显著性检验(Tukey法)。
2 结果与分析
2.1 不同居群保护酶活性和丙二醛含量比较
由表2可知,CAT活性最大的是居群1,最小的是居群8。居群1的CAT活性显著大于居群2、5、6、8、9、10、11、12、14、15、16、17;居群3、4、7、13、18、19和20(前)之间的CAT活性差异不显著,居群5、6、8、9、10、11、14、15、16和17(后)之间的CAT活性差异不显著,但前面一组的CAT活性显著大于后面一组。POD活性最大的是居群1,最小的是居群6。居群1的POD活性除了与居群8、12间的差异不显著,与其余居群间的差异均达显著水平;居群2、3、13、14、15、16、17、19(前)间的POD活性差异不显著,居群4、5、6、7、9、10、11、18、20(后)间的POD活性差异不显著,其中前一组居群的POD活性显著大于后一组的居群6、7和9。SOD活性最大的是居群13,最小的是居群17。居群13的SOD活性显著大于居群9和17,与其余居群间的差异均不显著。MDA的含量最大的是居群15,最小的是居群4。居群15的MDA含量显著大于居群4和7,与其余居群间的差异均不显著。由此可见,20个居群珠子参的保护酶活性和丙二醛含量存在一定差异,可能与其生长的海拔高度等因素有关。

注:采用JMP7统计分析软件对数据进行差异显著性检验(Tukey法),同行数据后不同字母表示差异具有统计学意义,P<0.05。
2.2 聚类分析
从以上分析可知,20个居群珠子参的保护酶活性和丙二醛含量存在一定差异。我们根据CAT、POD、SOD活性和MDA含量对20个珠子参居群进行聚类分析(Ward法),当距离为1.64时分为3类(图1)。第Ⅰ类包括1、3、9、18、4和7,共计6个居群;第Ⅱ类包括2、5、10、19、20和14,共计6个居群;第Ⅲ类包括6、12、13、11、16、17、8和15,共计8个居群。
2.3 各类居群的保护酶活性和丙二醛含量
为了比较各类居群的保护酶活性和丙二醛含量的差异,对CAT、POD、SOD活性和MDA含量的均值分别进行差异显著性检验。由表3可知,POD和SOD活性在各类居群间的差异不显著;第Ⅰ类居群的CAT活性分别是第Ⅱ、Ⅲ类居群的1.45倍和1.74倍,其中第Ⅰ类的显著大于第Ⅲ类的;第Ⅲ类居群的MDA含量分别是第Ⅰ、Ⅱ类的2.28倍和1.52倍,三者间的差异达显著水平。
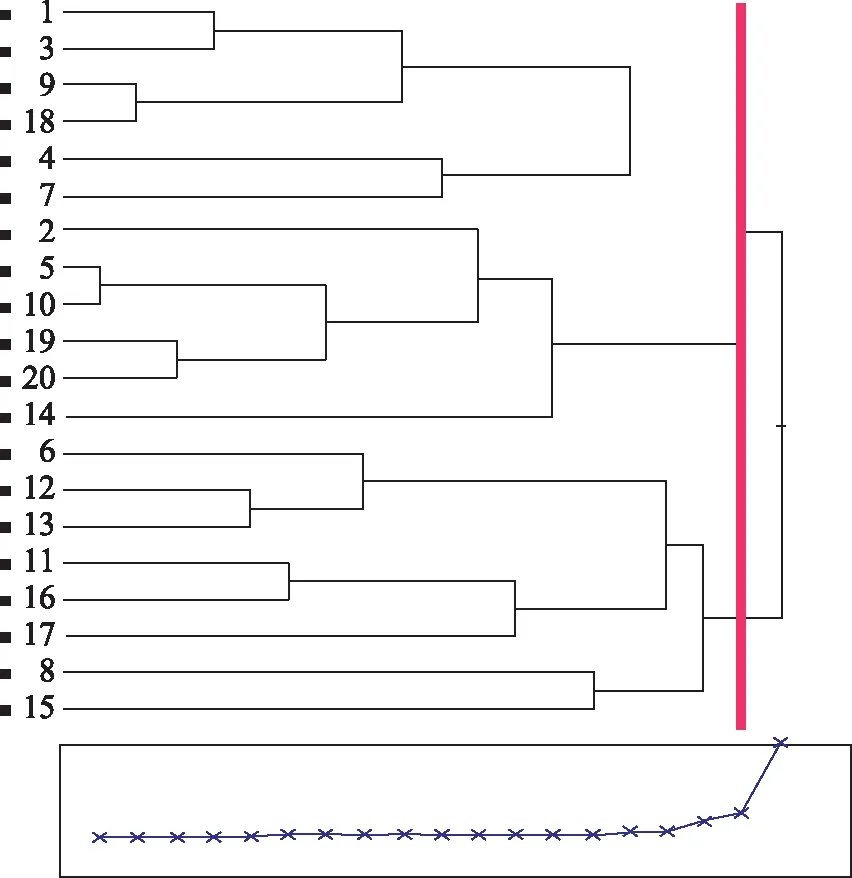
图1 20个居群珠子参的聚类分析树状图
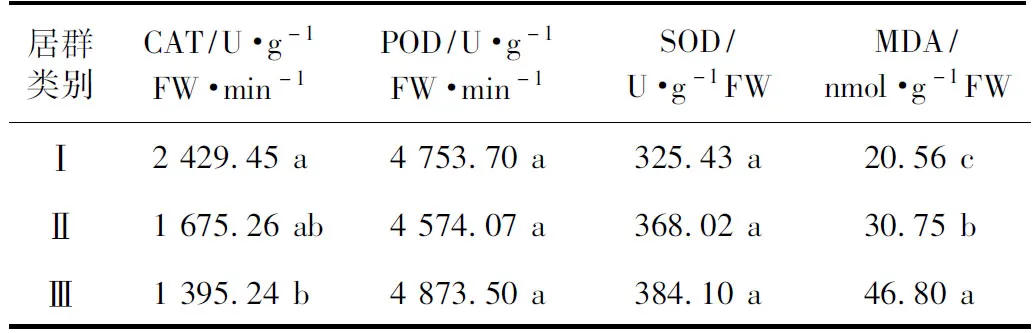
注:采用JMP7统计分析软件对数据进行差异显著性检验(Tukey法),同行数据后不同字母表示差异具有统计学意义,P< 0.05。
2.4 各类居群的保护酶活性和丙二醛含量与海拔高度间的关系
为了探讨各类居群的保护酶活性和丙二醛含量与海拔高度间的关系,将各类居群的CAT、POD、SOD活性和MDA含量分别与海拔高度进行分析,结果如图2、3、4。由图2-A,B,C 可以看出在海拔2600~3600 m范围内,第Ⅰ类居群的CAT、POD和SOD活性,随着海拔的升高呈二次凹函数关系,相关系数r分别为0.639 6、0.597 1和0.634 4;MDA含量与海拔高度间相关性较差(图2-D)。由图3-A,B,C,D可以看出,在海拔2600~3600 m范围内,第Ⅱ类居群的CAT、POD、SOD活性和MDA含量与海拔高度无相关性。由图4-A,C可以看出,在海拔2600~3600 m范围内,CAT和SOD活性与海拔呈正相关关系,相关系数r分别为0.377 9和0.526 2;POD活性与海拔呈负相关关系,相关系数r为0.506 9;(图4-B);MDA含量与海拔高度间无相关性(图4-D)。
3 讨论与结论
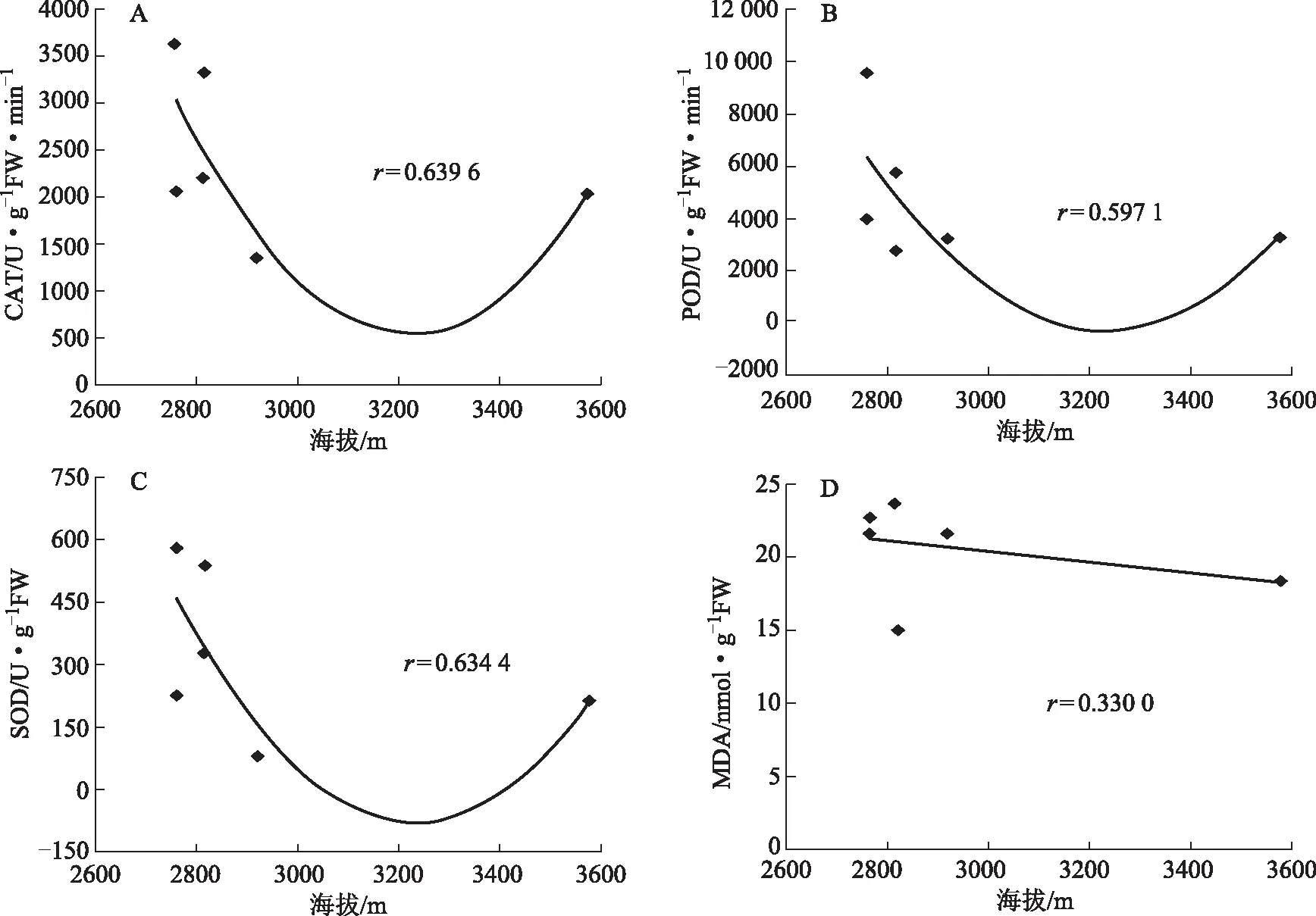
图2 第Ⅰ类居群的CAT、POD、SOD活性和MDA含量随海拔高度的变化情况
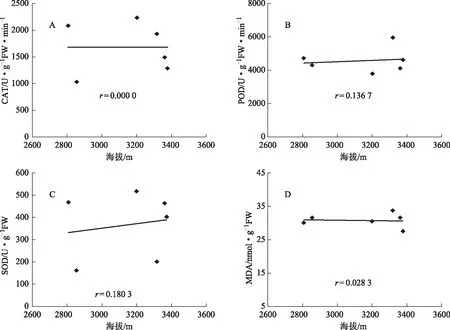
图3 第Ⅱ类居群的CAT、POD、SOD活性和MDA含量随海拔的变化
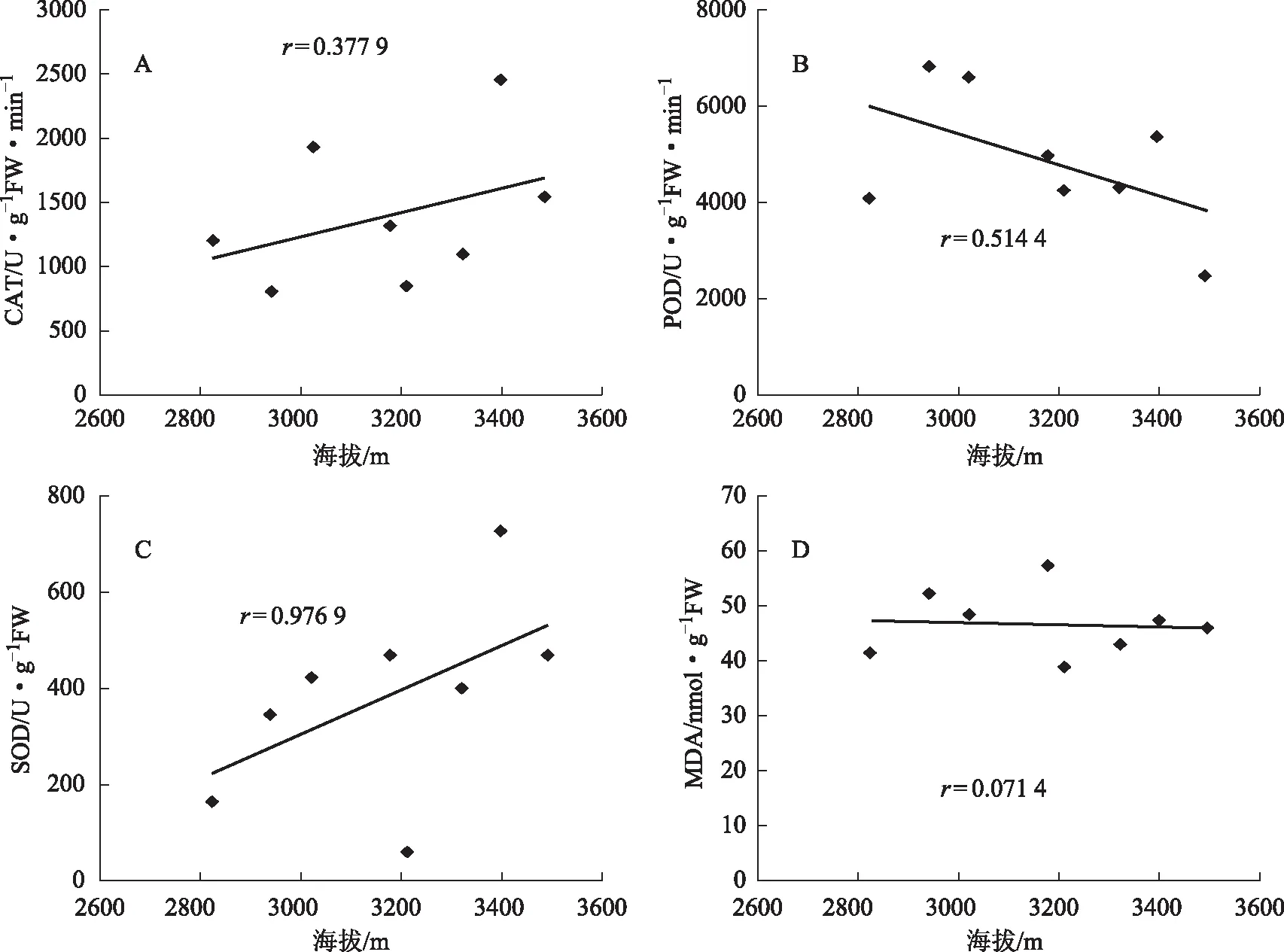
图4 第Ⅲ类居群的CAT、POD、SOD活性和MDA含量随海拔的变化
各种逆境对植物体的伤害大多与植物体内自由基代谢平衡有关。逆境能引起植物体内活性氧代谢紊乱,从而引起自由基的积累和膜脂过氧化,使膜系统的结构和功能受到损伤,造成植物细胞伤害,其中表现之一就是细胞中MDA含量的增加[13]。相应地植物体内也形成复杂的抗氧化系统,保护植物免受活性氧伤害[14-16]。SOD被认为是植物体内氧代谢的关键酶,它的活力变化直接影响植物体内O2-与H2O2的含量;POD是活性较高的适应性酶,是细胞中降解活性氧(ROS)的保护酶复合物的一员,其主要作用是清除H2O2以保护细胞;CAT主要存在于植物的过氧化物体(或乙醛酸循环体)中,主要功能是清除光呼吸或脂肪酸β-氧化过程中形成的H2O2。活性氧的清除涉及一系列细胞代谢和酶促反应过程,由非酶保护系统和酶保护系统的成员协同作用使细胞内的活性氧维持在较低水平,确保植物正常生长和代谢[17]。SOD、POD和CAT是保护酶系统的主要酶,SOD、POD和CAT协同作用可降低其对膜脂的攻击,其活性的高低可反映植物对环境条件适应能力的强弱[18-21]。
在经纬度和海拔等自然梯度上,气候、植被和土壤等环境因子具有明显的和系统性的变化规律。其中,海拔梯度是一复合梯度,海拔高低不同,有可能造成不同地区光、温、水、气、肥的巨大差别,从而影响植物生长[22]。Wildi和Lütz认为,植物体内保护物质对海拔的变化有着各自不同的响应模式[23]。
本研究从珠子参的保护酶活性和膜质过氧化水平对20个居群珠子参进行聚类分析,然后分析各类居群对海拔梯度的响应特性。结果表明,20个居群珠子参可分为3个类群,随着海拔高度的升高,各类居群的保护酶活性和丙二醛含量表现出不同的响应特性。第Ⅰ类居群的保护酶CAT、POD和SOD活性随着海拔的升高呈现“高-低-高”的变化趋势。这表明当海拔相对较低时,珠子参植株体内CAT、POD和SOD活性增强,能有效地清除体内由生态因子胁迫而产生的活性氧,保护细胞免受伤害。随着海拔升高,生态条件适合珠子参生长而改变代谢途径使产生的活性氧自由基降低,CAT、POD和SOD活性也随之降低,说明该类居群珠子参植株具有性喜冷凉的生物学特性。当海拔较高时,CAT、POD和SOD活性又呈增强的趋势,这可能是由于在高海拔条件下温度下降,较低的土壤温度影响了珠子参植物根系对土壤水分的吸收能力,受到了较严重的水分胁迫等不利因素的影响,抗逆酶活性诱导增强,这与陈晓莉等在祁连圆柏上的研究结果类似[24]。在海拔2600~3600 m范围内,随着海拔的升高,CAT、POD、SOD活性表现出相同的变化趋势,这表明三种抗氧化酶具有较强的协同作用关系,能及时有效地清除由于海拔改变而产生的活性氧自由基,使得MDA含量保持在较低水平,三个抗氧化保护酶的协同作用与该类居群的抗逆性和对环境的适应性密切相关,可能是珠子参居群适应环境胁迫的重要生理机制之一。第Ⅱ类居群,随着海拔的升高,CAT、POD、SOD活性和MDA含量随海拔高度变化的规律不明显,这表明在海拔2600~3600 m范围内,由于生态因子变化并未使得该类居群的保护酶活性等方面发生明显变化,海拔可能不是最主要的影响因子。第Ⅲ类居群,在海拔2600~3600 m范围内,CAT和SOD活性与海拔高度呈正相关关系,POD活性与海拔高度呈负相关关系;MDA含量随海拔高度变化的规律不明显,但其含量显著大于第Ⅰ和Ⅱ类居群。这表明,随着海拔的升高该类居群的CAT、SOD的活性有一定的增加,但CAT活性显著小于第Ⅰ类居群,POD活性下降,三种抗氧化酶系统的协同作用小,对清除活性氧自由基的作用减弱,因此膜质过氧化程度较高,生态适应性差。
综合本次研究表明,随着海拔的升高,3类居群珠子参植株对由海拔引起的生态因子变化的适应能力不同,第Ⅰ类居群的膜质过氧化程度最低,生态适应性较好;第Ⅲ类的膜质过氧化程度最高,生态适应性较差。保护酶CAT、POD和SOD活性随着海拔的升高也表现出不同的响应特性,因此,从抗氧化系统和膜质过氧化水平角度对珠子参居群进行分类,并研究各类居群对海拔变化的响应特性,探讨其生态适应性机制,可为珠子参的引种驯化和栽培的生态适应性提供理论参考。此外,20个居群珠子参的生理特征并没有完全依地理距离而聚类,即珠子参居群间生理特征的变异存在不连续性,这可能是生活在不同生境中的珠子参在形态等方面发生了适应性变化,在生理特征方面也同样发生了变异,这与麻栎不同种源表型性状聚类分析的结果与其种源地理分布的相关性不明显[25]与云南含笑6个天然居群的表型性状并没有严格依地理距离而聚类[26]的研究结果类似。